鋁脅迫下添加水楊酸對黑麥草生理及葉綠素熒光參數的影響
王棟麟,王琳,吳亞,張漢林,劉大林
(1.揚州大學動物科學與技術學院,江蘇 揚州 225009;2.揚州大學農業科技發展研究院(國際聯合實驗室),江蘇 揚州 225009)
多花黑麥草(Loliummultiforum)是禾本科植物,既可作為草坪建植的草坪草,還可作為飼喂家畜的牧草,是不可多得的多功能型牧草[1],種植培育多花黑麥草對我國南方牧草發展具有重要意義。近年來隨著工業廢水的排放、大氣的酸沉降以及酸性化肥的大量使用,部分地區的土壤pH值不斷降低,我國酸性土壤面積已占土壤總面積的兩成以上,且在我國南方地區分布廣泛[2]。在酸性土壤中,Al3+對植物產生直接毒害的同時也間接影響了植物對養分的吸收[3],Al3+通過降低植物根尖細胞壁的剛性,抑制細胞伸長,從而影響根系生長[4-5]。同時降低了植物體內葉綠素含量和光合速率,導致植物干物質減少和產量降低[6],降低蛋白質合成酶活性,可溶性蛋白的含量[7]。因此,有效緩解酸性土壤中鋁脅迫對多花黑麥草等草坪草的毒害作用已成為亟須解決的問題。
水楊酸(SA)作為一種信號分子以及酚類內源性生長調節劑,廣泛存在于植物體內,可參與植物多種生理響應機制以增強植物對逆境脅迫的耐受性。已有研究表明,SA能夠誘導逆境相關基因的表達并調節細胞抗氧化機制[8],還可以誘導植物系統性抗性(SAR)的產生、調控植物的光合作用[9]。因此,本研究選取多花黑麥草作為試驗材料,探究添加SA對鋁脅迫下多花黑麥草生理指標的影響,以期為利用SA緩解酸性土壤中鋁脅迫對多花黑麥草的毒害提供一定的科學依據。
1 材料和方法
1.1 試驗材料
試驗材料為多花黑麥草品種Nagahahikari和特高,均來自揚州大學草業科學種子庫。
1.2 試驗方法
本試驗采用砂培盆栽法,播種后將其置于恒溫25 ℃,14 h/10 h光暗的光照培養箱中培養3周后進行試驗處理。預試驗顯示當Al3+濃度為20 mmol/L時可顯著影響黑麥草生長,因此本試驗設置Al3+濃度為20 mmol/L,共設6個處理:①僅添加營養液,記為CK SA0;②添加0.3 mmol/L的SA,記為CK SA0.3;③添加0.6 mmol/L的SA,記為CK SA0.6;④添加20 mmol/L Al3+(Al3+由AlCl3·6H2O提供),記為Al SA0;⑤添加20 mmol/L Al3+和0.3 mmol/L的SA,記為Al SA0.3;⑥添加20 mmol/L Al3+和0.6 mmol/L的SA記為Al SA0.6;持續處理3 d后培養至第7天時采樣,3次重復。
1.3 測定指標和方法
直尺測株高和根長(精確到0.1 cm),分析天平稱量地上生物量和地下生物量(精確到0.001 g)。分光光度計法測葉綠素含量、浸泡法測相對電導率,硫代巴比妥酸法測丙二醛(MDA)含量,蒽酮法測可溶性糖含量,考馬斯亮藍法測可溶性蛋白含量,氮藍四唑染色法測超氧化物歧化酶活性(SOD),以上測定指標均參考施海濤[10]的試驗方法。采用POD、CAT測試盒(南京建成生物工程研究所)比色法測POD和CAT活性。參考賀建華等[11]的方法測鋁離子含量。采用PAM2500(Heinz Walz GmbH)測定葉綠素熒光參數,使用Yusuf等描述的JIP測試方法和計算公式分析OJIP瞬時曲線[12-14]。
1.4 數據處理
數據用Excel 2016計算,通過SPSS 19.0進行單因素方差分析,通過Duncan法進行多重比較,用獨立樣本T檢驗進行差異性檢測,最后用Excel 2016作圖。
2 結果與分析
2.1 鋁脅迫下添加水楊酸對黑麥草生長特征的影響
各種處理下,株高差異不顯著(P>0.05)(圖1)。

圖1 鋁脅迫下添加水楊酸兩種黑麥草的生長株高、根長和生物量
Al SA0處理黑麥草的根長相比CK SA0極顯著降低(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理黑麥草根長均顯著提高(P<0.05),Al SA0.3和Al SA0.6中Nagahahikari的地上生物量顯著提高(P<0.05)。與CK SA0相比,CK SA0.6處理黑麥草的地下生物量均顯著提高(P<0.05),Al SA0處理兩個黑麥草品種的地下生物量極顯著降低(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理兩個黑麥草品種的地下生物量顯著提高(P<0.05)。
2.2 鋁脅迫下添加外源水楊酸對黑麥草葉綠素含量的影響
相比CK SA0,CK SA0.6中Nagahahikari的葉綠素a、b含量以及葉綠素總量顯著提高(P<0.05),CK SA0.3和CK SA0.6處理特高的葉綠素a、b含量以及葉綠素總量均有提高但不顯著(P>0.05),Al SA0處理兩個黑麥草的葉綠素a含量和葉綠素總量極顯著降低(P<0.01),葉綠素b含量顯著降低(P<0.05)。與Al SA0相比,Al SA0.3和Al SA0.6中葉綠素a含量、葉綠素b含量和葉綠素總量均隨著SA濃度的提高而提高,且在Al SA0.6中兩種黑麥草的葉綠素a含量、葉綠素b含量和葉綠素總量顯著提高(P<0.05)(圖2)。

圖2 鋁脅迫下添加水楊酸對兩種黑麥草的葉綠素含量
2.3 鋁脅迫下添加水楊酸黑麥草的葉綠素熒光特性
相比CK SA0,CK SA0.3和CK SA0.6處理下兩種黑麥草的OJIP熒光強度均較高,其中CK SA0.6的OJIP熒光強度要高于CK SA0.3。Al SA0處理兩種黑麥草的OJIP熒光強度均低于CK SA0。Al SA0.3和Al SA0.6處理兩種黑麥草的OJIP熒光強度均高于Al SA0,且Al SA0.6處理的OJIP熒光強度要高于Al SA0.3(圖3)。

圖3 鋁脅迫下添加水楊酸對兩種黑麥草的OJIP熒光曲線
與CK SA0相比,CK SA0.6處理特高的Fo值顯著提高(P<0.05)。與CK SA0相比,Al SA0中Nagahahikari的Fo值極顯著降低(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理兩種黑麥草的Fo值顯著提高(P<0.05);與CK SA0相比,CK SA0.6處理Nagahahikari的Fj值顯著提高(P<0.05),CK SA0.3中特高的Fj值顯著提高(P<0.05)。對比CK SA0,Al SA0處理兩種黑麥草的Fj值極顯著降低(P<0.01)。
與Al SA0相比,Al SA0.3和Al SA0.6處理下Nagahahikari的Fj值顯著提高(P<0.05),且Fj值隨SA濃度的提高而提高;對比CK SA0,CK SA0.6處理兩種黑麥草的Fi值均顯著提高(P<0.05),Al SA0處理兩種黑麥草的Fi值極顯著降低(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理Nagahahikari的Fi值顯著提高(P<0.05),且Fi值隨SA濃度的提高而提高;與CK SA0相比,CK SA0.3和CK SA0.6處理兩種黑麥草的Fm值顯著提高(P<0.05),且隨SA濃度的提高而提高。對比CK SA0,Al SA0處理兩種黑麥草的Fm值極顯著降低(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理兩種黑麥草的Fm值顯著提高(P<0.05),且隨SA濃度的提高而提高;與CK SA0相比,CK SA0.6處理兩種黑麥草的F300 μs值顯著提高(P<0.05),Al SA0處理Nagahahikari的F300 μs值極顯著降低(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理Nagahahikari的F300μs值顯著提高(P<0.05)(表1)。
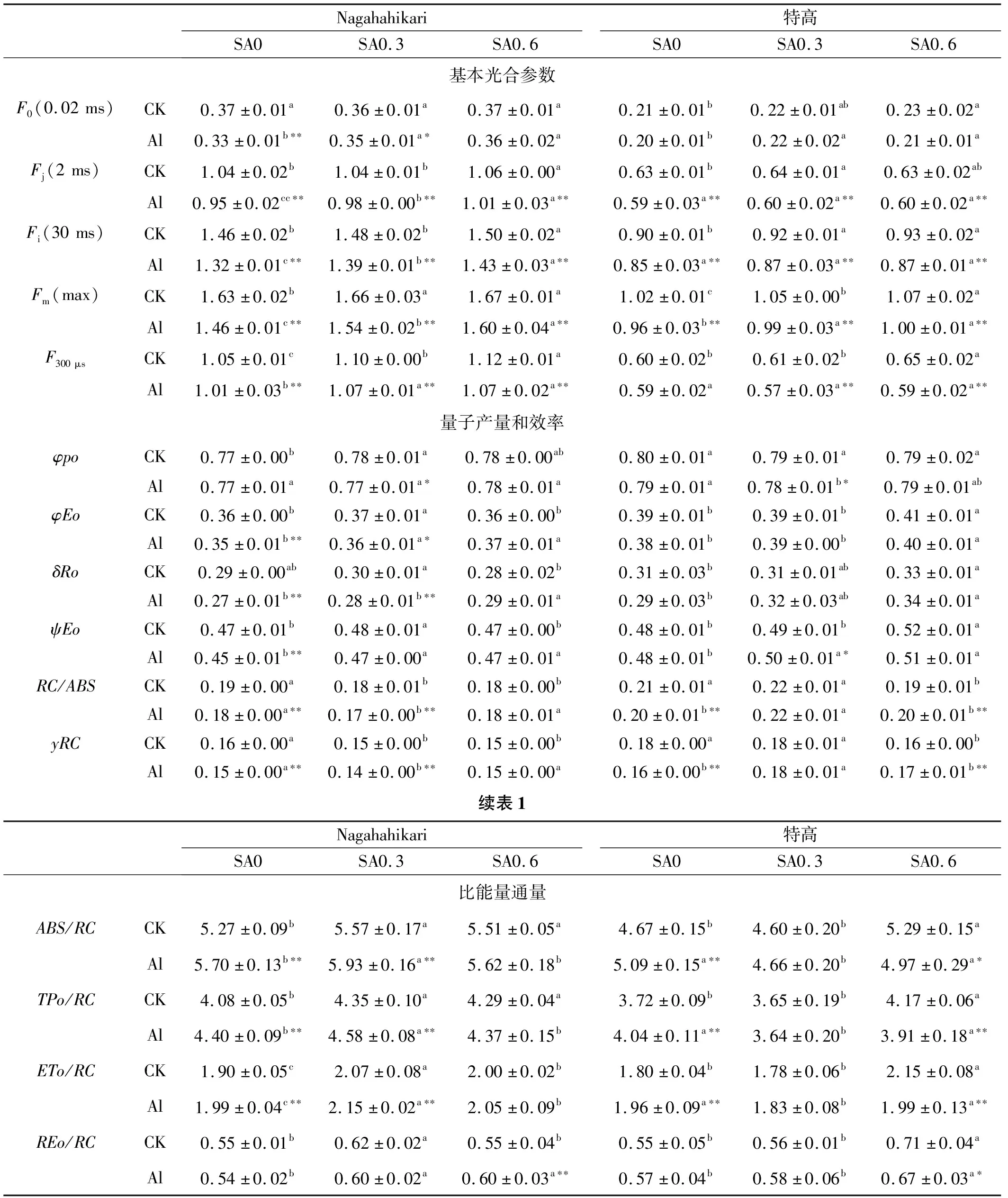
表1 鋁脅迫下添加外源水楊酸對兩種黑麥草熒光參數的影響
與CK SA0相比,Al SA0處理Nagahahikari的φEo、δRo、ψEo、RC/ABS和yRC值極顯著降低(P<0.01),特高的RC/ABS和yRC值極顯著降低(P<0.01)。與Al SA0相比,Al SA0.6處理Nagahahikari的φpo、φEo、δRo和ψEo值顯著提高(P<0.05),特高的φEo、δRo和ψEo值顯著提高(P<0.05),Al SA0.3處理Nagahahikari的RC/ABS和yRC值顯著降低(P<0.05),特高的RC/ABS和уRC值顯著提高(P<0.05)。
與CK SA0相比,CK SA0.3處理Nagahahikari的ABS/RC、TPo/RC、ETo/RC和REo/RC值顯著提高(P<0.05),CK SA0.6處理特高的ABS/RC、TPo/RC、ETo/RC和REo/RC值顯著提高(P<0.05),Al SA0處理兩種黑麥草的ABS/RC、TPo/RC和ETo/RC值極顯著提高(P<0.01)。與Al SA0相比,Al SA0.3處理Nagahahikari的ABS/RC、TPo/RC和ETo/RC值顯著提高(P<0.05),而特高的ABS/RC、TPo/RC和ETo/RC值顯著降低(P<0.05),Al SA0.6處理兩種黑麥草的REo/RC值均顯著提高(P<0.05)。
CK SA0.3和CK SA0.6處理兩種黑麥草的PIABS值與CK SA0相比無顯著性差異(P>0.05)。與CK SA0相比,Al SA0處理Nagahahikari的PIABS值極顯著降低(P<0.01),特高的PIABS值顯著降低(P<0.05)。與Al SA0相比,Al SA0.6處理兩種黑麥草的PIABS值顯著提高(P<0.05)(圖4-A),CK SA0.3和CK SA0.6處理兩種黑麥草的PItotal值與CK SA0相比無顯著性差異(P>0.05)。與CK SA0相比,Al SA0處理Nagahahikari的PItotal值極顯著降低(P<0.01),特高的PItotal值顯著降低(P<0.05)。與Al SA0相比,Al SA0.6處理兩種黑麥草的PItotal值顯著提高(P<0.05),分別提高了23.13%和33.50%(圖4-B)。
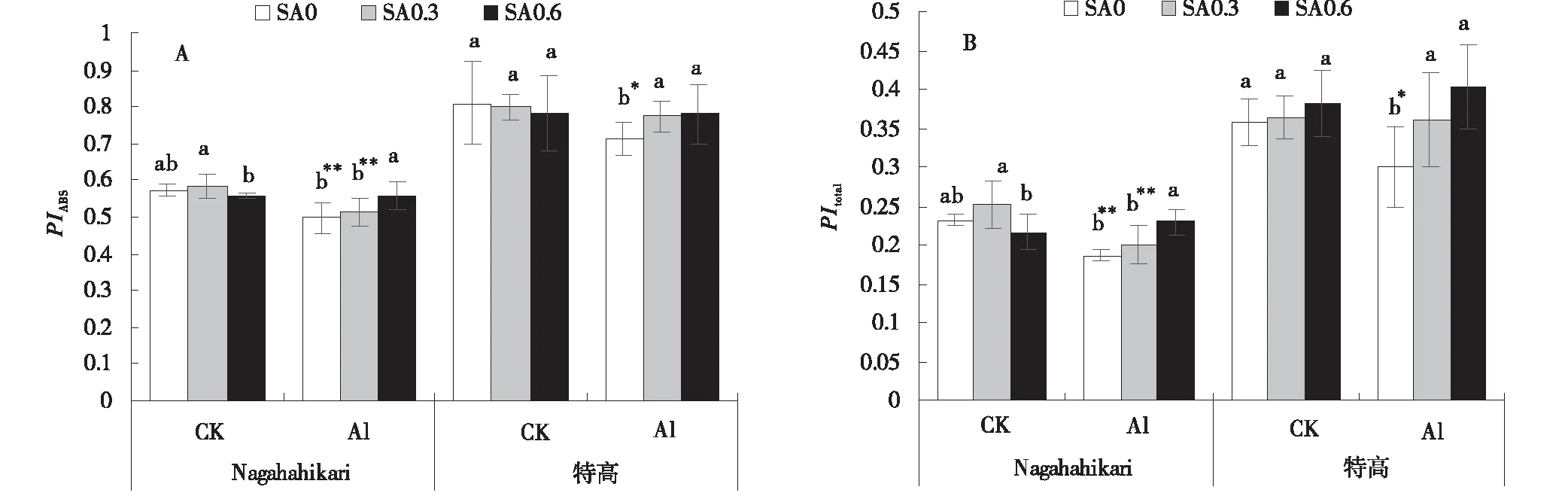
圖4 鋁脅迫下添加水楊酸對兩種黑麥草的熒光性能參數
2.4 鋁脅迫下添加水楊酸對黑麥草處理下可溶性糖和可溶性蛋白的影響
與CK SA0相比,CK SA0.3和CK SA0.6中兩種黑麥草的可溶性糖含量顯著提高(P<0.05),Al SA0中Nagahahikari的可溶性糖含量顯著提高(P<0.05),而特高的可溶性糖含量雖然提高但不顯著(P>0.05)。Al SA0.3中Nagahahikari的可溶性糖含量顯著低于Al SA0和Al SA0.6中Nagahahikari的可溶性糖含量(P<0.05)。與Al SA0相比,Al SA0.3和Al SA0.6中特高的可溶性糖含量顯著提高(P<0.05),且隨SA濃度的提高而提高(圖5-A)。
與CK SA0相比,CK SA0.3和CK SA0.6中Nagahahikari的可溶性蛋白含量顯著提高(P<0.05),且隨SA濃度的升高而升高。與CK SA0相比,Al SA0中兩種黑麥草的可溶性蛋白含量顯著提高(P<0.05)。與Al SA0相比,Al SA0.6中Nagahahikari的可溶性蛋白顯著提高(P<0.05),AlSA0.3和Al SA0.6中特高的可溶性蛋白含量隨著SA濃度的升高而降低,但不顯著(P>0.05)(圖5-B)。

圖5 鋁脅迫下添加水楊酸兩種黑麥草的可溶性糖和可溶性蛋白含量
2.5 鋁脅迫下添加外源水楊酸對黑麥草過氧化指標的影響
與CK SA0相比,CK SA0.6中兩種黑麥草的相對電導率顯著降低(P<0.05),Al SA0中兩種黑麥草的相對電導率極顯著提高(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6中Nagahahikari的相對電導率顯著降低(P<0.05),且隨著SA濃度的升高而降低,Al SA0.6中特高的相對電導率顯著降低(P<0.05)(圖6-A)。
由圖6B可知,與CK SA0相比,CK SA0.3和CK SA0.6中兩種黑麥草的MDA含量顯著降低(P<0.05),且MDA含量隨著SA濃度的提高而降低,Al SA0中兩種黑麥草的MDA含量均極顯著提高(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6中兩種黑麥草的MDA含量顯著降低(P<0.05),且MDA含量隨著SA濃度的提高而不斷降低(圖6-B)。
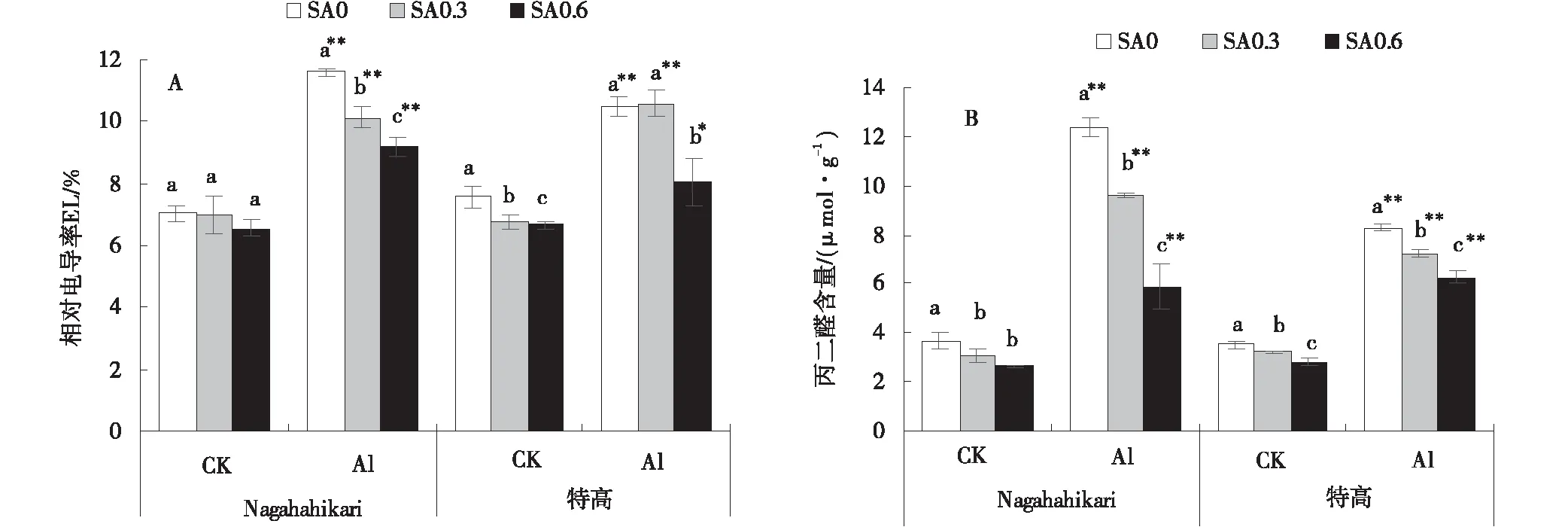
圖6 鋁脅迫下添加水楊酸兩種黑麥草的相對電導率和MDA含量
2.6 鋁脅迫下添加水楊酸對黑麥草SOD、POD和CAT活性的影響
SOD活性均隨著SA濃度的提高而提高,其中與CK SA0相比,CK SA0.3和CK SA0.6處理下兩種黑麥草的SOD活性顯著提高(P<0.05),Al SA0處理下兩種黑麥草的SOD活性極顯著提高(P<0.01)。與Al SA0相比,Al SA0.6處理下兩種黑麥草SOD活性均顯著提高(P<0.05)(圖7-A)。
與CK SA0相比,CK SA0.3和CK SA0.6處理下Nagahahikari的POD活性顯著提高(P<0.05),CK SA0.3和CK SA0.6處理下特高的POD活性隨SA濃度的升高而降低但差異不顯著(P>0.05),Al SA0處理下Nagahahikari的POD活性顯著提高(P<0.05),特高的POD活性極顯著提高(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理下兩種黑麥草的POD活性均隨著SA濃度的升高而升高,且差異顯著(P<0.05)(圖7-B)。
與CK SA0相比,CK SA0.3處理下Nagahahikari的CAT活性顯著提高(P<0.05),特高的CAT活性隨SA濃度的升高而降低但差異不顯著(P>0.05),Al SA0處理下兩種黑麥草的CAT活性均極顯著提高(P<0.01)。與Al SA0相比,Al SA0.3和Al SA0.6處理下Nagahahikari的CAT活性且隨著SA濃度的升高而降低且差異顯著(P<0.05),特高的CAT活性隨著SA濃度的升高而升高但差異不顯著(P>0.05)(圖7-C)。
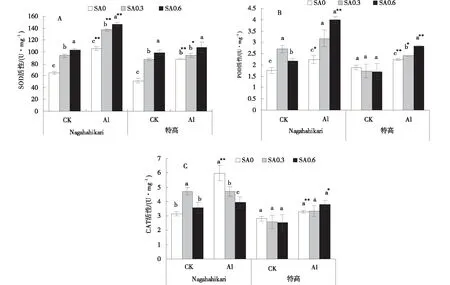
圖7 鋁脅迫下添加水楊酸兩種黑麥草的SOD、POD和CAT活性
2.7 鋁脅迫下添加水楊酸對黑麥草Al3+富集量的影響
對比CK SA0,CK SA0.6處理下兩種黑麥草的地上部Al3+含量顯著降低(P<0.05),Al SA0處理下兩種黑麥草的地上部Al3+含量極顯著升高(P<0.01)。與Al SA0相比,Al SA0.6中Nagahahikari的地上部Al3+含量顯著降低(P<0.05),Al SA0.3和Al SA0.6中特高的地上部Al3+含量顯著降低(P<0.05)(圖8-A)。

圖8 鋁脅迫下添加水楊酸兩種黑麥草的地上部和根中Al3+含量
對比CK SA0,CK SA0.6處理下兩種黑麥草的根系Al3+含量顯著降低(P<0.05),Al SA0處理下兩種黑麥草的根系Al3+含量極顯著提高(P<0.01)。與Al SA0相比,Al SA0.6處理下兩種黑麥草的根系Al3+含量顯著降低(P<0.05)(圖8-B)。
3 討論
本研究發現,黑麥草在鋁脅迫下根長和地下生物量顯著降低(P<0.05),其原因可能在于Al3+最先進入植物的部位是植物根系,根系吸收的Al3+大部分殘留在根系組織里,向莖葉中運輸較少[15],導致黑麥草的根部生長受到明顯抑制,進而影響到地下生物量。SA作為植物體內普遍存在的一種內源性信號分子,可作為植物抗逆反應所需的信號分子來激活植物防御保護機制,在植物的抗逆過程中起著關鍵作用[16]。鋁脅迫下添加0.3 mmol/L和0.6 mmol/L的外源SA時,能夠促進黑麥草的根生長以及地上和地下生物量的提高,其中SA濃度為0.6 mmol/L時效果顯著(P<0.05)。其原因可能是添加的SA促進黑麥草分泌更多的有機酸,然后有機酸中的陰離子與Al3+產生螯合作用,合成為沒有生物毒性或生物毒性較低的絡合物[17],從而達到減輕鋁毒害的作用。此外,研究發現添加適宜濃度的SA降低了黑麥草的地上和地下部的鋁含量,該結果與Pandey[18]的研究結果一致,證明SA能夠降低黑麥草對Al3+的吸收和富集能力。
葉綠素作為植物中參與光合作用的重要色素,其含量的高低與光合作用以及植物受脅迫的程度密切相關[9]。本研究發現,僅鋁脅迫處理下黑麥草的葉綠素含量顯著低于對照組(P<0.05),這與初曉輝[19]的研究結果一致。其原因可能是黑麥草體內的Al3+與Mg2+在ATP結合點位上進行競爭,且Mg2+與ATP結合能力要弱于Al3+,導致黑麥草體內葉綠素合成原料匱乏,使得黑麥草體內的葉綠素含量降低。此外本研究還發現,對照和鋁脅迫下添加0.6 mmol/L的SA能顯著提高黑麥草的葉綠素含量(P<0.05),這與唐艷萍等[20]的研究結果一致。可能是由于SA通過降低黑麥草對Al3+的吸收和富集能力,導致黑麥草體內的Al3+含量降低,減弱鋁脅迫的Al3+和Mg2+在ATP結合位點上的競爭能力,最終緩解了黑麥草葉綠體受鋁毒害的影響。
葉綠素熒光特性可以反映植物光合生理與逆境脅迫的關系[21]。程曉晴[4]研究發現,SA提高了鋁脅迫苜蓿的葉綠素含量和凈光合速率,增大了PS I、PS II的有效量子產率。本研究發現,添加SA提高了鋁脅迫下黑麥草的OJIP熒光瞬態強度,對OJIP曲線進行JIP檢驗,結果表明鋁脅迫下添加適宜濃度的SA能夠提高黑麥草的Fo值和Fm值,提高φEo、δRo和ψEo值,有效保護了光系統的能量傳遞過程。可能是由于SA促進了鋁脅迫下黑麥草葉綠體的合成,提高了黑麥草葉綠體含量,從而提高了光能轉換效率。證明鋁脅迫下添加適宜濃度的SA能提高黑麥草的光合性能。此外,SA對鋁脅迫下不同的黑麥草品種光合作用以及光化學系統的影響存在差異,本研究中,對鋁脅迫下黑麥草Nagahahikari的緩解效果較好。
逆境條件下植物器官會發生膜脂過氧化,MDA作為膜脂過氧化指標,其含量的提高是活性氧毒害作用的表現,SOD、POD和CAT則主要對清除植物體內活性氧起著重要作用。研究發現,黑麥草的MDA含量受鋁脅迫影響顯著升高(P<0.05),SOD、POD和CAT活性顯著提高(P<0.05),該結果與周媛的研究結果一致[22]。可能由于鋁脅迫能夠誘導黑麥草體內產生大量的活性氧(Reactive oxygen species;ROS),黑麥草為適應鋁脅迫環境,會提高抗氧化酶活性和激活抗氧化酶系統,從而清除體內多余的ROS,使得ROS維持相對平衡狀態[23-24]。本研究還發現,鋁脅迫下添加0.6mmol/L的SA能顯著降低MDA含量(P<0.05),并提高SOD和POD活性,這與張永福等[25]研究結果一致。其原因可能是適宜濃度的SA能夠誘導黑麥草體內抗氧化系統啟動以保護蛋白表達,消除過量的ROS并保護細胞膜的完整性從而減輕應激損傷。
可溶性糖作為植物體內重要的滲透調節物質,能為細胞提供能量,保持細胞滲透勢[26]。結果表明鋁脅迫下黑麥草的可溶性糖含量高于對照組,其原因可能是在逆境脅迫下,植物為保持細胞滲透壓,維持植株正常的新陳代謝,會將蔗糖水解為葡萄糖和果糖,從而提高可溶性糖含量[27]。鋁脅迫下添加SA能夠提高黑麥草特高的可溶性糖含量,其原因可能是SA能夠通過增強植物的光合能力,提高葉綠素含量從而保護光合系統,促進了碳水化合物的積累。
4 結論
鋁脅迫下添加SA能促進黑麥草根伸長,提高地下生物量以及降低植物體內Al3+的富集量;保護光合原件,提高光合性能以及葉綠素含量;降低MDA含量,提高SOD與POD活性。其中0.6 mmol/L濃度的SA效果較好,且SA對不同黑麥草品種間的緩解效果存在差異。

