SHH信號通路在骨髓增生異常綜合征中的表達及SMO抑制劑對MUTZ-1細胞的作用研究*
姚柳,趙芳,秦玉婷,王歡,尼羅帕爾·吐爾遜,陳雙,帕提古麗·阿不力孜,郝建萍
[新疆醫科大學第一附屬醫院 血液病中心(新疆維吾爾自治區血液病研究所),新疆 烏魯木齊830054]
骨髓增生異常綜合征(myelodysplastic syndrome,MDS)是一組異質性髓系克隆性疾病,其特點是髓系細胞發育異常,表現為無效造血、難治性血細胞減少、高風險向急性髓系白血病轉化[1]。MDS 的發病機制仍然不明確,可能與多基因累積突變,癌基因與抑癌基因異常,造血干細胞、祖細胞增殖分化和凋亡行為異常,以及免疫功能紊亂等多種因素有關[2-3]。造血干細胞移植是目前唯一有潛力的治療方法,但是,只有很少的患者接受造血干細胞移植。靶向表觀遺傳途徑逆轉抑癌基因的病理性失活是MDS 的另一種治療可能性。該方法具有侵襲性和細胞毒性,并且隨著治療時間的推移,部分患者的療效會逐漸降低,耐藥現象普遍存在[4-6]。因此,迫切需要替代的低毒療法。研究表明,Hedgehog(HH)是多種人類癌癥發病機制中的關鍵介質,HH 信號在白血病干細胞的自我更新和維持腫瘤干細胞中發揮重要作用,其異常激活與腫瘤的發生、侵襲和轉移密切相關[7-8]。HH 基因家族包括 Sonic Hedgehog (SHH)、 Desert Hedgehog(DHH)和Indian Hedgehog(IHH)3 種同源基因,分別編碼相應的分泌型蛋白作為HH 信號通路的配體,其中SHH 信號通路與人類關系最密切,其由SHH、Patched、Smoothened(SMO)和Gli4 種基因組成,分別編碼SHH 配體、Patched 受體、SMO 受體以及下游的轉錄因子Gli 家族蛋白[9]。跨膜受體Patched 包括Patched-1 和Patched-2 兩種亞型[10]。SHH 信號通路受SHH 蛋白調節呈雙相性:無SHH 配體時,Patched 與蛋白復合物結合,可觸發Caspase 依賴的細胞死亡途徑[11];存在SHH 配體時,Patched 釋放SMO,解除對SMO 的抑制,激活轉錄因子Gli-1、Gli-2、Gli-3 和下游靶基因,最終調節多種靶基因(Cyclin D1、Bcl-2、C-myc、Cyclin E和BMP 等)的表達,進而調控細胞的生長、增殖與分化[12-13]。SHH 信號通路作為HH 信號的重要分支,在血液腫瘤中發揮著重要作用,但在MDS 發生、發展中的作用研究較少。本研究旨在探討SHH 信號通路相關基因在MDS 中的表達,SMO 抑制劑Jervine 對人骨髓增生異常綜合征細胞MUTZ-1 增殖、凋亡及SHH 通路相關基因、蛋白表達的影響,現報道如下。
1 資料與方法
1.1 一般資料
選取2016年6月—2018年3月于新疆醫科大學第一附屬醫院血液病中心經骨髓細胞形態學、染色體R 顯帶分析、熒光原位雜交、流式細胞術檢查確診的53 例MDS 患者。其中,男性30 例,女性23 例;年齡15~88 歲,中位發病年齡67 歲;根據WHO 2016 分型標準[14]進行分型,MDS 伴單系病態造血(MDS-SLD)4 例,MDS 伴多系病態造血(MDS-MLD)12 例,MDS 伴 環形鐵粒幼細胞(MDS·RS)1 例,MDS 伴原始細胞增多Ⅰ型(MDS-EB-1)7 例,MDS伴原始細胞增多Ⅱ型(MDS-EB-2)29 例;依據國際預后積分系統(IPSS)[15]對患者預后分組:低危組2 例,中危1 組16 例,中危2 組21 例,高危組14 例。將低危組和中危1 組歸為相對低危組,中危2 組和高危組歸為相對高危組。選取同期該院25 例缺鐵性貧血患者作為正常對照組。本研究經醫院醫學倫理委員會批準,患者簽署知情同意書。
1.2 儀器、試劑與細胞
流式細胞儀(美國BD Bioscience 公司),磁珠分選儀(德國美天旎生物技術有限公司);羊抗人SHH 抗體、兔抗人SMO 抗體、羊抗人Patched-1 抗體、兔抗人Gli-1 抗體(美國Santa Cruz 公司),Trizol 試劑(美國Invitgen 公司),逆轉錄酶試劑(日本TaKaRa 公司),Jervine(英國Abcam 公司),兔二抗、鼠二抗(武漢博士德生物工程有限公司),10%胎牛血清(FBS)和1%青霉素-鏈霉素的RPMI 1640培養基(美國Gibco 公司),CCK-8 細胞計數試劑盒(上海碧云天生物技術有限公司),Annexin V-FITC/PI 試劑盒(南京凱基生物公司);MUTZ-1 細胞(上海通派生物科技有限公司)。
1.3 實驗方法
1.3.1 CD34+細胞分離 流式細胞儀檢測53 例MDS 患者骨髓單個核細胞中CD34+細胞的數量,磁珠分選儀分離CD34+細胞,分選的CD34+細胞純度在95%以上,有效率在90%以上。
1.3.2 實時熒光定量聚合酶鏈反應(qRT-PCR)檢測SHH、Patched-1、SMO 和Gli-1 mRNA 的相對表達量 抽取MDS 患者和正常對照組患者空腹肘正中靜脈血3~4 mL,12 000 r/min 離心15 min,取上清液。按照Trizol 試劑盒說明書步驟從血清中提取總RNA,按照逆轉錄酶試劑盒說明書步驟逆轉錄成cDNA,置于-20℃冰箱保存備用。擴增引物根據GeneBank 序列設計并由武漢巴菲爾生物技術公司合成,引物序列見表1。β-actin為內參基因。采用20 μL PCR 擴增體系,每孔加入SYBR Green Master Mix 10.0 μL,50×ROX Reference Dye 2 0.4 μL,高純水4.8 μL,正、反向引物各0.4 μL,cDNA 4.0 μL,每個樣本設3 個復孔。擴增反應條件:95℃預變性1 min、95℃變性15 s、60℃退火15 s、72℃延伸30 s,于72℃采集熒光信號,循環40 次。采用2-ΔΔCt法計算目的基因的相對表達量。

表1 引物序列
1.3.3 細胞培養和Jervine 干預 MUTZ-1 細胞系在含10% FBS 和1%青霉素-鏈霉素的RPMI 1640 培養基,37℃、5%二氧化碳培養箱中培養[16]。將溶解在DMSO溶液中終濃度為1 μ mol/L、5 μ mol/L、10 μmol/L 的Jervine 加入對數生長期的MUTZ-1 細胞中,共孵育24 h。
1.3.4 CCK-8法檢測細胞增殖活性 收集MUTZ-1細胞,按照5×104個/mL 接種于96 孔板,每孔接種100 μL 細胞懸液,分別加入0 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L Jervine,37℃、5%二氧化碳飽和濕度培養箱中培養24 h,加入10 μL CCK-8,37℃培養4 h,在酶標儀450 nm 波長處測定吸光度值。進行3 次獨立重復實驗,計算細胞活力變化情況。不含細胞只含培養基為空白組,Jervine 0 μmol/L為對照組,Jervine 1 μmol/L、Jervine 5 μmol/L、Jervine 10 μmol/L 為實驗組,計算增殖率,增殖率=(實驗組吸光度值-空白組吸光度值)/(對照組吸光度值-空白組吸光度值)×100%。
1.3.5 流式細胞術檢測細胞凋亡率 用0 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L Jervine 處理MUTZ-1細胞,每孔總體積為3 mL。37℃、5%二氧化碳飽和濕度的培養箱中培養24 h 后,收集細胞,嚴格按照Annexin V-FITC/PI 試劑盒說明書操作,通過流式細胞儀檢測細胞凋亡率。實驗重復3 次,取平均值進行統計分析。
1.3.6 qRT-PCR 檢 測MUTZ-1細胞的SMO 和Gli-1 mRNA的相對表達量 用Trizol試劑從MUTZ-1細胞中提取總RNA,用逆轉錄酶試劑逆轉錄成cDNA,引物序列同表1。反應條件和計算方法同1.3.2。
1.3.7 Western blotting 法檢測SMO、Gli-1、Bcl-2、Caspase-3、Cyclin D1 蛋白相對表達量 用RIPA 裂解液提取MUTZ-1 細胞總蛋白,每次取20 μL 總蛋白進行SDS-PAGE 凝膠電泳(80 V 40 min,120 V 60 min),將蛋白從SDS-PAGE 膠上轉印至PVDF 膜(100 V 120 min)。5%脫脂奶粉封閉2 h。β-actin 為內參。按 照1∶500 稀 釋Gli-1,按 照1∶1 000 稀 釋SMO、Caspase-3, 1∶2 000 稀 釋Bcl-2, 1∶5 000 稀 釋Cyclin D1,1∶200 稀釋β-actin,4℃孵育過夜,按照1∶50 000 稀釋兔二抗和鼠二抗,37℃孵育2 h,隨后顯色底物顯影。
1.4 治療方案
相對低危組以沙利度胺、環孢素、雄激素治療為主,聯合間斷輸血。相對高危組根據患者意愿分別輸血、給予地西他濱或預激化療。
1.5 隨訪
所有患者隨訪到死亡或2018年3月30日。總生存期(OS)為從確診到死亡的時間或2018年3月30日。隨訪數據從醫院記錄中獲得,或者通過電話采訪患者或其家人獲得。
1.6 統計學方法
數據分析采用SPSS 23.0 統計軟件。2-ΔΔCt法分析基因的相對表達量,結果不服從正態分布,做對數轉換為正態分布后進行統計學分析。方差齊時,計量資料用均數±標準差(±s)表示,多組比較采用方差分析,進一步兩兩比較采用LSD-t法;方差不齊時,計量資料用中位數(上四分位數,下四分位數)[M(P25,P75)]表示。用Kaplan-Meier 法繪制生存曲線,比較用Log rank χ2檢驗。采用Pearson 法做相關性分析。P<0.05 為差異有統計學意義。
2 結果
2.1 3組患者SHH、Patched-1、SMO 和Gli-1 mRNA相對表達量的比較
3 組患者SHH 和Patched-1 mRNA 相對表達量比較,差異無統計學意義(P>0.05)。3 組患者SMO 和Gli-1 mRNA 相對表達量比較,差異有統計學意義(P<0.05);進一步兩兩比較,相對高危組SMO 和Gli-1 mRNA 相對表達量高于正常對照組和相對低危組(P<0.05);相對低危組與正常對照組比較,差異無統計學意義(P>0.05)。見表2。
表2 3組患者SHH、Patched-1、SMO和Gli-1 mRNA相對表達量的比較 (±s)

表2 3組患者SHH、Patched-1、SMO和Gli-1 mRNA相對表達量的比較 (±s)
注:①與正常對照組比較,P <0.05;②與相對低危組比較,P <0.05。
組別正常對照組相對低危組相對高危組F 值P 值n Gli-1 mRNA 0.07±0.49 0.14±0.92 1.03±1.32①②7.928 0.001 25 18 35 SHH mRNA 0.22±1.71 1.20±2.17 1.32±2.03 2.458 0.089 Patched-1 mRNA 0.05±1.84 1.01±2.25 1.01±2.07 1.845 0.170 SMO mRNA-0.38±2.09 1.17±3.05 3.89±2.51①②21.601 0.000
2.2 SHH信號通路相關基因與患者預后生存分析
53 例患者中位生存時間為12.0(7.5,16.5)個月;平均SMO mRNA 相對表達量為(2.95±2.97),平均Gli-1 mRNA 相對表達量為(0.73±1.26)。高于平均水平的患者為高表達組,低于平均水平的患者為低表達組。SMO基因高、低表達組患者中位生存時間分別為8.0(6.7,9.3)個月和20.0(14.2,25.8)個月,Gli-1基因高、低表達組患者中位生存時間分別為7.0(4.6,9.4)個月和20.0(7.2,32.8)個月。用Kaplan-Meier 法繪制生存曲線,結果顯示,SMO基因高、低表達組患者3年累積生存率分別為8.4% 和36.9%,兩組比較,采用Log rank χ2檢驗,差異有統計學意義(χ2=10.840,P=0.001)(見圖1);Gli-1基因高、低表達組患者3年累積生存率分別為11.6%和31.5%,兩組比較,采用Log rank χ2檢驗,差異有統計學意義(χ2=10.180,P=0.001)(見圖2)。
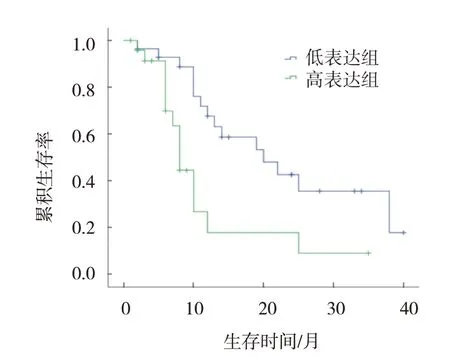
圖1 MDS患者SMO基因高、低表達組的生存曲線

圖2 MDS患者Gli-1基因高、低表達組的生存曲線
2.3 Jervine對MUTZ-1細胞增殖的影響
CCK-8 法檢測結果顯示,Jervine 0 μmol/L 組、Jervine 1 μ mol/L 組、Jervine 5 μ mol/L 組、Jervine 10 μmol/L 組MUTZ-1 細胞的增殖率分別為(99.88±0.12)%、(93.39±0.93)%、(87.88±1.72)%和(78.76±0.75)%,4 組比較,差異有統計學意義(F=217.752,P=0.000);進一步兩兩比較,Jervine 5 μmol/L 組和Jervine 10 μmol/L 組細胞增殖率低于Jervine 0 μmol/L 組(P<0.05)(見圖3)。MUTZ-1 細胞增殖率與Jervine 濃度呈負相關(r=-0.977,P=0.000),隨著Jervine 濃度升高,對MUTZ-1 細胞增殖作用越小,呈現劑量依賴性。

圖3 不同濃度Jervine作用MUTZ-1細胞24 h后細胞增殖率的比較 (±s)
2.4 Jervine對MUTZ-1細胞凋亡的影響
流式細胞儀檢測結果顯示,Jervine 0 μmol/L 組、Jervine 1 μ mol/L 組、Jervine 5 μ mol/L 組、Jervine 10 μmol/L 組細胞凋亡率分別為(3.53±0.21)%、(5.69±0.23)%、(10.90±0.13)%和(18.23±0.72)%,4 組比較,差異有統計學意義(F=806.727,P=0.000)(見圖4)。MUTZ-1 細胞凋亡率與Jervine 濃度呈正相關(r=0.997,P=0.000),隨著Jervine 濃度升高,對MUTZ-1 細胞凋亡作用越明顯,呈現劑量依賴性。

圖4 不同濃度Jervine組MUTZ-1細胞的凋亡率
2.5 Jervine 對MUTZ-1 細 胞SMO 和Gli-1 基 因表達的影響
Jervine 0 μmol/L 組、 Jervine 1 μ mol/L 組、Jervine 5 μ mol/L 組、Jervine 10 μmol/L 組MUTZ-1細胞的SMO、Gli-1 mRNA 相對表達量比較,差異有統計學意義(P<0.05);進一步兩兩比較,Jervine 5 μmol/L 組和Jervine 10 μmol/L 組SMO、Gli-1 mRNA相對表達量低于Jervine 0 μmol/L 組(P<0.05)。見表3。
表3 不同濃度Jervine組MUTZ-1細胞的SMO、Gli-1 mRNA相對表達量的比較 (±s)

表3 不同濃度Jervine組MUTZ-1細胞的SMO、Gli-1 mRNA相對表達量的比較 (±s)
注:?與Jervine 0 μmol/L組比較,P <0.05
組別Jervine 0 μmol/L組Jervine 1 μmol/L組Jervine 5 μmol/L組Jervine 10 μmol/L組F 值P 值Gli-1 mRNA 1.09±0.08 0.76±0.13 0.49±0.08?0.27±0.07?44.822 0.000 SMO mRNA 0.99±0.07 0.81±0.07 0.61±0.04?0.39±0.07?50.623 0.000
2.6 Jervine 對MUTZ-1 細 胞SMO 和Gli-1 蛋 白表達的影響
Jervine 0 μmol/L 組、 Jervine 1 μ mol/L 組、Jervine 5 μ mol/L 組、Jervine 10 μmol/L 組MUTZ-1細胞的SMO、Gli-1 蛋白相對表達量比較,差異有統計學意義(P<0.05);進一步兩兩比較,Jervine 5 μmol/L 組和Jervine 10 μmol/L 組SMO、Gli-1 蛋白相對表達量低于Jervine 0 μmol/L 組(P<0.05)。見圖5 和表4。
表4 不同濃度Jervine組MUTZ-1細胞的SMO、Gli-1蛋白相對表達量的比較 (±s)

表4 不同濃度Jervine組MUTZ-1細胞的SMO、Gli-1蛋白相對表達量的比較 (±s)
注:?與Jervine 0 μmol/L組比較,P <0.05。
組別Jervine 0 μmol/L組Jervine 1 μmol/L組Jervine 5 μmol/L組Gli 0.8 0.7 0.5 SMO 蛋白0.78±0.04 0.64±0.04 0.47±0.03?Jervine 10 μmol/L組F 值P 值-1 蛋白5±0.081±0.090±0.06?0.28±0.05?38.685 0.000 0.30±0.04?85.542 0.000
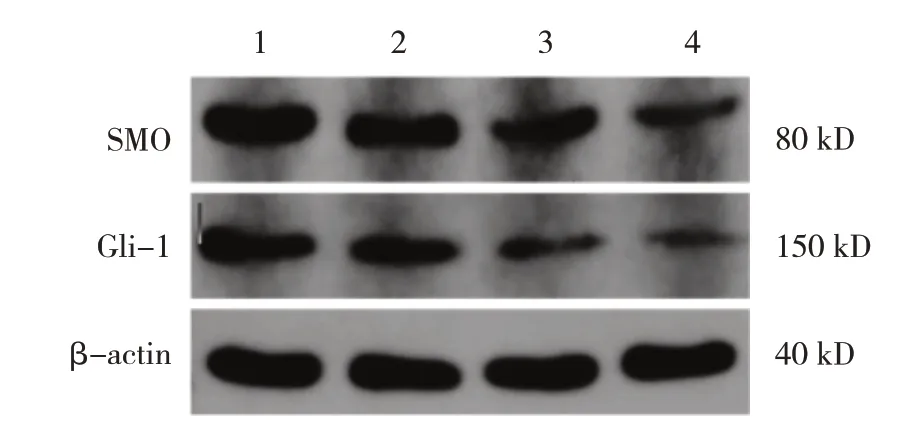
圖5 不同濃度Jervine組MUTZ-1細胞的SMO、Gli-1蛋白的表達
2.7 Jervine對Bcl-2、Caspase-3、Cyclin D1蛋白表達的影響
Jervine 0 μmol/L 組、 Jervine 1 μ mol/L 組、Jervine 5 μmol/L 組、Jervine 10 μmol/L 組MUTZ-1細胞的Bcl-2、Caspase-3、Cyclin D1 蛋白相對表達量比較,差異有統計學意義(P<0.05);進一步兩兩比較,Jervine 1 μmol/L 組、Jervine 5 μmol/L 組、Jervine 10 μmol/L組與Jervine 0 μmol/L組比較,Bcl-2、Cyclin D1 蛋白相對表達量降低,Caspase-3 蛋白相對表達量升高(P<0.05)。見圖6 和表5。
表5 不同濃度Jervine 組MUTZ-1 細胞的Bcl-2、Caspase-3、Cyclin D1蛋白相對表達量的比較(±s)

表5 不同濃度Jervine 組MUTZ-1 細胞的Bcl-2、Caspase-3、Cyclin D1蛋白相對表達量的比較(±s)
注:?與Jervine 0 μmol/L組比較,P <0.05。
組別Cyclin D1蛋白0.72±0.04 0.59±0.06?0.41±0.02?0.29±0.03?68.334 0.000 Bcl-2 蛋白Jervine 0 μmol/L組Jervine 1 μmol/L組Jervine 5 μmol/L組Jervine 10 μmol/L組F 值P 值0.78±0.04 0.64±0.10?0.49±0.04?0.31±0.04?31.871 0.000 Caspase-3蛋白0.23±0.07 0.35±0.07?0.48±0.05?0.61±0.06?19.762 0.000

圖6 不同濃度Jervine作用MUTZ-1細胞后Bcl-2、Caspase-3和Cyclin D1蛋白的表達
3 討論
HH 信號通路在調節正常細胞分化和胚胎發育以及驅動腫瘤形成和發展的病理過程中起至關重要作用,其中SHH 信號通路與人類關系最為密切[17-18]。MDS 發生、發展有多個因素參與,涉及多個信號通路,本研究分析SHH 信號通路在MDS 中的地位,結果顯示MDS 患者骨髓中CD34+細胞SHH信號通路異常激活,參與MDS 的發生、發展,SMO 或Gli-1 高表達的MDS 患者中位生存時間短,預后較差。目前國內外關于SHH 信號通路在MDS中的作用機制報道極少,ZOU 等[19]對23 例MDS 患者和9 例MDS 轉急性髓系白血病患者進行SHH、SMO和Gli-1基因檢測,結果顯示在MDS 患者中存在SHH 信號通路的活化,而且高危MDS 及轉白血病患者中SHH、SMO和Gli-1基因表達水平明顯高于低危患者,SHH、SMO 和Gli-1 表達水平與IPSS預后分組相關。XAVIER-FERRUCIO 等[20]對63 例低危和高危MDS 患者骨髓CD34+細胞進行Patched、SMO、Gli-1和Gli-2基因檢測,結果顯示SMO 在MDS 患者中高表達,SMO 表達與WHO 分型有關,SMO 高表達患者無事件生存率和OS 明顯縮短。本研究也證實了上述觀點。因此阻斷該通路可以影響腫瘤干細胞的發育和存活,為MDS 治療提供一個新的選擇。因相關研究較少,不同的研究結果略有差異,結果的一致性還需擴大樣本量進行觀察。
為進一步探討SHH 信號通路在MDS 中的作用機制,本研究選用SMO 抑制劑Jervine 對存在SHH信號通路高表達的MDS 細胞株MUTZ-1 進行抑制效應及其可能機制的研究。Jervine 是從Veratrum calfornicum 中分離得到的一種天然甾體生物堿,通過與SMO 的跨膜結構域結合而抑制HH 信號通路[21]。MUTZ-1 是從難治性貧血伴原始細胞增多MDS 患者中分離建株的細胞。本研究采用不同濃度Jervine 作用MUTZ-1 細胞,檢測細胞的增殖率和凋亡率發現,MUTZ-1 細胞增殖率隨Jervine 濃度增加而降低,凋亡率隨Jervine 濃度增加而升高,表明Jervine 具有抑制MUTZ-1 細胞增殖和促進細胞凋亡的作用。本研究對不同濃度Jervine 組MUTZ-1 細胞的SMO、Gli-1 mRNA 相對表達量和蛋白相對表達量進行檢測,結果表明,Jervine 可下調MUTZ-1 細胞SMO 和Gli-1 基因、蛋白的表達,且隨著Jervine濃度增加,SMO 和Gli-1 基因和蛋白表達明顯下降。此外,Bcl-2、Caspase-3 和Cyclin D1 是SHH 信號通路的下游靶基因,本研究結果顯示,加入不同濃度Jervine 作用于MUTZ-1 細胞后,Bcl-2 和Cyclin D1 蛋白表達明顯下降,Caspase-3 則相反,表明SHH 通路對MUTZ-1 細胞增殖和凋亡的作用可能是通過對Bcl-2、Caspase-3 和Cyclin D1 的調節而實現的。KOBUNE 等[22]研究結果顯示,在初診急性粒細胞白血病患者中CD34+細胞上存在HH 信號通路激活,并介導白血病細胞耐藥,使用SMO 抑制劑Cyclopamine 作用于急性粒細胞白血病細胞株(Kasumi-1、Kasumi-3 及TF-1)與原代急性粒細胞白血病細胞48 h 后,上述所有細胞凋亡率明顯增加。這與本研究結論一致。
綜上所述,MDS 患者中存在SHH 信號通路異常激活;作為SHH 信號通路的阻斷劑,Jervine 可抑制MDS 細胞的發展,為MDS 提供了一種潛在的新的治療策略。

