白術多糖對Ang-Ⅱ誘導的血管平滑肌細胞增殖及氧化應激的作用
鞏克民, 季宏建
(1.江蘇醫藥職業學院藥學院,江蘇 鹽城 224005;2.鹽城市第三人民醫院藥學部,江蘇 鹽城 224005)
動脈粥樣硬化是心肌梗死和腦卒中的發病基礎,其基本的病理表現為血管壁彈性下降、血管內膜損傷、修復、增厚及其導致的管腔狹窄,繼而引發靶器官的缺血缺氧損傷,最終引發一系列嚴重疾病[1]。內皮細胞、巨噬細胞和血管平滑肌細胞(vascular smooth muscle cells,VSMCs)參與了動脈粥樣硬化的形成和發展[2],VSMCs在新生內膜的大量積聚是血管中膜平滑肌細胞遷移至內膜并大量增殖造成,有效抑制VSMCs的活化及增殖可能是防治動脈粥樣硬化的重要環節[3]。而氧化應激是動脈粥樣硬化發生發展過程中的重要促進因素之一,主要通過氧化修飾作用,誘導血管基因表達、促進局部炎癥反應和VSMCs增殖,從多方面參與動脈粥樣硬化的發生發展[4]。
中藥多糖是一種來源廣泛、無毒副作用的天然的大分子化合物,具有多種生物活性和多種藥理作用。有研究報道[5-7],多糖能夠減輕腦缺血造成的神經功能損傷,抑制神經元凋亡,降低模型大鼠腦組織中的NO水平和NOS活性,表現出明顯的抗氧化應激損傷活性,發揮腦組織保護作用;同時也有研究報道[8-9],多糖能夠減輕機體氧化應激反應的發生,抑制血管平滑肌細胞增殖,保護血管內膜從而減輕動脈粥樣硬化的形成。白術多糖作為白術的主要生物活性成分之一,已經在抗炎、抗氧化、抗腫瘤、提高免疫力、治療中樞神經系統疾病等方面被廣泛地使用[10]。但是關于白術多糖在心腦血管方面的應用研究極少。本實驗旨在觀察白術多糖對血管緊張素Ⅱ (angiotensin-Ⅱ,Ang-Ⅱ)誘導的VSMCs增殖及氧化應激反應的影響,以期為白術多糖應用于臨床腦血管病的防治提供理論依據。
1 材料
1.1 動物 8周齡雄性SPF級SD大鼠,由江蘇省實驗動物中心提供,動物生產許可證號SCXK(蘇) 2019-0036。
1.2 藥物 白術多糖購于陜西慈緣生物技術有限公司,批號CY190105,純度≥98%,深棕色粉末狀,極易溶于水,雙蒸水配制成20 mg/L貯備液,0.22 μm濾膜過濾除菌,分裝并貯存于常溫備用。
1.3 試劑 DMEM高糖培養基、胎牛血清、0.25%胰蛋白酶和青-鏈霉素均購于美國HyClone公司;Ang-Ⅱ購于美國Sigma公司;p-p38、c-Myc、β-actin抗體均購于美國R&D公司;PE-BrdU細胞增殖檢測試劑盒購于江蘇凱基生物技術股份有限公司;p38MAPK抑制劑SB203580、ROS活性氧檢測試劑盒、SOD和MDA試劑盒均購于上海碧云天生物技術有限公司。
2 方法
2.1 大鼠胸主動脈VCMCs的分離及培養 2%戊巴比妥鈉麻醉大鼠后,在無菌條件下取出胸主動脈,剔除血管外膜和內膜后,將血管段剪成1 mm2大小的組織塊,均勻鋪在培養瓶底部,加入含有20%胎牛血清的DMEM培養基,置于37 ℃,5% CO2飽和濕度培養箱培養,待觀察到組織塊周圍的細胞生長融合后,用0.25%胰蛋白酶消化傳代,取第4~5代細胞用于后續實驗研究。
2.2 分組處理 取第4~5代VCMCs細胞分為5組,對照組,VCMCs細胞不經過任何處理,正常培養;Ang-Ⅱ組,采用0.1 μmol/L Ang-Ⅱ處理VCMCs 24 h[11];Ang-Ⅱ+白術多糖組,采用0.1 μmol/L Ang-Ⅱ刺激24 h,80 μg/mL白術多糖處理VCMCs 48 h;Ang-Ⅱ+SB203580組,采用10 μmol/L p38MAPK抑制劑SB203580預處理2 h[12],0.1 μmol/L Ang-Ⅱ刺激24 h;Ang-Ⅱ+ SB203580+白術多糖組,依次采用10 μmol/L p38MAPK抑制劑SB203580預處理2 h,0.1 μmol/L Ang-Ⅱ刺激24 h,80 μg/mL白術多糖處理48 h。
2.3 MTT比色法檢測VCMCs細胞活力 取對數生長期VCMCs細胞,以每孔2×103個細胞種于96孔板,先采用0.1 μmol/L Ang-Ⅱ誘導刺激24 h,再采用不同質量濃度(0、20、40、80、160 μg/mL)的白術多糖分別處理24、48、72 h。吸取培養液,取出不同分組的細胞培養板,每孔加20 μL MTT 溶液(5 mg/mL),繼續培養4 h,然后吸掉上清,每孔加入150 μL DMSO溶解液,置搖床上低速振蕩10 min,使結晶物充分溶解。在酶聯免疫檢測儀490 nm波長處測量各孔光密度(OD490)表示細胞活力。
2.4 BrdU法檢測VCMCs細胞增殖情況 VCMCs細胞分組處理后,按照試劑盒說明書步驟進行操作和BrdU標記,加入PE-BrdU抗體,4 ℃避光孵育30 min。使用488 nm激發波長、575 nm發射波長,經流式細胞儀檢測,以BrdU標記的陽性細胞所占百分比表示細胞增殖情況。
2.5 流式細胞儀檢測細胞內ROS水平 培養VCMCs細胞,分組處理后收集細胞沉淀,重懸后按照試劑盒說明書步驟進行,加入10 μmol/L DCFH-DA熒光探針避光孵育30 min,PBS洗滌3次,使用488 nm激發波長,525 nm發射波長,上流式細胞儀檢測,以相對平均熒光強度值表示細胞內ROS水平。
2.6 細胞內SOD活性及MDA水平檢測 培養VCMCs細胞,分組處理后收集細胞沉淀,冰水浴條件下裂解細胞,按照試劑盒說明書進行操作,采用硫代巴比妥酸法測定MDA水平,羥胺法測定T-SOD活性。
2.7 Western blot檢測p-p38和c-Myc的蛋白表達 培養VCMCs細胞,分組處理后收集細胞沉淀,加入RIPA裂解液,提取細胞總蛋白,采用BCA法檢測各組蛋白濃度。取20 μg蛋白上樣,進行SDS-PAGE電泳分離,再將蛋白轉印至PVDF膜上,5%脫脂奶粉封閉液封閉2 h,洗膜,加入一抗稀釋液(c-Myc、p-p38和β-actin,1∶1 000),室溫孵育1 h,洗膜,加入HRP標記的山羊抗兔或小鼠IgG(1∶20 000),室溫孵育1 h,洗膜,滴加化學發光試劑,于暗室中顯影分析。
3 結果
3.1 白術多糖對暴露于Ang-Ⅱ條件下VCMCs細胞活力的影響 如圖1所示,與對照組比較,Ang-Ⅱ作用24、48、72 h均可提高VCMCs細胞增殖活性(P<0.05);與Ang-Ⅱ處理組比較,80、160 μg/mL白術多糖處理48、72 h均可抑制Ang-Ⅱ誘導的VCMCs細胞活力增強(P<0.05)。綜合考慮,選擇80 μg/mL白術多糖處理48 h作為實驗條件。

注:與對照組比較,*P<0.05;與Ang-Ⅱ+白術多糖(0 μg/mL)組比較,#P<0.05。圖1 不同質量濃度白術多糖對VCMCs細胞活力的影響
3.2 白術多糖抑制Ang-Ⅱ誘導的VCMCs細胞增殖 如圖2所示,與對照組比較,Ang-Ⅱ組VCMCs細胞增殖水平增加(P<0.05);與Ang-Ⅱ組比較,Ang-Ⅱ+白術多糖組和Ang-Ⅱ+SB203580組VCMCs細胞增殖水平降低(P<0.05);與Ang-Ⅱ+白術多糖組比較,Ang-Ⅱ+SB203580組和Ang-Ⅱ+SB203580+白術多糖組VCMCs細胞增殖水平降低(P<0.05);Ang-Ⅱ+SB203580組、Ang-Ⅱ+SB203580+白術多糖組VCMCs細胞增殖水平無明顯變化(P>0.05)。
3.3 白術多糖對Ang-Ⅱ誘導條件下VCMCs細胞內氧化應激水平的影響 如圖3所示,與對照組比較,Ang-Ⅱ組VCMCs細胞內ROS、MDA水平增加(P<0.05),SOD活性降低(P<0.05);與Ang-Ⅱ組比較,Ang-Ⅱ+白術多糖組和Ang-Ⅱ+ SB203580組VCMCs細胞內ROS、MDA水平降低(P<0.05),SOD活性增加(P<0.05);與Ang-Ⅱ+白術多糖組比較,Ang-Ⅱ+SB203580組和Ang-Ⅱ+SB203580+白術多糖組VCMCs細胞內ROS、MDA水平降低(P<0.05),SOD活性增加(P<0.05);與Ang-Ⅱ+SB203580組比較,Ang-Ⅱ+SB203580+白術多糖組VCMCs細胞內ROS、MDA水平以及SOD活性均無明顯變化(P>0.05)。
3.4 白術多糖對Ang-Ⅱ誘導條件下VCMCs細胞內p-p38和c-Myc蛋白表達水平的影響 如圖4所示,與對照組比較,Ang-Ⅱ組VCMCs細胞內p-p38和c-Myc蛋白表達水平增加(P<0.05);與Ang-Ⅱ組比較,Ang-Ⅱ+白術多糖組和Ang-Ⅱ+SB203580組VCMCs細胞p-p38和c-Myc蛋白表達水平降低(P<0.05);與Ang-Ⅱ+白術多糖組比較,Ang-Ⅱ+SB203580組和Ang-Ⅱ+SB203580+白術多糖組VCMCs細胞p-p38和c-Myc蛋白表達水平降低(P<0.05);與Ang-Ⅱ+SB203580組比較,Ang-Ⅱ+ SB203580+白術多糖組VCMCs細胞內p-p38和c-Myc蛋白表達水平無明顯變化(P>0.05)。

注:A為ROS水平, B為SOD活性,C為MDA水平。與對照組比較,*P<0.05, **P<0.01;與Ang-Ⅱ組比較,#P<0.05;與Ang-Ⅱ+白術多糖組比較,■P<0.05。圖3 白術多糖對Ang-Ⅱ誘導條件下VCMCs細胞內ROS、MDA水平及SOD活性的影響
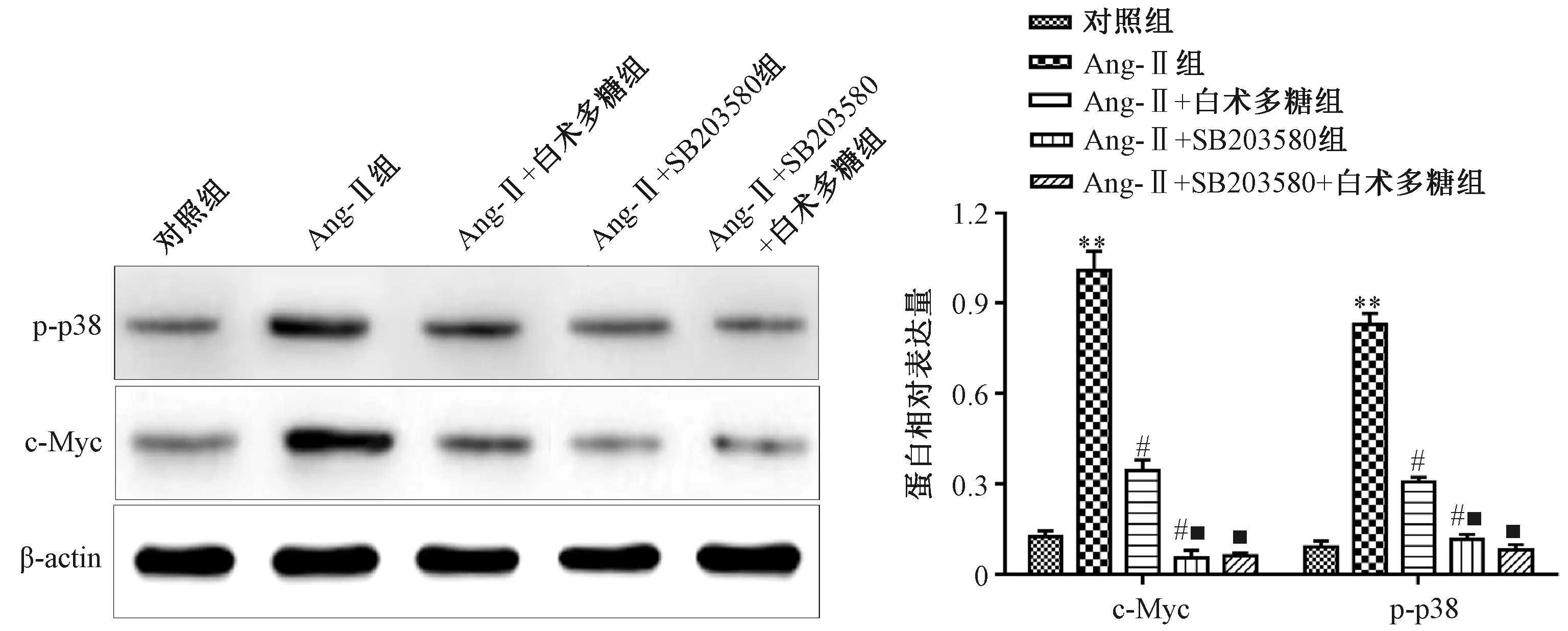
注:與對照組比較,**P<0.01;與Ang-Ⅱ組比較,#P<0.05;與Ang-Ⅱ+白術多糖組比較,■P<0.05。圖4 白術多糖對Ang-Ⅱ誘導條件下VCMCs細胞內p-p38和c-Myc蛋白表達水平的影響
4 討論
動脈粥樣硬化是冠心病、腦卒中等心血管疾病最常見的血管病理改變,一直是心血管領域的研究重點。而VSMCs的異常增殖在動脈粥樣硬化病變的形成過程中起到重要作用[13]。Ang-Ⅱ作為腎素-血管緊張素-醛固酮系統(RAAS)的重要功能因子,可以通過自分泌和旁分泌方式作用于VSMCs,刺激VSMCs增殖,且具有劑量依賴性[14]。因此,阻斷Ang-Ⅱ誘導的VSMCs異常增殖可能成為預防動脈粥樣硬化發生、發展的治療靶點。本研究結果顯示,Ang-Ⅱ刺激能夠誘導VSMCs增殖并產生氧化應激,而白術多糖處理可抑制Ang-Ⅱ誘導VSMCs細胞增殖,并提高細胞抗氧化能力,并且其作用機制可能與抑制p38 MAPK通路激活有關,提示該藥可能對動脈粥樣硬化相關心血管疾病的治療具有一定的療效。
氧化應激是機體抗氧化反應與氧化反應之間的一種失控狀態,機體組織中ROS生成過多是導致血管并發癥產生的重要環節,從多方面參與動脈粥樣硬化的發生發展[15]。已有研究表明[16],氧化應激發生時,ROS形成可促進細胞因子分泌和相應受體表達引起慢性炎癥反應和VSMCs增殖。因此,減少ROS的產生以及提高VSMCs抗氧化水平或許是治療和預防動脈粥樣硬化相關疾病的重要途徑。現有的抗動脈粥樣硬化藥物長期服用,均可導致不同程度的不良反應發生,故從天然植物藥中尋找有效的抗動脈粥硬化藥物成分是目前研究的熱點。白術多糖是從白術根莖中提取出的多糖類,具有抗炎、抗氧化、抗腫瘤、提高機體免疫力、抗衰老、調節胃腸等多重藥理作用。已有研究證實[17],白術可通過抑制氧化應激和RAAS的活化改善異丙腎上腺素誘導的大鼠心室重構。提示,白術多糖可能對Ang-Ⅱ誘導的VSMCs增殖及氧化應激具有一定的抑制作用。本研究結果顯示,Ang-Ⅱ可誘導VSMCs增殖,并導致細胞內ROS、MDA水平增加,SOD活性降低,說明Ang-Ⅱ可導致細胞內氧化水平增加進而促進VSMCs增殖。然而Ang-Ⅱ處理一段時間后再采用白術多糖干預,結果顯示VSMCs增殖被抑制,且胞內ROS、MDA水平下降,而SOD活性上升。表明,白術多糖對Ang-Ⅱ誘導的氧化應激和VSMCs增殖具有抑制作用,而有效抑制VSMCs增殖可能是臨床上防治動脈粥樣硬化的重要環節。
p38 MAPK是一種重要的轉錄因子,參與多種基因的表達調控,具有多種生物學功能。多項研究表明[18-19],p38 MAPK通路參與血管損傷后內膜增生過程。Wang等[20]研究顯示,AngⅡ能通過激活p38 MAPK信號通路誘導VSMCs增殖,抑制p38 MAPK信號通路活化可抑制AngⅡ誘導的VSMCs增殖。同時,Jeong等[21]研究表明,白術復合物可抑制p38 MAPK信號通路活化。提示,白術多糖有可能通過抑制p38 MAPK信號通路活化進而抑制AngⅡ誘導的VSMCs增殖和氧化應激。為探討白術多糖是否對AngⅡ激活的p38 MAPK通路產生影響,本研究對p38 MAPK信號通路蛋白進行了檢測,結果顯示,Ang-Ⅱ干預可誘導VSMCs中p38 MAPK信號通路相關蛋白p-p38和c-Myc蛋白的表達,采用p38 MAPK抑制劑SB203580干預可以抑制Ang-Ⅱ誘導的p38 MAPK信號通路活化,VSMCs增殖及氧化應激,表明抑制p38 MAPK信號通路活化可抑制Ang-Ⅱ誘導的VSMCs增殖及氧化應激。此外,本研究還顯示,采用白術多糖干預對Ang-Ⅱ誘導的p38 MAPK信號通路活化具有抑制作用,然而白術多糖與SB203580聯合干預并沒有對Ang-Ⅱ誘導的VSMCs增殖及氧化應激出現疊加抑制效果,說明白術多糖是通過抑制p38 MAPK信號通路的激活進而抑制Ang-Ⅱ誘導的VSMCs增殖和氧化應激。
綜上所述,白術多糖可能通過抑制p38 MAPK信號通路的激活,降低VSMCs細胞內ROS、MDA的生成,提高SOD活性,從而抑制Ang-Ⅱ誘導的VSMCs增殖,本研究結果為白術多糖對AS相關心血管疾病的治療提供了實驗依據,為其應用于臨床腦血管病的防治提供了理論基礎。

