AGGF1調控AMPK-mTOR-ULK1信號通路促進視網膜血管生成機制研究
李蓉 姚國敏 周凌霄 閆瑾 張敏 李亞
在對先天性靜脈畸形骨肥大綜合征患者的研究中,發現了具有多個特殊結構域的新基因,即G補綴FHA域血管生成因子1(angiogenic factor with G patch and FHA domains 1,AGGF1)。該基因廣泛表達于人體組織和器官,如腦、眼、心臟等[1]。血管生成是指血管內皮細胞在已形成的毛細血管的基礎上原位增殖和遷移,以形成新毛細血管的過程[2]。血管生成涉及多種因素和復雜信號[3],其中,近年來AGGF1已被證實參與血管發育,具有強烈的促血管生成作用[4]。在血管性疾病領域,AGGF1具有治療冠心病及心肌梗死[5]、糖尿病血管并發癥的潛能[6]。而在腫瘤領域,AGGF1被證實是抗腫瘤血管新生、抑制腫瘤轉移的重要靶點[7,8]。研究證實,AGGF1促進了高糖、高氧下的視網膜新生血管形成,可能參與了糖尿病視網膜病變、早產兒視網膜疾病的病理機制[9,10]。自噬是一種作為對應激的應答、被嚴格調控的溶酶體降解機制,從而維持細胞內穩態,在生理狀態和疾病中均發揮重要作用[11]。我們的前期研究表明,應激狀態下視網膜血管內皮細胞自噬的激活參與了視網膜血管生成過程[12,13]。鑒于此,我們推測,激活細胞自噬可能是AGGF1發揮促視網膜血管生成的一種重要機制。本研究擬以視網膜血管內皮細胞為對象,觀察AGGF1作用下對細胞遷移和管腔結構形成的影響,進而通過阻斷自噬激活的關鍵信號通路,觀察AGGF1對視網膜血管生成的作用是否受到抑制,從而明確AGGF1發揮促視網膜新生血管生成作用的自噬機制,為進一步研究AGGF1在眼部疾病中的治療潛能和作用靶點奠定基礎。
1 材料與方法
1.1 主要試劑與儀器 人視網膜血管內皮細胞(HRMECs,上海中喬新舟生物科技有限公司);M199培養基、胎牛血清及0.25%胰酶(美國Gibco公司);人AGGF1重組蛋白(美國Abnova公司);AMPK 抑制劑Compound C(美國Selleck公司);Transwell小室及Matrigel(美國BD公司);細胞RIPA裂解液、BCA蛋白濃度測定試劑盒(碧云天生物技術有限公司);兔抗人一抗AMPK、p-AMPK,mTOR,p-mTOR,ULK1,p-ULK1(美國Cell signaling公司);兔多抗GAPDH (杭州賢至生物有限公司);HRP標記羊抗兔二抗(武漢博士德生物工程有限公司);GFP-LC3B質粒(北京義翹神州生物技術有限公司);Lip2000轉染試劑及Opti-MEM培養基(美國Thermo Fisher Scientific公司);CO2恒溫培養箱(日本SANYO,MCO-15AC型);倒置相差顯微鏡(日本Olympus,IX51型);激光共聚焦顯微鏡(日本尼康,C2型);低速離心機(美國Eppendorf,5702R型);全自動酶標儀(美國Thermo scientific,Multiskan MK3型)。
1.2 實驗方法
1.2.1 細胞培養與分組:將液氮中凍存的HRMECs取出,快速放入37℃水浴鍋中解凍,然后轉移至含有5 ml M199培養基的離心管中,室溫離心收集細胞(1 200 r/min,3 min);棄去上清后用含10%胎牛血清+1%青霉素、鏈霉素的M199培養基懸浮細胞,接種至培養皿中,輕輕吹打混勻,在37℃、飽和濕度條件的5%CO2細胞培養箱中培養。用0.25%胰酶消化細胞,終止消化后收集細胞;PBS洗滌細胞2次后離心(1 200 r/min,3 min);加入完全培養基制成單細胞懸液,按1∶3的比例傳代,在37℃、5%CO2及飽和濕度條件下擴大培養。根據不同處理將細胞分為以下3組:對照組(常規培養),AGGF1組(在M199培養基中加入0.5 μg/ml AGGF1),Compound C+AGGF1(在M199培養基中加入5 μmol/L的Compound C及0.5 μg/ml AGGF1),3組細胞在37℃、5%CO2及飽和濕度條件下培養。
1.2.2 細胞遷移:采用Transwell小室法檢測細胞遷移能力。取生長狀態良好的細胞,制備單細胞懸液,計數后按照每孔5×105個接種至6孔板,在37℃、飽和濕度條件的5%CO2孵箱中培養過夜。根據上述不同分組處理細胞48 h,0.25%胰酶消化,收集細胞后離心(1 200 r/min×3 min),棄去上清,PBS清洗2次后用無血清培養基重懸細胞,調整細胞濃度至2×105/ml備用。在24孔板中加入800 μl M199培養基(含10%胎牛血清+1%青霉素、鏈霉素),并放入Transwell小室,在上室分別接入200 μl各組細胞懸液,37℃、5%CO2孵箱中培養48 h。PBS清洗小室,70%冰乙醇溶液固定細胞1 h,0.5%結晶紫染液對細胞進行染色,室溫中放置20 min。PBS清洗后用擦凈上室一側未遷移的細胞,在顯微鏡下觀察拍照。每個小室隨機選取3個200倍的視野,計數遷移的細胞,取平均值。
1.2.3 細胞管腔形成:采用Matrigel法檢測細胞管腔形成能力。4℃條件融化Matrigel膠過夜,并預冷24孔板和移液器槍頭。向24孔板加入融化的Matrigel膠,每孔200 μl。低速無菌離心除去氣泡,在37℃下孵育30 min。0.25%胰酶消化不同分組培養48 h的細胞,用無血清培養基制成單細胞懸液,計數后按照每孔2×105/個細胞接種至有預鋪膠的24孔板中,在37℃、5%CO2及飽和濕度條件下培養過夜。在顯微鏡下觀察拍照,隨機選取3個100倍視野,采用Image J圖像分析軟件計數細胞管腔形成數目,取平均值。
1.2.4 自噬熒光:采用GFP-LC3B質粒轉染細胞,觀察細胞內的自噬熒光。取生長狀態良好的細胞,計數后以每孔5×105個細胞接種于6孔板,37℃、5%CO2培養箱中培養過夜。將要轉染的細胞,換成無血清的培養基,培養2 h。取10 μl/孔Lip2000,用200 μl Opti-MEM培養基稀釋,混合后室溫孵育5 min;取4 μg質粒,用50 μl Opti-MEM的培養基稀釋混勻。將稀釋的Lip2000和質粒輕輕混合,室溫靜置20 min,以形成質粒-Lip2000的混合物。將質粒-Lip2000的混合物加入到含有細胞及培養液的培養瓶中,輕輕混勻。轉入37℃、5% CO2培養箱培養,6 h后將培養基換成含血清的培養基,然后在37℃、5%CO2培養箱中孵育過夜。根據不同分組處理細胞48 h,在熒光顯微鏡下觀察拍照。隨機選取3個400倍的視野,采用Image J圖像分析軟件計算平均熒光強度。
1.2.5 Western blotting:采用Western blotting法檢測細胞AMPK、mTOR及ULK1的蛋白表達。根據不同分組處理細胞48 h,提取細胞總蛋白,采用BCA法測定蛋白濃度。將40 μg樣品蛋白在10% SDS-PAGE上電泳,然后轉移到PVDF膜上。用含5% 脫脂奶粉的封閉液TBST溶液浸泡PVDF膜,室溫搖床孵育2 h。磷酸化蛋白用1% 胎牛血清封閉。用稀釋的一抗浸泡PVDF膜,在4℃條件下孵育過夜,所用抗體稀釋濃度分別為:AMPK(1∶1 000),p-AMPK(1∶1 000),mTOR(1∶1 000),p-mTOR(1∶1 000),ULK1(1∶1 000),p-ULK1(1∶1 000),GADPH(1∶1 000)。TBST充分洗膜后,用稀釋的HRP標記的相應二抗(1:50000)在室溫下搖床孵育2 h。TBST充分洗膜,除去多余二抗,ECL顯色曝光,晾干后掃描膠片,用BandScan軟件分析膠片灰度值,與內參照GAPDH的表達進行比較,計算各目的蛋白的相對表達量,每組進行3次生物學重復。
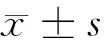
2 結果
2.1 HRMECs細胞遷移情況 3組細胞遷移比較,差異有統計學意義(P<0.05)。與對照組相比,AGGF1組和Compound C+AGGF1組細胞遷移數均明顯增多(P<0.05)。與AGGF1組比較,Compound C+AGGF1組細胞遷移數降低(P<0.05)。見表1,圖1。
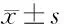
表1 3組細胞遷移情況比較
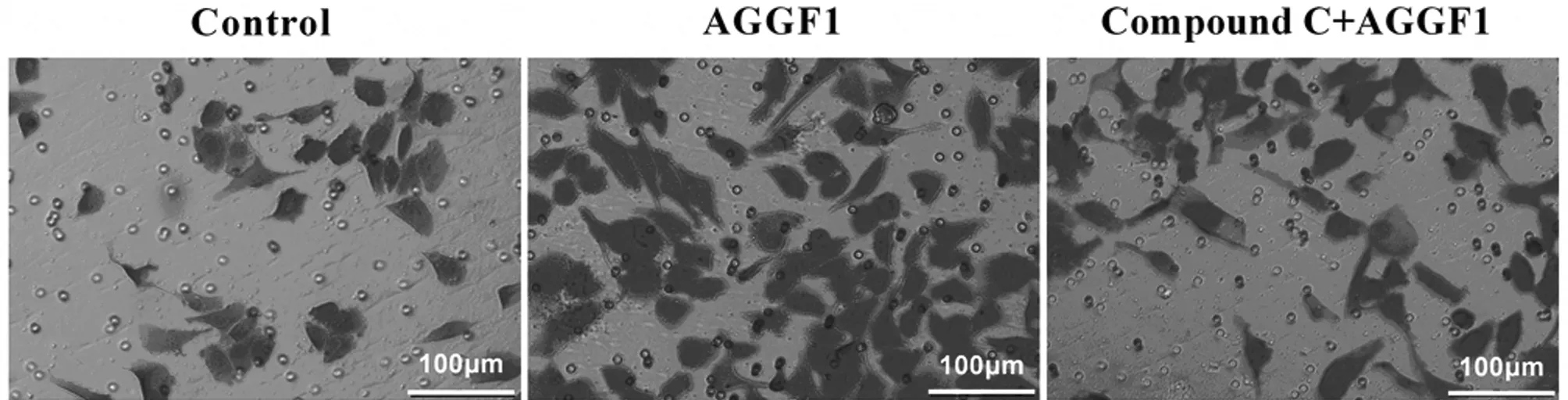
圖1 顯微鏡下觀察各組細胞遷移情況(標尺=100 μm)
2.2 HRMECs細胞管腔形成情況 3組間細胞管腔形成數比較,差異有統計學意義(P<0.05)。與對照組比較,AGGF1組和Compound C+AGGF1組的細胞管腔形成數均明顯增多(P<0.05);與AGGF1組比較,Compound C+AGGF1組的細胞管腔形成數降低(P<0.05)。見表2,圖2。
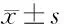
表2 3組細胞管腔形成數比較
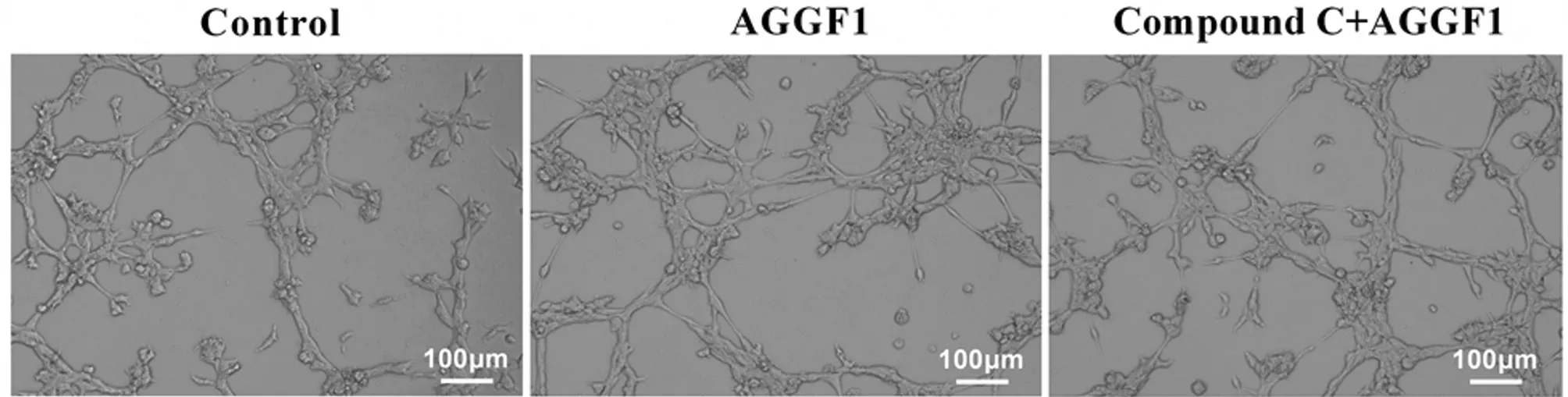
圖2 顯微鏡下觀察各組細胞管腔形成情況(標尺=100 μm)
2.3 HRMECs自噬情況 GFP-LC3B融合蛋白熒光檢測結果顯示三組間熒光強度的總體比較差異有統計學意義(P<0.05)。對照組細胞中出現較弱的GFP綠色熒光信號,AGGF1組綠色熒光明顯強于對照組和Compound C+AGGF1組(P<0.05);Compound C+AGGF1組的綠色熒光強于對照組(P<0.05)。見表3,圖3。
表3 3組細胞GFP-LC3B平均熒光強度比較
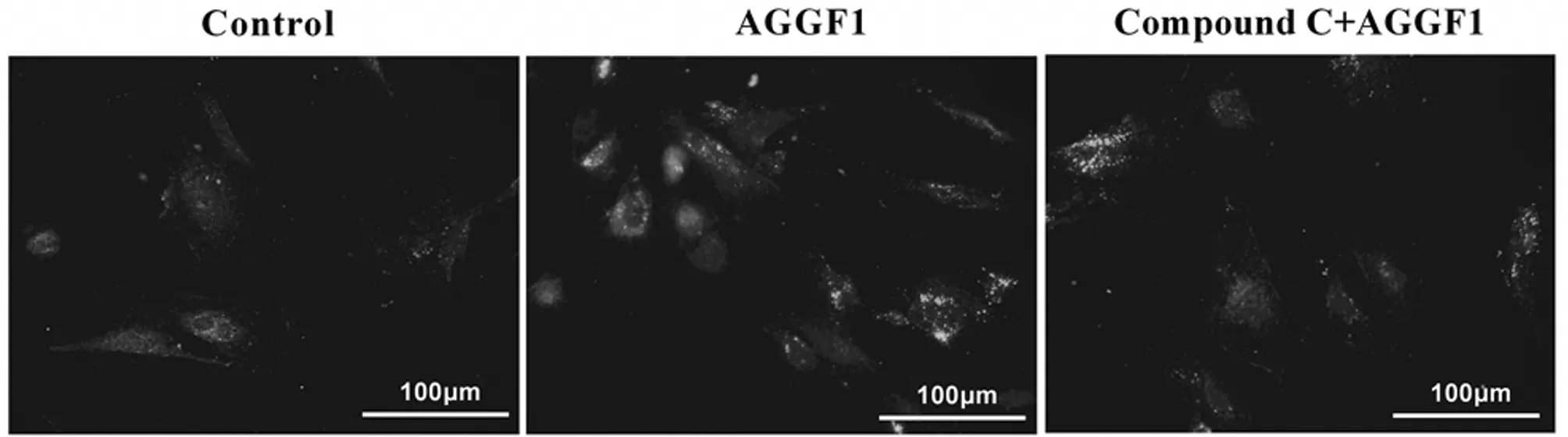
圖3 激光共聚焦顯微鏡下觀察各組轉染GFP-LC3B質粒的HRMECs細胞自噬(GFP-綠色熒光;標尺=100 μm)
2.4 HRMECs中AMPK-mTOR-ULK1自噬信號通路關鍵蛋白表達情況 Western blotting檢測結果顯示,與對照組比較,AGGF1組HRMECs細胞自噬被激活,表現為AMPK-mTOR-ULK1信號通路中關鍵蛋白p-AMPK和p-ULK1蛋白表達條帶的明顯增強和p-mTOR蛋白表達條帶的明顯減弱。當采用Compound C處理細胞時,p-AMPK和p-ULK1的蛋白表達則明顯減弱,而p-mTOR的蛋白表達則明顯增強。對照組、AGGF1組和Compound C+AGGF1組間細胞AMPK、mTOR和ULK1的相對表達量總體比較差異均無統計學意義(P>0.05)。對照組、AGGF1組和Compound C+AGGF1組間細胞p-AMPK、p-mTOR和p-ULK1的相對表達量總體比較差異均有統計學意義(P<0.05)。AGGF1組細胞中p-AMPK和p-ULK1值均明顯大于對照組和Compound C+AGGF1組(P<0.05),AGGF1組細胞中p-mTOR值明顯小于對照組和Compound C+AGGF1組(P<0.05)。Compound C+AGGF1組細胞中p-AMPK和p-ULK1值均高于對照組(P<0.05),其p-mTOR值低于對照組。見圖4,表4。
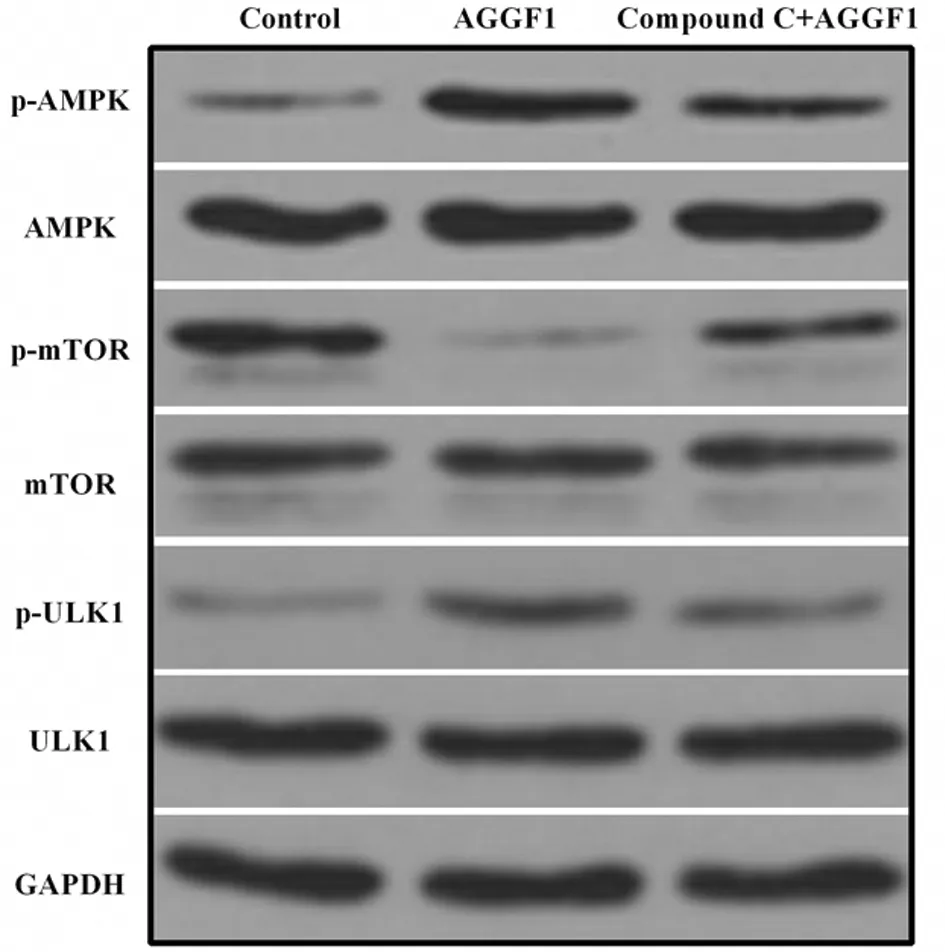
圖4 3組細胞AMPK-mTOR-ULK1自噬信號通路關鍵蛋白表達比較
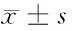
表4 Western blotting檢測各組蛋白的相對表達量
3 討論
由于內皮細胞功能障礙是視網膜新生血管性疾病的主要特征,因此本研究選擇HRMECs,一種常用的細胞模型進行觀察[14,15]。結果提示,AGGF1直接處理HRMECs可以明顯促進細胞遷移和管腔形成,與我們前期在其他視網膜內皮細胞模型中觀察到的結果[9,10]一致,證明了AGGF1具有促進視網膜內皮細胞血管生成的作用。目前關于AGGF1促血管生成的機制研究還較少,有研究提示雖然其效應類似于血管內皮生長因子(vascular endothelial growth factor,VEGF),但進一步研究發現其作用與VEGF信號通路無關[1,16]。在針對冠心病和心肌梗死治療策略的研究中發現,維持或增強自噬是增強AGGF1促血管生成的新機制,主要涉及JNK信號通路的激活[16],但在視網膜血管生成中,AGGF1的作用及分子機制還不清楚。
研究證實,AMPK-哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycinm,TOR)-Unc-51樣激酶1 (Unc-51-like kinase 1,ULK1)信號通路對自噬具有重要的調控作用,對該通路的深入研究將有助于更好地理解細胞自噬過程,并為自噬相關疾病的治療提供新的靶點[17]。已證實多個與自噬相關的特異性基因(ATG)編碼相應的蛋白,協同參與自噬體形成的各個階段。其中,微管相關蛋白1A/1B輕鏈3(LC3)是ATG8在哺乳動物的類似物,廣泛分布于哺乳動物組織和培養細胞中[18]。LC3B參與自噬的全部過程[19,20],通過免疫印跡或免疫熒光檢測LC3B已成為監測自噬及自噬相關過程的可靠方法[18]。
本研究采用Compound C作為AMPK信號通路最常用的化學抑制劑[21],利用免疫印跡和LC3B免疫熒光的方法觀察了阻斷AMPK-TOR-ULK1途徑時,AGGF1對HRMECs細胞血管形成的作用是否受到影響。結果發現Compound C處理細胞時,可顯著降低細胞p-AMPK和 p-ULK的蛋白表達水平,增加p-mTOR的表達,最終降低LC3B的表達,與在其他細胞中的研究結果[22]相一致。這些結果均表明AMPK-mTOR-ULK1信號通路與自噬激活有關,而Compound C可有效抑制細胞自噬激活。本研究同時還發現Compound C可明顯減弱AGGF1作用下的細胞遷移和管腔形成,提示AMPK-mTOR-ULK1信號通路與AGGF1介導的自噬有關,且通過此通路上調自噬水平是AGGF1發揮促視網膜血管生成效應的一種分子機制。
綜上所述,本研究證實了AGGF1通過激活AMPK-mTOR-ULK1信號通路而促進HRMECs的自噬激活,后者最終通過增強細胞遷移和管腔形成能力,發揮促進視網膜血管生成的作用。不過,體外細胞實驗結果與體內生理、病理狀態存在一定差異,本研究結果還需要在體實驗進行驗證。另外,本研究只觀察了AGGF1對正常狀態下視網膜血管內皮細胞的作用,未對病理狀態下,如缺氧、高糖的作用和機制進行觀察,故不能說明AGGF1在眼部疾病中效應及機制,尚需進一步利用相應的疾病模型進行深入觀察。

