寧夏地區不同品系番茄主要病毒病種類鑒定及復合侵染研究
馬曉春,李建設,高艷明,柴阿麗,王曉敏,閆海靜,王嘉欣
(1.寧夏大學農學院,銀川 750021;2. 中國農業科學院蔬菜花卉研究所,北京 100081)
【研究意義】隨著番茄(Solanumlycopersicum)種植面積的增加以及貿易往來日趨頻繁,番茄病毒病也隨之加重。番茄病毒病具有較強的爆發性和毀滅性,在我國的各個番茄主栽區頻繁發生,對我國的番茄產業造成較大沖擊。因此,明確侵染我國各個地區的番茄病毒病種類,篩選適宜各地抗病毒品種,對預防番茄病毒病的發生以及減輕病毒病對番茄產業帶來的危害意義重大。【前人研究進展】番茄病毒癥狀分為花葉型、蕨葉型、條斑型以及黃色花葉型[1]。目前,國內外報道的可侵染番茄的病毒至少有136種[2],且35種番茄病毒在我國已報道,包括23種RNA病毒和11種DNA病毒[3-4]。其中番茄黃化曲葉病毒病(Tomatoyellowleafcurlvirus,TYLCV)屬雙生病毒科(Geminiviridae)菜豆金色花葉病毒屬(Begomovirus),DNA病毒。TYLCV于20世紀30年代末在以色列首次發現[5],于2006年在我國首次檢出[6],隨著媒介煙粉虱在全國范圍內暴發,在我國番茄主產區以從南到北的趨勢擴展開來[7],造成番茄大面積減產甚至絕產。此外,寧夏于2011年在賀蘭縣首次發現TYLCV,隨后該病毒向全寧夏區域蔓延[8]。番茄褪綠病毒(Tomatochlorosisvirus,ToCV)屬長線形病毒科(Closteroviridae)毛形病毒屬(Crinivirus),單鏈RNA病毒。1998年,ToCV在美國佛羅里達州被首次發現并報道,之后在全球30多個國家陸續報道[9]。ToCV于2004年在我國臺灣首次報道,現已擴散至河北、廣東、天津等多個省份[10-11]。被ToCV侵染后的植株表現出嚴重的褪綠和黃化,極似營養失調癥,曾被人們一度認為是植株營養生理失調或農藥藥害所致,因此常因誤判而不能夠及時準確防治[12-15]。番茄斑萎病毒(Tomatospottedwiltvirus,TSWV)屬番茄斑萎病毒科(Tospovirus),番茄斑萎病毒屬(Orthotospovirus),RNA病毒。TSWV于1915年在澳大利亞被首次報道[16],現已流行于世界各地。1989年,自我國首次在廣州報道TSWV以來[17],在我國南北方地區包括云南、寧夏等地亦大面積發生[18-19],成為制約番茄產業發展的又一重要病害。TSWV的主要傳播媒介為西花薊馬(Frankliniellaoccidentalis)[20]。受不同環境、不同番茄品種以及栽培管理和農事操作等因素的影響,不同地區的番茄病毒種類不同[21]。【本研究切入點】番茄病毒病危害不斷加重,目前針對番茄病毒復合侵染的相關報道較少,缺少對寧夏地區番茄主要病毒種類的系統研究。【擬解決的關鍵問題】本研究在寧夏銀川周邊進行田間調查,利用分子檢測鑒定手段,從田間采集不同品種疑似番茄病毒樣本,進一步確定寧夏地區侵染番茄的主要病毒種類以及復合侵染的類型,旨在為寧夏設施栽培番茄篩選出較好的抗性品種,以及為田間生產指導提供理論依據。
1 材料與方法
1.1 供試番茄品種
供試番茄品種于2021年6月29日和7月15日采用穴盤育苗方式在寧夏賀蘭園藝產業園植物工廠播種,待幼苗生長至3葉1心時定植,‘盛世1號’‘澳粉1號’‘施華洛’‘美粉969’‘豐收’‘豐冠’‘京采6號’‘伊亞’共8個大果番茄品種于2021年7月21日在產業園2號、13號日光溫室內定植,‘TY1602’‘普羅旺斯’‘京番308’‘甜脆脆’‘1號’‘味多美2號’‘原味1號’‘亞蔬12號’‘櫻桃番茄香妃9號’‘阿魯’于2021年8月7日在玻璃溫室定植。
1.2 試驗場地描述
日光溫室每個品種定植38~39株,株行距42.0 cm×75.0 cm;玻璃溫室每個品種定植50株,株行距20.0 cm×80.0 cm。定植前安裝滴灌系統,并用利爾康(泡騰消毒片Ⅱ型)對基質土壤進行消毒,定植時每棵番茄苗穴施1 g 5%的噻蟲嗪顆粒劑,定植后按常規方法施肥和管理,番茄均采用單桿整枝。
1.3 待測番茄樣品采集
2021年9月8日在寧夏賀蘭園藝產業園2號、13號日光溫室(2號溫室為基質培,13號溫室為土培)和A3玻璃溫室對大紅番茄、粉果番茄和櫻桃番茄植株進行田間調查,并分別采集18個番茄品種共366份疑似發病植株葉片,拍照后分別裝在采集袋中,標明采集時間、地點、品種、癥狀,帶回實驗室,次日進行病毒病鑒定,剩余樣品標記后存入-80 ℃保存備用。樣品采集時溫室內番茄病毒病均自然發病,取樣期間不使用任何化學農藥。

表1 引物序列信息
1.4 番茄病樣總DNA/RNA提取
1.4.1 番茄葉片總DNA提取 稱取0.1 g番茄葉片樣品,加入液氮充分研磨成粉末,采用Tiangen DNA提取試劑盒,按照操作說明提取DNA,用于后續試驗。
1.4.2 番茄總RNA的提取及cDNA的合成 稱取0.1 g番茄葉片樣品,加入液氮充分研磨成粉末,采用RNAprep Pure多糖多酚植物總RNA 提取試劑盒,按照操作說明進行提取RNA,反轉錄采用Vazyme生物公司的 Hiscript Ⅲ 1st Strand cDNA Synthesis Kit(+gDNA wiper),以提取的總RNA為模板進行反轉錄,反應體系和步驟參照Vazyme生物公司產品說明書進行。cDNA合成:加入2 μL RNA,用RNase Free ddH2O補足到8 μL,65 ℃加熱5 min,迅速置于冰上驟冷,靜置2 min;然后加入5×gDNA wiper Mix 2 μL,用移液器輕輕吹打混勻,42 ℃ 2 min;第一鏈cDNA合成反應:10 μL 2×RT Mix,2 μL Hiscript Ⅲ Enzyme Mix,1 μL Radom hexamers,RNase Free ddH2O 25 ℃ 5 min,37 ℃ 45 min,85 ℃ 5 s,-20 ℃保存備用。
1.5 不同品種番茄病樣RT-PCR檢測
1.5.1 常規PCR檢測 利用TYLCV特異性引物(表1)按照說明書進行常規PCR擴增,擴增體系(20 μL):2×TaqMaster Mix (Dye Plus)10 μL,TYLCV-F/TYLCV-R引物各0.5 μL,模板2 μL,ddH2O 7 μL 。擴增條件:94 ℃ 4 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 45 s,34個循環;最后72 ℃延伸10 min,-20 ℃保存。
1.5.2 RT-PCR檢測 分別利用特異性引物(表1)按照說明書步驟進行RT-PCR擴增,擴增體系(20 μL):2×TaqMaster Mix(Dye Plus) 10 μL,ToCV-F/ToCV-R、TSWV-F/TSWV-R、STV-F/STV-R引物各0.5 μL,模板2 μL,ddH2O 7 μL 。擴增條件同PCR擴增。擴增結束后,分別取5 μL PCR/RT-PCR 產物在1.0%瓊脂糖凝膠上電泳檢測,并用全自動凝膠成像系統記錄結果。
1.6 不同品種番茄抗病性鑒定
參照許向陽等[22]的方法,調查每株番茄的發病情況,計算病株率并根據分級方法評估抗性等級,分別予以記錄。
病株率(%)=病株數/調查總株×100
病情指數=Σ(各級病株數×相對級數值)/(調查總株數×最高嚴重度代表值)×100
分級標準。免疫:病情指數為0,植株不帶毒;高抗:0<病情指數≤ 2;抗病:2<病情指數< 15;耐病:15<病情指數< 30;感病:病情指數>30。
2 結果與分析
2.1 番茄的田間癥狀
寧夏保護地栽培番茄在夏季和秋季病毒病發生十分嚴重,主要發病癥狀表現為開花期植株頂端葉片黃化,葉脈明顯但葉肉發黃,心葉畸形、褶皺,葉邊緣卷曲變形,葉背面葉脈變粗,植株矮化(圖1-A);部分植株表現為上部葉片縮小微卷,生長點壞死,部分葉片黃化,有些葉片除了主葉脈其余部分均出現黑色斑塊,有的葉柄也可見較淺黑色條斑(圖1-B);另外,植株表現為頂端葉片黃化、白化、褪綠,植株長勢衰弱(圖1-C);有些植株同時表現為頂部葉片黃化、卷曲、皺縮,葉面凹凸不平,葉邊緣輻射至葉脈處出現古銅色斑點或斑塊(圖1-D);除此之外,有些番茄植株呈叢生狀,植株近一半表現出心葉葉片嚴重黃化卷曲,葉片變硬變脆,節間縮短,葉片甚至干枯脫落,莖稈的支撐力減弱,植株生長停滯(圖1-E);植株生長至結果期,前期發病的植株仍表現出上部葉片黃化卷曲,底部葉片葉肉褪綠變紫,此癥狀逐漸向上部發展,且果實較健康植株小(圖1-F)。說明,寧夏番茄無土栽培田間病毒病整體發生嚴重且呈暴發趨勢,且在番茄不同品種間、不同生育期發病程度均表現不一,因此,番茄病毒病不僅僅有單一侵染,同時,復合侵染的情況也較多。

圖1 番茄病樣田間癥狀Fig.1 Field symptoms of tomato disease
2.2 番茄病樣RT-PCR鑒定分析
利用TYLCV、ToCV、TSWV、STV、ToMV、CMV和TMV特異性引物對采自田間的366份番茄疑似病樣進行PCR/RT-PCR檢測,結果表明,所檢測樣本的特異性引物TYLCV-F/TYLCV-R、ToCV-F/ToCV-R、TSWV-F/TSWV-R和STV-F/STV-R在相應處均擴增出648、450、425、681 bp的單一條帶。而ToMV、CMV、TMV和陰性對照未能擴增出目的條帶。4個目的條帶亮度有所差異,尤其與ToCV病毒所對應的條帶較其他微弱,考慮到4種病毒存在營養和空間的競爭。另外,通過田間調查不同品種番茄感病癥狀,選取寧夏賀蘭園藝產業園主栽品種‘TY1602’的病葉再次提取總RNA/DNA,并利用已經檢測出的病毒種類的特異性引物進行RT-PCR檢測,結果顯示所對應特異性引物均擴增出450、425、681和648 bp大小的特異性條帶(圖2),與預期目的條帶大小相符。說明,番茄品種‘TY1602’同時被TYLCV、ToCV、TSWV和STV侵染。
2.3 不同品種番茄病毒病復合侵染分析
從表2可看出,病毒病復合侵染情況在產業園普遍發生,且在不同品種間和不同栽培基質間均表現出差異。檢測結果顯示,有單一病毒侵染的品種,也有2種病毒復合侵染的樣品,部分品種同時被3種病毒所侵染。此外,檢測發現,有的品種植株樣本檢測出4種病毒的存在。
產業園2號溫室和13號溫室主要品種為大果硬果番茄,主要表現出2種病毒復合侵染的癥狀,而A3玻璃溫室主栽品種為水果番茄和櫻桃番茄,病毒病發生較2號和13號溫室嚴重且侵染的病毒種類為2種或2種以上,其中以3種復合侵染為主。另外,3個溫室中的番茄品種無論抗TYLCV與否,都檢出TYLCV病毒,檢出率為100%;4種病毒在不同結構溫室均有發生,除感染TYLCV病毒外,ToCV和STV在不同溫室也普遍分布;此外,玻璃溫室的番茄樣本大多可檢測到TSWV病毒。在18種番茄品種中,單一病毒侵染的品種有硬果番茄‘盛世1號’和櫻桃番茄‘香妃9號’,這2個品種在田間相較于其他品種長勢較好;其他品種均存在復合侵染。從檢測結果中同樣可得出,TYLCV病毒單一侵染占采集總樣本的10.38%;復合侵染樣本數為328份,占比為81.69%,2種病毒復合侵染占總復合侵染的72.95%,其中占比較多的是TYLCV+ToCV病毒,復合侵染率占40.44%,TYLCV+STV病毒復合侵染以及TYLCV+TSWV病毒復合侵染分別占22.68%和6.01%;3種病毒復合侵染占總復合侵染的8.47%,侵染類型有TYLCV+ToCV+STV、TYLCV+ToCV+TSWV、TYLCV+STV+TSWV,其中TYLCV+ToCV+STV、TYLCV+ToCV+TSWV復合侵染情況相當,分別占總侵染率的3.83%和3.28%,另外,占比較少的侵染類型為TYLCV+STV+TSWV;4種病毒復合侵染占總復合侵染樣本的0.27%,為TYLCV+ToCV+STV+TSWV。可見,番茄病毒病復合侵染現象已在該園區大面積發生。
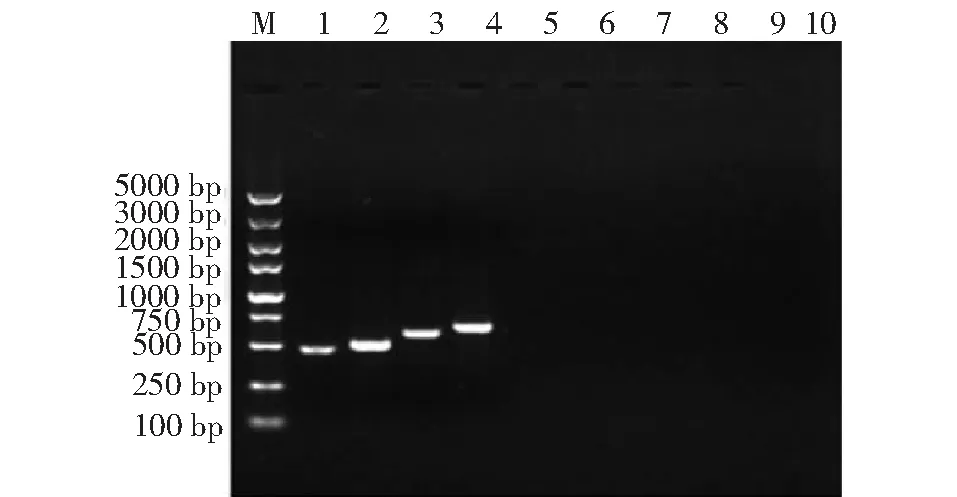
M.分子質量標準 DL5000 DNA Marker;1. 番茄褪綠病毒;2. 番茄斑萎病毒;3. 南方番茄病毒;4. 番茄黃化曲葉病毒;5. 番茄花葉病毒;6. 黃瓜花葉病毒;7. 煙草花葉病毒;8~10.陰性對照M. Molecular mass standard DL5000 DNA Marker; 1. TSWV; 2. ToCV; 3. STV; 4. TYLCV; 5. ToMV; 6. CMV; 7. TMV; 8-10. Negative control圖2 部分番茄樣品的PCR檢測凝膠電泳結果Fig.2 PCR detection GEL electrophoresis results of some tomato samples
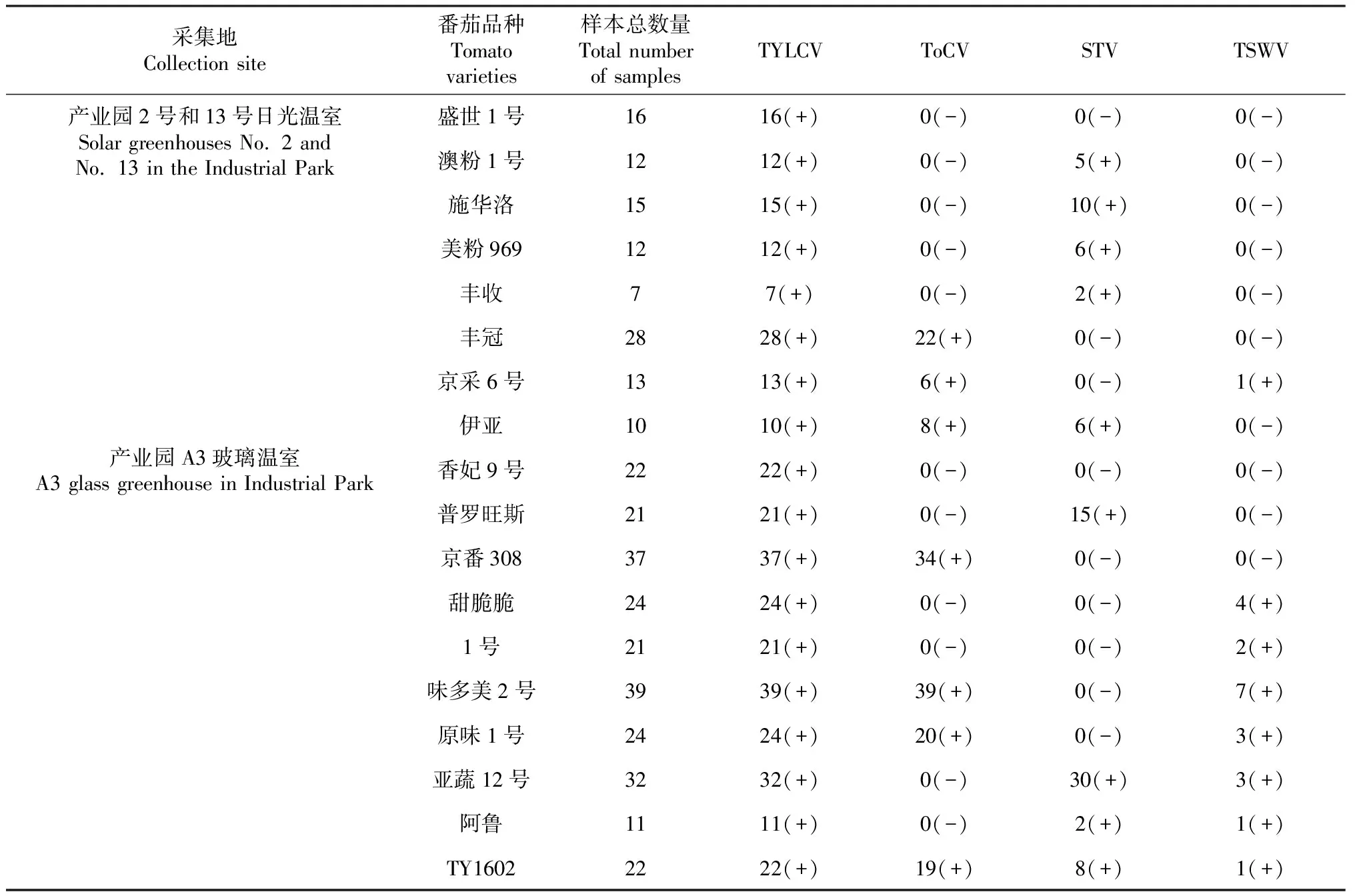
表2 不同品種番茄病毒病檢測鑒定
2.4 不同品系番茄病毒病抗性分析
不同番茄品種對病毒病的抗性表現不同(表3),在所有品系番茄中,除‘豐冠’為感病品種外,其他品系番茄都表現出不同程度的抗性。其中,硬果番茄‘豐收’,口感番茄‘京采6號’‘1號’以及櫻桃番茄‘阿魯’和‘香妃9號’表現為高抗水平;抗性等級為抗病的品種有‘盛世1號’‘澳粉1號’‘施華洛’‘伊亞’‘美粉969’‘TY1602’‘普羅旺斯’‘亞蔬12號’‘甜脆脆’‘原味1號’‘京番308’‘味多美2號’,這幾個品種的病情指數最高,達到14.0,其中‘澳粉1號’的病指最低,為2.3。高抗品種占參試總品種的27.78%,而大多數為抗性品系,占總品系的66.67%。
3 討 論
本研究利用分子技術手段,對采自寧夏賀蘭園藝產業園疑似感染病毒的番茄植株樣品進行RT-PCR檢測,鑒定出4種病毒,分別為TYLCV、ToCV、STV和TSWV。檢測分析顯示,采集的366份樣本中,TYLCV檢出率為100%,而且TY抗性品種部分感染了TYLCV病毒,這可能是棚室溫度高于35 ℃,抗TY品種抗性減弱所致,也有可能是由于TYLCV擁有單鏈DNA病毒容易變異的屬性,導致抗性不穩定[23]。另外,被ToCV和STV侵染的樣本,分別占總采集樣本的40.44%和22.68%。其中,以煙粉虱為主要傳播媒介的病毒TYLCV和ToCV,自被寧夏報道[8,24]以來,已發展為該地區的優勢病毒種類。凡是我國番茄主栽區,TYLCV和ToCV同樣為侵染番茄的主要病原[21]。高溫和干旱是病毒病發病的有利條件,粉虱的發生情況與病毒的發生呈正相關關系[25]。因為采樣時期(8、9月)正值煙粉虱高發季,加之今年夏季整體溫度較高,降雨少,棚室內粉虱大量聚集,為粉虱的發生和繁殖創造了有利條件。除此之外,番茄發病程度與其發育階段也有密切聯系[26],采樣地區番茄定植時期為7、8月,沒有避開番茄易感病期,且遇粉虱高發期,因此出現大面積侵染TYLCV和ToCV。
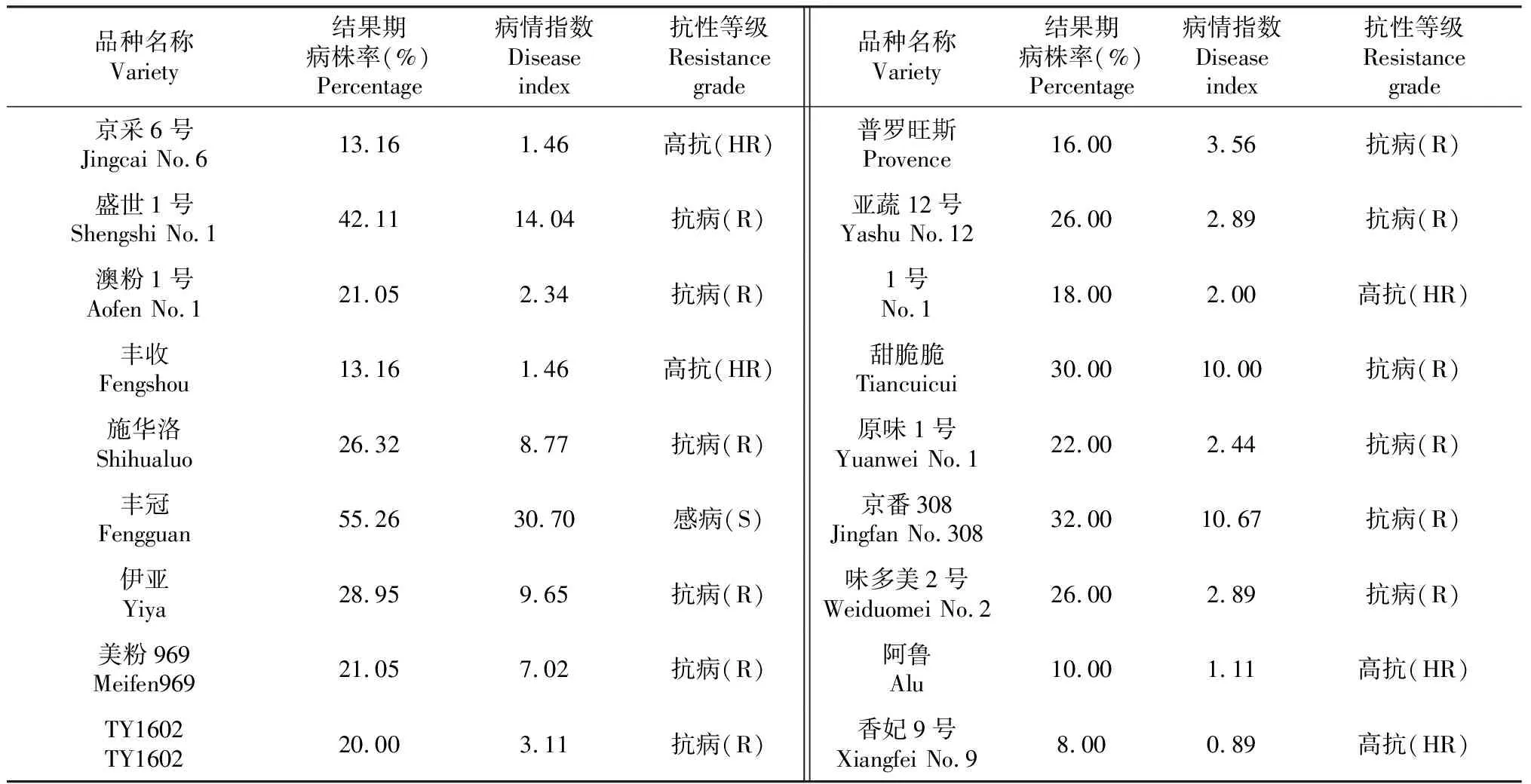
表3 不同品系番茄病毒病抗性評價
自然條件下,出現2種或2種以上病毒復合侵染植物的情況已司空見慣,當不同病毒復合侵染時,作物更多表現出協生作用[27]。本研究發現,寧夏地區番茄復合侵染現象已不足為奇,復合侵染的樣本占總樣本數量的81.69%,復合侵染形式以TYLCV與ToCV、STV以及TSWV復合侵染為主,其中2種病毒復合侵染占多數,且TYLCV和ToCV病毒復合侵染為樣本采集地區的侵染優勢種,占總復合侵染率的40.44%。我國山東[28]、云南[29]、江蘇[30]、河南[31]、河北[32]等多個地區也有TYLCV和ToCV復合侵染的相關報道[33],這可能是由于昆蟲獲毒、傳毒效率與病毒互作所致[34],也有可能是感染其中一種病毒的植株失去抵御另外一種病毒的能力。另外,本研究檢測到ToCV與TSWV病毒復合侵染,這是因為2種病毒之間存在協生作用[35]。除此以外,也檢測到STV與TYLCV、ToCV、TSWV其中的1種甚至2種或3種復合侵染。研究指出,STV通常與其他病毒復合感染,在山東,有STV與TYLCV、CMV、TOCV復合侵染的報道[36];新疆出現STV、CMV、PVY、ToMV復合侵染的現象[37];北京也檢測到STV與TYLCV、ToCV復合侵染[38]。可見,種傳病毒STV不容小覷,應引起重視。
通過田間病毒病發生情況調查以及分子檢測發現,本研究所有參試品種中,大果紅果早熟番茄‘豐收’和櫻桃番茄‘阿魯’表現出高抗番茄病毒病,且在田間長勢良好,植株總體健康,其次為粉果番茄‘澳粉1號’‘京采6號’和鮮食番茄‘1號’‘亞蔬12號’‘原味1號’,這幾個品種在田間總體表現良好,并且病毒侵染率也較其他品種低。‘豐冠’‘味多美2號’‘京番308’植株病毒侵染率高達74%~78%。就目前的抗病毒品種而言,學者們通過不同方法選育了一些抗性較高的品種。邵秀麗等[39]將‘牟番38’進行了不同區域和不同茬次種植,進行植物學性狀評價和田間抗病性評估,得出此品種田間抗番茄TY病毒病;帕提古麗·艾斯木托拉等[40]通過抗病性、植株生物學、果實品質和產量綜合分析,篩選出‘歐瑞斯’‘奧力奧’‘新達利’優質品種。另外,李亞茹等[41]提出對抗性表現較好的基因采用聚合育種,從而提高品種抗性能力。
初步判定‘豐收’‘阿魯’‘澳粉1號’‘京采6號’‘1號’‘亞蔬12號’‘原味1號’這幾個品種為抗病毒品種,但缺少品種與多種病毒靶標對峙抗性,后期可進一步驗證抗病毒品種。此次在寧夏采樣范圍和采樣時間均有局限,檢測到的病毒種類并不完全,下一步可在不同時間段對寧夏地區各市縣進行番茄病毒病調查以及采樣鑒定,為寧夏番茄產業提供理論依據和技術指導。
4 結 論
番茄病毒病復合侵染在寧夏地區已大面積發生,且呈暴發趨勢,應當引起高度重視和警惕,為寧夏地區番茄病毒病預警、檢測及防治奠定理論依據。

