腦栓通膠囊對局灶性腦缺血再灌注大鼠血管新生的影響*
郭 敏 劉婷婷 吳 錚 田 欣 祝自新 鄭文榮 王宇峰 鄭瑞芳 邢建國 孫芳玲 王 文,3
(1.首都醫科大學宣武醫院實驗動物室,北京 100053)(2.北京市老年病醫療研究中心,北京 100053) (3.北京腦重大疾病研究院腦卒中研究所,北京 100053)(4.新疆維吾爾自治區藥物研究所,烏魯木齊 830002)
缺血性卒中是由于腦部血液供應障礙造成大腦神經功能損傷的腦血管疾病,具有高致殘率和高病死率等特點[1]。卒中發生后腦內會發生一系列復雜的病理生理變化,包括興奮性毒性、氧化應激、血腦屏障的通透性和炎性反應,最終導致細胞死亡[2]。盡早恢復腦缺血區域的血流量,可以挽救腦組織功能,有助于患者康復。研究表明,神經血管的微環境改變可以誘導血管新生,對卒中的后期康復起著重要作用[3]。血管生成是腦缺血后微血管形成和血運重建的關鍵過程,在缺血邊界區形成有效而功能性強的血管可以為患者提供充足的血流,減少梗死體積,新生微血管的生長為新生神經元提供了必要的神經營養[4]。血管內皮生長因子(vascular endothelial growth factor,VEGF)和堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)參與調節許多生理病理活動,尤其在促進血管生成、修復神經系統損傷中起到重要作用[5]。研究表明,通過給予外源性藥物或分子生物學手段提高VEGF與bFGF的表達,可以促進血管新生,進而促進缺血性腦損傷恢復[6-7]。
腦栓通膠囊主要由蒲黃、赤芍、郁金、漏蘆、天麻組成,具有活血化瘀、通達血脈的作用。臨床研究表明,腦栓通可以改善卒中患者神經功能,降低炎性反應,提高生活質量[8-9],但是其改善神經功能的具體作用機制并不清楚。本實驗通過觀察腦栓通膠囊對局灶性腦缺血再灌注模型大鼠神經功能損傷的修復、大腦梗死體積、皮層血管新生相關蛋白VEGF與bFGF表達以及梗死區周邊血管新生的影響,探討腦栓通膠囊對大鼠缺血性腦損傷的保護作用及其對血管新生的影響,為更好地應用于臨床治療提供理論依據。
1 材料和方法
1.1 藥物與試劑
腦栓通膠囊由廣東華南藥業有限公司生產(國藥準字Z20040093)。
1.2 實驗動物分組及給藥
健康SPF級別260~280 g雄性SD大鼠,北京大學醫學部(實驗動物科學部)提供【SCXK(京)2016-0010】,本實驗由宣武醫院實驗動物福利與倫理委員會審查,倫理審批號:20180928。首都醫科大學宣武醫院實驗動物室SPF級常規飼養,環境溫度(24±2)℃,濕度(55±5)%,術前過夜禁食不禁水。隨機分為假手術組、模型組、腦栓通膠囊小(1.05 g/kg)、大(2.62 g/kg)劑量給藥組,每組動物5只。采用線栓法制備大鼠局灶性腦缺血再灌注模型,術后連續灌胃給藥7 d,每天給藥1次,其中假手術組和模型組每天灌胃等體積雙蒸水。
1.3 主要試劑
抗VEGF抗體、抗bFGF抗體(Santa公司),抗Ki67抗體(Abcam公司),Lectin (Vector Laboratories公司),抗β-actin抗體、辣根過氧化物酶標記山羊抗兔二抗、辣根過氧化物酶標記山羊抗鼠二抗(北京中杉金橋生物技術有限公司),Alexa 594 二抗(Life Technologies公司)。
1.4 模型制備
局灶性腦缺血再灌注模型采用Zea Longa’s改良線栓法制備[10]。大鼠用1%戊巴比妥鈉35 mg/kg腹腔注射進行麻醉,仰臥位固定于手術操作臺上,碘伏消毒頸部皮膚。頸部正中剪約2 cm切口,分離大鼠右側頸總動脈、頸內動脈和頸外動脈,結扎頸外動脈和頸總動脈的近心端,0動脈夾夾閉頸內動脈,在動脈夾與頸總動脈近心端之間結扎一活結。在近心端距頸總動脈分岔約2 mm處用顯微剪細小切口,將直徑為0.26 mm的線栓插入動脈切口,稍扎緊縫合線,繼續推動線栓進入頸內動脈,直至出現阻擋感,說明線栓已經越過大腦中動脈,到達大腦前動脈的起始部,此時不再繼續推入線栓,將線栓與頸總動脈一并扎緊。記錄栓塞開始時間。30 min局部缺血后,移除線栓進行血流再灌注,縫合皮膚。假手術組,除不插入線栓外,其他操作相同。
1.5 改良神經功能缺損評分(mNss)法
大鼠連續灌胃給藥7 d后進行行為學評分,本實驗采用mNss法評估各組大鼠神經功能缺損情況[11-12],主要包括:運動、感覺、平衡木及反射4項測試,總分為18分,得分越高表明神經功能損傷情況越嚴重。
1.6 大鼠腦梗死體積的測定
大鼠用1%戊巴比妥鈉35 mg/kg腹腔注射麻醉,斷頸椎處死,立刻取出腦組織。將腦組織置于-20 ℃冰箱中20 min后取出,去除嗅球、小腦和低位腦干,放入腦槽中沿冠狀面切片,由前向后每隔2.0 mm作冠狀切片,共切6片。將切片放入2% TTC染色液中,放入37 ℃水浴箱中避光孵育,每隔一段時間搖動一次,30 min后取出,正常組織顯示出紅色,梗死組織顯示為白色[13]。再將腦片置于4%多聚甲醛固定液中固定1 d,取出后放入掃描儀中進行掃描。保存圖片,用圖像分析系統Image Pro Plus 6.0計算腦片的梗死面積、腦片面積。腦梗死體積百分比為:腦梗死體積百分比=(腦片總梗死面積/腦片總面積)×100%。
1.7 Western blot檢測VEGF與bFGF表達
造模7 d后,大鼠用1%戊巴比妥鈉35 mg/kg腹腔注射麻醉,迅速剝離腦組織,刮去腦膜,取出患側皮層置于EP管中稱重,加入10 mL/g腦組織體積的裂解液,超聲粉碎。冰上靜止30 min,4 ℃ 12 000 r/min 離心30 min,取上清。BCA法定量蛋白濃度,加入裂解液,調節各組總蛋白濃度一致。總蛋白加入5×上樣緩沖液1∶4稀釋,金屬浴95 ℃變性10 min。
采用10% SDS-PAGE分離膠,濃縮膠用5% SDS-PAGE。濃縮膠電壓60 V,40 min,分離膠電壓100 V,90 min,電泳分離蛋白。NC膜轉膜,將條帶置于5%脫脂奶粉中,室溫封閉2 h;分別加抗VEGF抗體(1∶1 000)、抗bFGF抗體(1∶1 000)和抗β-actin抗體(1∶1 000),4 ℃孵育過夜。次日加相應辣根過氧化物酶(HRP)標記二抗室溫孵育2 h。ECL顯色1 min,濾去顯色液,凝膠成像儀拍片。Quanity One軟件分析蛋白條帶吸光度值。
1.8 免疫熒光染色檢測Ki67/Lectin共表達
造模7 d后,每組選取5只大鼠用4%多聚甲醛進行心臟灌注后取腦,腦組織蔗糖梯度脫水后用冰凍切片機進行切片,厚度為20 μm。將隨機挑選的腦片用3‰ PBST清洗腦片3次,每次5 min。隨后加入由 3‰ PBST 稀釋的5%的驢血清室溫封閉2 h,加入由5% 驢血清稀釋濃度1∶200的Ki67一抗、濃度1∶400的Lectin,4 ℃孵育過夜。次日PBS緩沖液清洗3次,每次5 min,加入Alexa 594 熒光二抗,濃度為1∶400,室溫避光孵育2 h,DAPI封片。激光共聚焦(Olympus)觀察梗死周邊區域并進行拍照,用圖像分析系統Image Pro Plus 6.0分析。
1.9 統計學方法
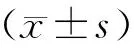
2 結果
2.1 腦栓通膠囊對局灶性腦缺血再灌注模型大鼠神經功能損傷的影響
大鼠局灶性腦缺血再灌注造模后,連續給藥腦栓通膠囊治療7 d,采用mNss評分體系分別對假手術組、模型組、腦栓通膠囊小劑量給藥組和腦栓通膠囊大劑量給藥組進行神經功能評價。統計結果顯示,相對于模型組,腦栓通膠囊小劑量給藥組和腦栓通膠囊大劑量給藥組神經功能損傷有一定改善且有統計學差異(P<0.05)(表1)。

表1 腦栓通膠囊對大鼠神經功能損傷的影響Table 1 Effects of Naoshuantong capsuleon neurological function of
2.2 腦栓通膠囊對局灶性腦缺血再灌注模型大鼠大腦梗死體積的影響
TTC染色結果顯示,局灶性腦缺血再灌注后大鼠腦片出現明顯白色梗死灶(圖1)。與模型組比較,腦栓通膠囊小劑量給藥組的大腦梗死體積有所減小,但沒有顯著性差異;腦栓通膠囊大劑量給藥組能夠顯著減小大腦梗死體積且有統計學差異(P<0.05)(表2)。

圖1 各組腦組織梗死體積比較Fig.1 Comparison of the infarct volume ofbrain tissue in each group

表2 腦栓通膠囊對大鼠大腦梗死體積的影響Table 2 Effects of Naoshuantong capsule oncerebral infarction volume in
2.3 腦栓通膠囊對局灶性腦缺血再灌注模型大鼠皮層血管新生相關蛋白VEGF表達的影響
采用Western blot的方法檢測局灶性腦缺血大鼠患側皮層VEGF蛋白表達的情況。與假手術組相比,模型組大鼠缺血側皮層VEGF表達有增加的趨勢,但沒有統計學差異。與模型組大鼠相比,腦栓通膠囊小劑量給藥組和腦栓通膠囊大劑量給藥組VEGF水平明顯增加(P<0.05,P<0.001)(圖2,表3)。

圖2 各組大鼠患側皮層VEGF表達水平Fig.2 VEGF expression in ipsilateralcortex of rats in each group

表3 腦栓通膠囊對大鼠患側皮層VEGF表達的影響Table 3 Effects of Naoshuantong capsule on VEGFexpression in ipsilateral cortex of
2.4 腦栓通膠囊對局灶性腦缺血再灌注模型大鼠皮層血管新生相關蛋白bFGF表達的影響
采用 Western blot 的方法檢測局灶性腦缺血大鼠患側皮層bFGF蛋白表達的情況。結果顯示,與假手術組相比,模型組大鼠缺血側皮層bFGF表達有增加的趨勢,但沒有統計學差異。與模型組大鼠相比,腦栓通膠囊小劑量給藥組和腦栓通膠囊大劑量給藥組bFGF水平明顯增加(P<0.05,P<0.001)(圖3,表4)。

圖3 各組大鼠患側皮層bFGF表達水平Fig.3 bFGF expression in ipsilateralcortex of rats in each group

表4 腦栓通膠囊對大鼠患側皮層bFGF表達的影響Table 4 Effects of Naoshuantong capsule on bFGFexpression in ipsilateral cortex of
2.5 腦栓通膠囊對局灶性腦缺血再灌注模型大鼠梗死區周邊血管新生的影響
采用Lectin+/Ki67+免疫熒光雙染檢測大鼠腦組織梗死周邊區域血管新生情況。如圖4所示,缺血損傷后,皮層梗死區可觀察到明顯的Lectin+/Ki67+血管內皮細胞增殖。結果顯示,與假手術組相比,模型組大鼠梗死周邊區域Lectin+/Ki67+新生血管內皮細胞數量有增加的趨勢,但沒有統計學差異。與模型組大鼠相比,腦栓通膠囊小劑量給藥組和腦栓通膠囊大劑量給藥組新生血管內皮細胞數量明顯增加(P<0.05,P<0.001)(表5)。

注:n=5 標尺=50 μmNote: n=5, Scale bar=50 μm圖4 各組大鼠梗死區周邊Lectin+/Ki67+表達情況Fig.4 Expression of Lectin+/Ki67+ in theischemic penumbra of rats in each group

表5 腦栓通膠囊對大鼠梗死區周邊Lectin+/Ki67+表達的影響Table 5 Effects of Naoshuantong capsule on theexpression of Lectin+/Ki67+ in the
3 討論
缺血性卒中發病后,缺血核心區域的損傷是不可逆的,而在核心區外圍半影區的腦組織如治療及時,腦血液供應恢復,神經元功能可得到修復[14]。腦栓通膠囊是原國家食品藥品監督管理局于2004年批準的中藥6類新藥, 臨床上用于缺血性卒中急性期及恢復期的治療[15-16]。有研究表明,腦栓通膠囊可以抑制腦缺血再灌注大鼠神經元凋亡,改善神經功能缺損[17]。有研究表明,腦栓通膠囊可以降低急性腦梗死大鼠炎性因子水平,改善MMP9、TIMP-1表達[18]。但腦栓通膠囊對血管生成是否起作用尚不清楚。本研究通過檢測大鼠大腦皮層梗死區周邊血管新生情況及血管新生相關蛋白bFGF和VEGF的表達,初步探究腦栓通膠囊對血管生成的作用機制。
卒中后缺血缺氧環境可以激活血管內皮細胞,促進血管新生,進一步促進側支循環建立,對改善腦組織缺血缺氧狀態,促進神經功能的恢復有重要意義[19]。血管新生過程包括血管內皮細胞的激活、增殖和遷移,形成新的管腔,進一步融合成血管網[20]。該過程涉及多種因子和信號通路相互作用及精確的分子調控機制,其中VEGF是血管新生調控的關鍵因子。在腦內,VEGF由神經元、星形膠質細胞和血管內皮細胞等產生和分泌[21]。缺血性卒中發生急性期,VEGF水平升高,可以直接與血管內皮細胞上的受體結合,激活細胞內血管生成相關信號通路,促進出芽式血管新生,從而起到腦保護作用[22]。bFGF在血管新生過程中也發揮著重要作用[23]。研究表明,缺血性卒中后,bFGF水平顯著升高,通過自分泌或旁分泌的方式促進血管內皮細胞增殖和分化,同時也能增強內皮細胞的黏附、識別和遷移功能,以促進新血管形成,從而修復受損腦組織[24]。本研究表明,在缺血性腦損傷后,VEGF和bFGF蛋白表達有上升趨勢,在給予腦栓通膠囊治療后,VEGF和bFGF蛋白表達水平進一步增加。
為了進一步探究腦栓通對卒中后血管新生的作用,用Ki67和Lectin免疫熒光標記檢測了腦缺血再灌注7 d后大鼠梗死區周邊新生的血管內皮細胞。Lectin與內皮細胞表面N-乙酰氨基葡萄糖寡糖結合,是嚙齒動物血管的有效標志物,Ki67是核抗原和細胞增殖的標志物[25]。本研究表明,腦栓通膠囊治療后,新生的血管內皮細胞數量顯著增加,提示腦栓通膠囊可能通過上調卒中后VEGF和bFGF的表達促進血管新生,進而促進腦組織的修復。
綜上所述,腦栓通膠囊能縮小局灶性腦缺血大鼠腦梗死體積,改善神經功能,并且該保護作用與促進血管新生有關。后續研究將進一步通過明確腦栓通膠囊促卒中后血管新生的作用和機制,為腦栓通膠囊再生修復治療卒中作用提供實驗依據。

