基于LPS受體小肽的抗多黏菌素大腸桿菌的ELISA法的建立*
段悅慶 柯舒文 楊 華 唐 標 劉月環,2
(1.杭州醫學院臨床醫學院,杭州 310053)(2.杭州醫學院 浙江省實驗動物與安全性研究重點實驗室,杭州 310013) (3.浙江省農業科學院農產品質量安全與營養研究所,杭州 310021)
多黏菌素因其高發腎毒和神經毒性[1]曾在臨床上被棄用,近年來又成為治療多重耐藥的革蘭陰性菌。Mcr-1是存在于大腸桿菌的一種質粒攜帶的多黏菌素耐藥基因,2016年首次發現于中國[2],存在于不同的菌屬中[3]。動物性食品、環境和人體皆可以作為轉移耐藥基因的宿主[4-6]。日趨嚴峻的多重耐藥與超級細菌嚴重威脅著人類健康,研發快速、高效的檢測方法顯得尤為緊迫。目前該領域的檢測方法除了肉湯微量稀釋法外,均是針對mcr耐藥基因的PCR檢測方法[7-11],對專業技能要求高、耗時長、需要專用PCR儀等缺點限制了臨床推廣。
多黏菌素耐藥性產生的機制提示細胞壁脂多糖(lipopolysaccharide,LPS)中的脂質A受到mcr-1的修飾,產生磷酸乙醇胺基團,使得細菌表面負電荷減少,導致多黏菌素與LPS減少互作,從而產生了耐藥性[12]。炎性反應研究表明,體內LPS與其受體結合后引起TLR4通路的改變以調節炎性反應的轉歸[13],基于上述啟發,結合LBP、TLR4、CD14和SR-IIA的氨基酸序列,本研究分析了脂質A的結合肽序列獲得了相應的MOTIF,根據這個MOTIF設計出能與LPS結合的小肽,建立了基于小肽的夾芯式ELISA檢測法,現將研究結果報告如下。
1 材料和方法
1.1 主要材料和儀器
酶標儀(SpectraMax M4,MolecularDevices公司),分析天平(MSE2258-00TU,Sartorius公司),多功能空氣振蕩器(HZY-124/223,華志公司),生化培養箱(SPX-250,常州偉嘉)。
多黏菌素耐藥性的陰性對照菌株來源于浙江工業大學微生物學實驗室。陽性對照菌為含mcr-1基因的大腸桿菌株均來自浙江省農科院。野外(大田)樣品來自浙江省內不同地區,土壤3份、自來水泥水1份及河水樣1份,共5份隨機取自浙江省兩個市的1區4縣,專業養殖場樣品隨機取自浙江省某鴨場土樣1份,雞場糞樣2份,豬場泥水樣1份。實驗動物相關樣品包括用于制備動物模型的高脂飼料原料蛋黃粉(EYP)4份,屏障系統的實驗動物過濾飲用水5份,上述樣品均采于省內某實驗動物生產基地。菌種和制備完畢的大田樣品均保存于浙江省實驗動物與安全性研究重點實驗室,陰、陽性對照菌用指數期菌,用前在LB培養基37 ℃培養4 h或過夜,野外(大田)樣采用0.9%氯化鈉溶液稀釋法來制備,最大程度體現了取樣現場多黏菌素抗性的原始狀態。
1.2 小肽的設計、合成與工作濃度的確定
篩選分析LPS受體復合物序列及空間結構獲得其MOTIF序列:XSS/FS/FISSXRAC,對其進行分析后設計出能識別LPS的肽段,并將肽段優化為9~13個氨基酸的小肽,使其適用于制成檢測大腸桿菌菌體的抗原,小肽由南京金斯瑞公司人工合成。小肽包被起始濃度為4 μg/mL,2 μg/mL,1 μg/mL,0.5 μg/mL,0.25 μg/mL(250 ng/mL),0.13 μg/ml(125 ng/mL),0.06 μg/mL(62.5 ng/mL),0.03 μg/mL(32.25 ng/mL),已知陰陽性的指數菌250倍稀釋后為待檢樣品,商品化的脂質A鼠抗體為一抗(1∶100)(ABCAM ab8467),HRP標記的羊抗鼠IgG(1∶5 000)(杭州華安 HA1006),建立ELISA體系。
1.3 耐多黏菌素E.coli的ELISA法檢測體系確立及試劑盒的研究
在對抗原小肽,待檢樣本,阻斷液(過氧化氫),一抗,二抗,顯色液,終止液的合適工作濃度逐一進行摸索后,獲得具有自主知識產權的以小肽為基礎的耐多黏菌素E.coli的ELISA法檢測體系及試劑盒。
1.4 試劑盒的檢測步驟與說明
檢測步驟:按常規ELISA法[14]操作如下:加樣(250倍指數菌100 μL)→孵板,洗滌→加入一抗(生物素標記的13小肽,1∶1 000)→孵板,洗滌→加入二抗(1∶2 500~5 000)→孵板洗滌→加入底物顯色液→終止,讀A值。結果判斷,A值<0.3為陰性,>0.4為陽性,范圍在0.3~0.4,則應重復檢測1~3次,若A值均值/陰性孔的A值均值大于2.1均判為陽性,小于2.1判為陰性。
1.5 PCR法作為對ELISA法的準確性參照
在檢測體系建立的過程中,以mcr-1的PCR對間接ELISA法檢測結果進行校核,既是確定檢測結果準確性的措施,又是試劑盒質控過程的重要步驟。本實驗PCR檢測方法按參考文獻[9]的方法進行驗證,實驗結果兩種方法相符。結果也在本研究試劑盒敏感性中體現。
1.6 培養法測定最低檢出量的限值
將待檢樣品倍比稀釋(先按檢測方法250倍作為一個檢測樣,再按1 000倍,100萬倍這樣稀釋作為一個檢測樣)后,取稀釋液2 μL涂于LB固體培養基,測出CFU值,然后用ELISA法測出稀釋液的A值,確定最大稀釋倍數與A值對應關系,即CFU為0時的A值。多黏菌素選擇性培養基中黏菌素終濃度為4 μg/mL。
1.7 試劑盒的質控
在以上實驗基礎上組裝檢測試劑盒,同時擴大樣本種類、含量,就檢測試劑盒的精密性、特異性、敏感性、重復性進行測試與優化,形成可以用的產品(含說明書)。
1.7.1敏感性:將已知多黏菌素耐藥陰性(5份)與陽性(3份)的菌株從1∶50起連續倍比稀釋至第8孔(1∶390 725),倍差為5倍,采用多黏菌素耐藥的大腸桿菌夾芯ELISA抗體檢測試劑盒對上述稀釋后的樣品進行檢測,得到A值數據,然后就以相應稀釋度的待檢液作為模板,裂解后用PCR法進行驗證。
1.7.2特異性:取多黏菌素耐藥陰性(含LPS、血清、載體、BSA、β-actin、Marker、酪蛋白、甘氨酸、水、TAE緩沖液等)的大腸桿菌菌株培養液,用小肽包被的ELISA法(1∶250)進行測定,然后將此菌株做藥敏或PCR實驗,將二者結果進行比較,計算陰性與陽性的檢出率及兩種方法的符合率。
1.7.3精密性:取陰陽性樣品各一份,1∶250倍稀釋后,各用半塊(6條)小肽包被的96孔板測定,得到的結果分別計算平均值及標準差,計算板內變異系數,變異系數小于9,即為精密性合格。
1.7.4重復性:取多黏菌素耐藥陽性陰性的菌株樣品,每個樣品用小肽包被的板連續測定8遍,觀察8次檢測結果的平均值,如果平均符合陰陽性判斷標準,則判為重復性符合預期。
1.8 試劑盒的使用效果
收集各種環境下已知陰陽性的實驗室純培養的指數期菌69份,野外(大田)樣品6份,蛋黃粉樣品及實驗動物飲用水樣品9份,用本試劑盒按1.4步驟進行檢測。
2 結果
2.1 ELISA檢測樣本量
檢測樣本包括10份陽性菌、6份陰性菌、5份野外(大田)樣品、4份蛋黃粉(EYP) 以及5份來自屏障系統的實驗動物過濾飲用水(Water),各樣品使用量見表1。
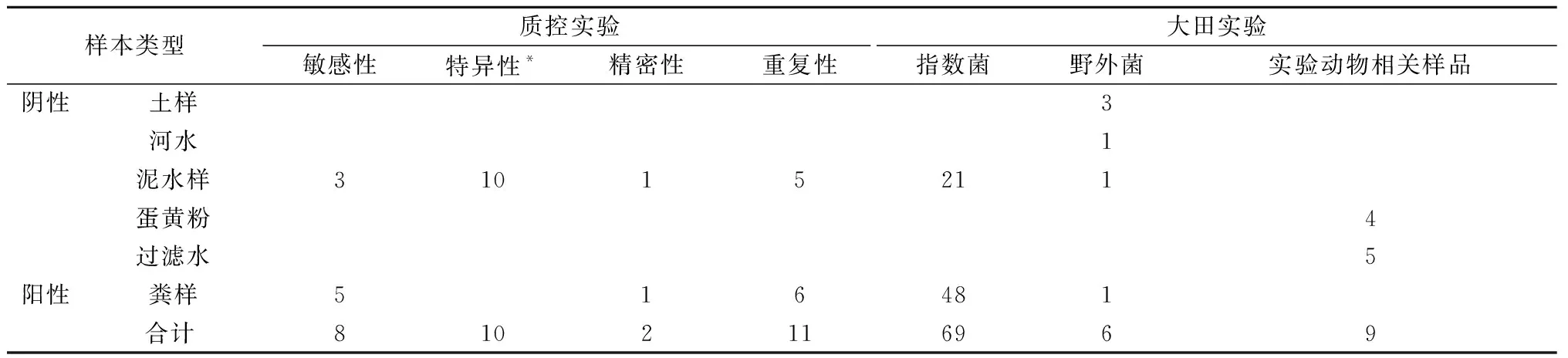
表1 抗多黏菌素大腸桿菌ELISA法檢測樣本數統計表Table 1 Samples by polymyxin- resistance E. coli ELISA
2.2 小肽的工作濃度
第一輪ELISA,脂質A鼠抗體為一抗(1∶100)(ABCAM ab8467),HRP標記的羊抗鼠IgG(1∶5 000)(杭州華安 HA1006)用于確定小肽的工作濃度(含用作抗原的小肽和用生物素標記的小肽的工作濃度),測出A值,根據ELISA法的方陣滴定法的經驗,A值為1.0左右時定為合適的小肽工作濃度對應值,其對應的小肽工作濃度為2 ng/μL,將之用于夾芯ELISA法包被的抗原預包被于96孔板,成為ELISA法中的酶標板。抗原確定為9肽,一抗確定為13肽后進行生物素標記,其后工作濃度確定為1∶1 000,二抗系商品化HRP標記的鏈霉親和素(說明書的工作濃度為1∶2 000~100 000)。
2.3 試劑盒的組裝
試劑盒組成:96孔小肽包被的ELISA板一塊;阻斷液1瓶,一抗1瓶,生物素標記的13肽、二抗1瓶;HRP底物液二瓶,終止液1瓶,陰性對照一瓶,陽性對照一瓶,空白對照一瓶,20倍濃縮洗液1瓶。
2.4 培養法測定最低檢出量的限值
在ELISA法A值區分為陽性(大于0.4)和陰性(小于0.3)的情況下,9個大田樣品經培養(微量肉湯稀釋法)涂板后觀察到的最大檢出限值為3×103個CFU/mL,最小的檢出限值為1.5×103個CFU/mL,經過多黏菌素選擇性培養基涂布法檢出限為0~2.5×103個CFU/mL。
2.5 試劑盒的質控結果
5份陽性樣品A值均在1∶50~1∶156 250(第1孔到第6孔)的稀釋倍數之間,敏感性符合率100%,10份多黏菌素耐藥陰性(含LPS,血清,載體,BSA,β-actin,Marker,酪蛋白,甘氨酸,水,TAE緩沖液等)的大腸桿菌菌株培養液各待檢樣品均呈陰性,試劑盒特異性良好。陰性樣品與陽性樣品各1份經過250倍稀釋后進行了精密性測試,得出的變異系數符合小于9的預期。用小肽包被的板對多黏菌素耐藥陽性6份與5份陰性的菌株樣品加樣后,每個樣品連續測定8遍,計算平均值,陰陽性組結果符合預期,重復性良好。
兩種方法相比較得出,ELISA法A值大于0.4 時對應于圖1中的B~F,均擴增出了1 626 bp的產物,而G,H沒有條帶,可能是由于稀釋度太大,即稀釋度大于1∶312 50的指數菌用本實驗 的ELISA法就無法檢出了,這完全滿足了檢驗下限的需求。
2.6 試劑盒的試用效果
48份陽性菌及21份陰性工程菌的檢測結果中,陽性菌均被檢出,陰性菌均未被檢出。6份不同性質的野外樣品僅糞樣為陽性,其余為陰性。9份實驗動物相關的樣本檢測結果均為陰性。

注:A和T.DNA Marker;B—S.多黏菌素耐藥陽性菌從原液開始連續做1∶50稀釋后的PCR結果Note:A and T.DNA Marker;B—S.PCR of polymyxin-resistant E.coli diluted continuously for 1∶50 from exponential phases圖1 ELISA敏感性檢測中的樣品1各稀釋度用PCR法擴增mcr-1 基因的結果Fig.1 Dilution of sample 1 detected by mcr-1 gene PCR in ELISA sensitivity test
3 討論
目前新型耐藥性檢測都是針對mcr-1及其同族基因的PCR法,雖有高度特異性、敏感性等優點,但因其專業技能要求高、耗時長等要求,不易短時間內大眾化推廣;環介導的快速擴增目測法(LAMP)相比PCR法靈敏度更高、操作簡單耗時更短,但易造成氣溶膠污染[16]。微量肉湯稀釋法及藥敏檢測因定性定量,可重復性好,不需昂貴設備而成為耐藥檢測領域的金標準[17-19]。但這些方法在臨床應用時則因為需要較長的孵育時間而導致不能及時指導抗感染治療,在野外環境下則沒有可用的儀器或檢測時間長而導致使用范圍受限[20-21]。
本研究中建立的針對多黏菌素耐藥的大腸桿菌的夾芯ELISA檢測方法在敏感性、特異性、精密性和重復性上面均達到了滿意的效果,初步應用檢測的樣本均達到了滿意的效果。本次對高脂模型飼料原料——蛋黃粉及屏障系統動物飲用水的陰性檢測結果證實了因實驗動物屏障系統微生物等級的嚴格控制使得耐藥性的傳播在一定程度上得以阻斷。另外,本研究使得檢測方法從核酸水平重回蛋白水平,檢出效率大大提高,檢測工作從復雜變為簡單,試劑都是常見成分,成本低,為今后的標準化、智能化檢測技術的全面鋪開提供了基礎,為多黏菌素的減量[22]使用與耐藥性治理提供了技術支撐。

