菟絲子總黃酮對大鼠卵巢儲備功能減退的改善作用
頓彩虹, 白愛紅, 謝文燕, 戚靜宜
(1.漯河市婦幼保健院生殖遺傳科,河南漯河 462000;2.洛陽市中心醫院生殖醫學科,河南洛陽 471699)
卵巢儲備功能是指卵巢皮質區域卵泡生長、發育、形成可受精卵泡的功能,反映女性生育潛能及生殖內分泌功能[1]。若卵巢儲備功能下降,將減少卵巢內儲存的可募集卵泡數目,導致卵巢形成卵子的能力減弱、卵泡質量下降,影響女性的生育能力,表現為閉經、月經稀發、不孕甚至卵巢早衰等[2-3]。中醫在調節女性生殖功能失調性疾病方面具有獨到之處,對卵巢儲備功能減退主要從肝腎辨證論治入手,同時兼顧痰濕、氣血等,可促進性腺軸恢復正常,增強卵巢功能,防止出現病理性改變,平衡性激素分泌[4]。菟絲子為旋花科植物菟絲Cuscuta chinensisLam.的種子,味辛、甘,性微溫,入肝、腎經,具有補腎益精、養肝明目、安胎的功效。菟絲子為溫陽補腎之要藥,可改善機體內分泌,增強性功能,具有抗氧化、調節免疫等作用[5]。菟絲子總黃酮為菟絲子的主要成分,現代藥理研究表明,其可改善大鼠生殖內分泌系統損傷[6],對下丘腦-垂體-性腺軸有多方面作用,可恢復下丘腦-垂體促性腺功能,增加垂體、卵巢對激素的反應性,促進卵泡發育,提高卵巢激素受體數量與功能,有類雌激素樣活性[7-8]。本研究構建卵巢儲備功能減退大鼠模型,旨在探討菟絲子總黃酮改善卵巢儲備功能的作用及其可能機制,以期為臨床應用菟絲子總黃酮改善卵巢儲備功能提供實驗基礎,現將研究結果報道如下。
1 材料與方法
1.1 實驗動物SPF級健康雌性SD大鼠68只,21日齡,體質量(50±2)g,購自北京斯貝福生物技術有限公司,生產許可證號:SCXK(京)2019-0010。實驗單位為河南中醫藥大學動物實驗中心。實驗開展前適應性飼養1周,自由攝食水,自然光照。
1.2 藥物、試劑與儀器菟絲子總黃酮(純度>98%,購自上海譜振生物科技有限公司,批號:20191204)。去氧乙烯基環己烯(4-cinylcyclohexene diepoxide,VCD)、環磷酸腺苷(cAMP)/蛋白激酶A(PKA)信號通路抑制劑H-89(純度>99%,碧云天生物技術有限公司);促卵泡激素(FSH)、促黃體激素(LH)、雌二醇(E2)、cAMP酶聯免疫吸附分析(ELISA)試劑盒(上海士鋒生物科技有限公司);兔抗大鼠卵泡刺激素受體(FSHR)、PKA、磷酸化PKA(p-PKA)、β-actin單克隆抗體(北京中杉金橋生物技術有限公司);辣根過氧化物酶標記的山羊抗兔免疫球蛋白(IgG)抗體(艾美捷科技有限公司)。電子天平(奧豪斯儀器有限公司);-80℃超低溫冰箱(美國Thermo Fisher Scientific公司);恒溫冰凍切片機、EG1150組織包埋機(德國Leica公司);全波長酶標儀(美國Thermo Fisher Scientific公司);Image-Pro Plus 6.0圖像分析軟件(美國Media Cybernetics公司)。
1.3 分組與造模68只21日齡的雌性大鼠適應性飼養1周后達28日齡,陰門開啟,經陰道脫落細胞涂片篩查,性周期正常。抽取10只大鼠設為正常組,其余構建卵巢儲備功能減退模型[9],方法:取VCD溶入芝麻油,配制濃度為80 mg/kg,每天1次,連續腹腔注射15 d,0.2 mL/只。正常組腹腔注射等體積芝麻油,每天1次。造模期間每日上午7∶00—8∶00進行陰道涂片,陰道上皮無動情周期變化,或動情周期明顯延長,則提示卵巢儲備功能減退大鼠造模成功[10]。造模成功大鼠48只,成功率為82.76%,隨機分為抑制劑組、模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組,每組12只。
1.4 干預方法造模成功后次日給藥:抑制劑組灌胃H-89 0.1 mg/kg[11],菟絲子總黃酮組灌胃菟絲子總黃酮530.1 mg/kg[12],抑制劑+菟絲子總黃酮組先灌胃菟絲子總黃酮530.1mg/kg再灌胃H-890.1mg/kg,模型組、正常組灌胃等體積生理鹽水,均連續4周,每周休息1 d。
1.5 觀察指標與方法
1.5.1 取材 給藥結束后,用戊巴比妥鈉麻醉大鼠,經腹主動脈取血5 mL。處死大鼠,分離兩側卵巢組織,稱質量。繼而將卵巢組織處理如下:一份液氮冷凍;一份以40 g/L多聚甲醛固定24 h,沖洗后濾紙吸干多余水分,梯度酒精脫水,二甲苯透明,浸蠟,包埋,制作蠟塊保存。
1.5.2 觀察大鼠一般狀況及測定卵巢濕質量、卵巢指數 觀察大鼠一般狀況,包括形態、活動、毛色、體質量等,稱兩側卵巢濕質量,計算卵巢指數,公式:左側(右側)卵巢指數=左側(右側)卵巢濕質量(mg)/大鼠體質量(g)。
1.5.3 ELISA法檢測血清性激素水平 取大鼠腹主動脈血液標本,取血后快速置入促凝管內,室溫靜置1 h,3 000 r/min離心(離心半徑10 cm)10 min,取血清待用。按照ELISA試劑盒說明書檢測血清FSH、LH、E2水平,并計算FSH/LH。應用酶標儀檢測450 nm波長處的吸光度值,計算各指標濃度。
1.5.4 蘇木素-伊紅(HE)染色法觀察卵巢組織形態學變化 取卵巢組織蠟塊,制作5μm切片,展片;干凈玻片撈片,烘干;二甲苯脫蠟,梯度酒精水洗,常規蘇木素染色10 min;水洗,1%鹽酸酒精分色20 s,1%氨水溶液返藍;自來水沖洗15 min,1%伊紅水溶液復染5 min;水洗,梯度酒精脫水,二甲苯透明,中性樹膠封片。顯微鏡下觀察卵巢形態學變化。
1.5.5 ELISA法檢測卵巢組織中cAMP含量 取液氮冷凍的卵巢組織,勻漿,以3 000 r/min(離心半徑10 cm)離心10 min,取上清。用96孔板,每孔加入50μL抗體,加入10μL標準品,室溫孵育2 h,洗板,顯色,終止,讀板,450 nm波長上機檢測,570 nm波長校正。二喹啉甲酸(BCA)法檢測組織總蛋白濃度,計算各組大鼠卵巢組織中cAMP含量,公式:cAMP含量=ELISA檢測濃度值/各樣本BCA結果。
1.5.6 蛋白免疫印跡(Western Blot)法檢測卵巢組織FSH-cAMP信號軸相關蛋白FSHR、PKA、
p-PKA表達 取液氮冷凍的卵巢組織在冰盒中研磨,勻漿后置入低溫離心機,以4℃、20 000 r/min(離心半徑10 cm)離心20 min,取上清。BCA法檢測蛋白濃度,根據蛋白濃度,按上樣量40μg計算樣本稀釋濃度,沸水浴10 min變性,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳后濕法轉膜。將硝酸纖維素膜置入50 g/L脫脂奶粉中封閉2 h;再取出置入一抗稀釋液[兔抗大鼠FSHR、PKA、p-PKA、β-actin(內參)單克隆抗體,稀釋比例分別為1∶500、1∶1 000、1∶2 500]中孵育過夜;TBST洗膜后,再置入辣根過氧化物酶標記的山羊抗兔IgG二抗(1∶5 000稀釋)中,室溫下孵育1 h;TBST洗膜,電化學發光試劑(ECL)顯色。經成像系統采集硝酸纖維素膜上的蛋白信號,采用Image-Pro Plus 6.0圖像分析軟件計算目的條帶灰度值。結果以目的蛋白與內參蛋白的灰度值比值表示。
1.6 統計方法采用SPSS 25.0統計軟件分析數據,計量資料以均數±標準差(±s)表示,并進行正態分布檢驗與Levene檢驗。符合正態分布且方差齊者,用單因素方差分析、LSD-t比較,方差不齊者用Welch檢驗、Dunnett’s T3比較。以P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠一般狀況比較實驗過程中正常組大鼠飲食、活動、二便等情況均正常,皮毛整潔、有光澤,體質量漸增,動情周期規律;模型組大鼠進食、二便次數減少,大便稀,毛色枯燥,有脫毛,體質量漸降,動情周期延長、紊亂,鏡下見上皮細胞增多,多于動情間期;抑制劑組大鼠異常表現較模型組嚴重,抑制劑+菟絲子總黃酮組、菟絲子總黃酮組則相對輕微。
2.2 各組大鼠卵巢濕質量與卵巢指數比較表1
表1 各組大鼠卵巢濕質量與卵巢指數比較Table 1 Comparison of ovarian wet mass and ovarian index of rats in various groups (±s)

表1 各組大鼠卵巢濕質量與卵巢指數比較Table 1 Comparison of ovarian wet mass and ovarian index of rats in various groups (±s)
①P<0.05,與正常組比較;②P<0.05,與抑制劑組比較;③P<0.05,與模型組比較;④P<0.05,與抑制劑+菟絲子總黃酮組比較
?
結果顯示:各組大鼠卵巢濕質量、卵巢指數組間比較,差異均有統計學意義(P<0.05)。與正常組比較,抑制劑組、模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的左側和右側卵巢濕質量及卵巢指數均降低(P<0.05)。與抑制劑組比較,模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的左側和右側卵巢濕質量及卵巢指數均升高(P<0.05);與模型組比較,抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的左側和右側卵巢濕質量及卵巢指數均升高(P<0.05);與抑制劑+菟絲子總黃酮組比較,菟絲子總黃酮組的左側和右側卵巢濕質量及卵巢指數均升高(P<0.05)。
2.3 各組大鼠性激素水平比較表2結果顯示:各組大鼠FSH、FSH/LH、E2水平組間比較差異有統計學意義(P<0.05),LH水平組間比較差異無統計學意義(P>0.05)。與正常組比較,抑制劑組、模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的FSH、FSH/LH、E2水平升高(P<0.05)。與抑制劑組比較,模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的FSH、FSH/LH、E2水平降低(P<0.05);與模型組比較,抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的FSH、FSH/LH、E2水平降低(P<0.05);與抑制劑+菟絲子總黃酮組比較,菟絲子總黃酮組的FSH、FSH/LH、E2水平降低(P<0.05)。
表2 各組大鼠性激素水平比較Table 2 Comparison of sex hormone levels of rats in various groups (±s)

表2 各組大鼠性激素水平比較Table 2 Comparison of sex hormone levels of rats in various groups (±s)
①P<0.05,與正常組比較;②P<0.05,與抑制劑組比較;③P<0.05,與模型組比較;④P<0.05,與抑制劑+菟絲子總黃酮組比較
?
2.4 各組大鼠卵巢組織形態變化比較圖1結果顯示:正常組卵巢體積較大,卵泡生長活躍,黃體發育良好;模型組卵巢萎縮明顯,卵泡數量減少,黃體減少;與模型組比較,抑制劑組卵巢萎縮更明顯,卵泡與黃體數量更少,而抑制劑組+菟絲子總黃酮組、菟絲子總黃酮組卵巢、卵泡與黃體數量明顯改善。

圖1 各組大鼠卵巢組織形態變化比較(HE染色,×100)Figure 1 Comparison of histomorphological changes of ovarian tissue of rats in various groups(by HE staining,×100)
2.5 各組大鼠卵巢組織中cAMP含量比較表3結果顯示:各組大鼠卵巢組織中cAMP含量組間比較差異有統計學意義(P<0.05)。與正常組比較,抑制劑組、模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組卵巢組織中cAMP含量降低(P<0.05)。與抑制劑組比較,模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的cAMP含量升高(P<0.05);與模型組比較,抑制劑+菟絲子總黃酮組、菟絲子總黃酮組cAMP含量升高(P<0.05);與抑制劑+菟絲子總黃酮組比較,菟絲子總黃酮組cAMP含量升高(P<0.05)。
表3 各組大鼠卵巢組織中cAMP含量比較Table 3 Comparison of content of c AMP in ovarian tissue of rats in various groups(±s,pmol·mg-1)
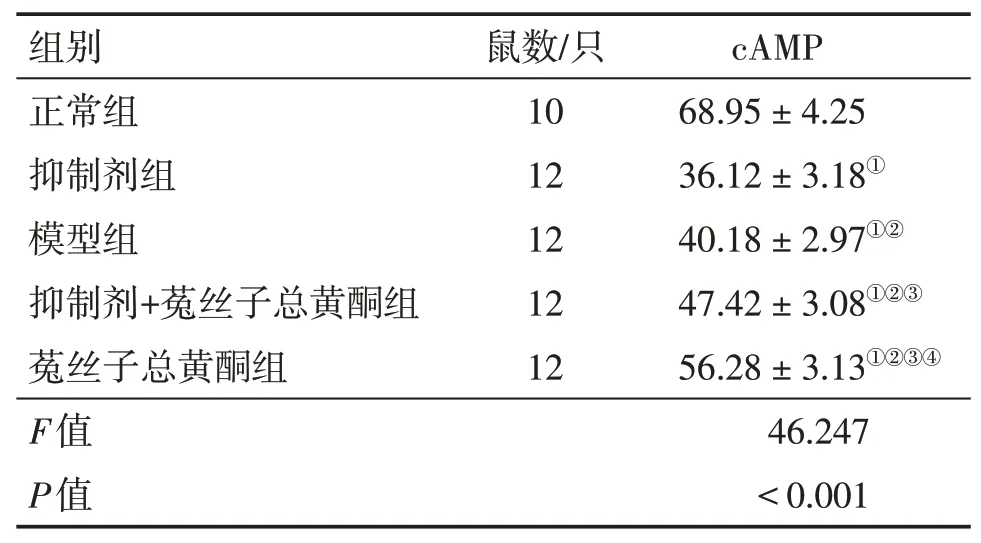
表3 各組大鼠卵巢組織中cAMP含量比較Table 3 Comparison of content of c AMP in ovarian tissue of rats in various groups(±s,pmol·mg-1)
①P<0.05,與正常組比較;②P<0.05,與抑制劑組比較;③P<0.05,與模型組比較;④P<0.05,與抑制劑+菟絲子總黃酮組比較
?
2.6 各組大鼠卵巢組織中FSH-cAMP信號通路相關蛋白表達比較表4、圖2結果顯示:各組大鼠FSHR、p-PKA蛋白相對表達量組間比較差異有統計學意義(P<0.05),PKA蛋白相對表達量組間比較差異無統計學意義(P>0.05)。與正常組比較,抑制劑組、模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的FSHR、p-PKA蛋白相對表達量降低(P<0.05)。與抑制劑組比較,模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的FSHR、p-PKA蛋白相對表達量升高(P<0.05);與模型組比較,抑制劑+菟絲子總黃酮組、菟絲子總黃酮組的FSHR、p-PKA蛋白相對表達量升高(P<0.05);與抑制劑+菟絲子總黃酮組比較,菟絲子總黃酮組的FSHR、p-PKA蛋白相對表達量升高(P<0.05)。

圖2 大鼠卵巢組織中FSHR、PKA、p-PKA蛋白Western Blot電泳條帶圖Figure 2 Western Blot bands of FSHR,PKA and p-PKA proteins in ovarian tissue of rats
表4 各組大鼠卵巢組織中FSHR、PKA、p-PKA蛋白相對表達量比較Table 4 Comparison of protein relative expression of FSHR,PKA and p-PKA in ovarian tissue of rats in various groups (±s)

表4 各組大鼠卵巢組織中FSHR、PKA、p-PKA蛋白相對表達量比較Table 4 Comparison of protein relative expression of FSHR,PKA and p-PKA in ovarian tissue of rats in various groups (±s)
①P<0.05,與正常組比較;②P<0.05,與抑制劑組比較;③P<0.05,與模型組比較;④P<0.05,與抑制劑+菟絲子總黃酮組比較
?
3 討論
卵巢作為女性生殖器官,負責卵子的產生與排出,分泌的激素對女性的經、帶、胎、產過程具有調節作用。隨著女性年齡的增長,卵巢功能日漸衰退,致卵巢儲備功能減退,影響受孕能力,甚或伴發閉經并至全身其他系統疾病。卵巢儲備功能減退涉及遺傳、醫源性、環境等影響因素,發病機制目前尚不完全清楚[13]。本研究通過腹腔注射VCD構建卵巢儲備功能減退實驗動物模型,高度模擬了女性卵巢儲備功能減退狀態。可見造模后的大鼠形態、活動、毛色、動情周期等出現異常變化,卵巢濕質量減輕,卵巢指數下降,而經菟絲子總黃酮治療后則明顯改善,提示菟絲子總黃酮可恢復卵巢儲備功能減退大鼠動情周期,增加卵巢質量,糾正降低的卵巢指數,改善卵巢儲備功能。本研究經HE染色觀察大鼠卵巢組織形態學與卵泡情況后發現,模型組卵巢明顯萎縮,卵泡數量減少,閉鎖卵泡增多,而菟絲子總黃酮組卵巢體積增大,皮質內可見大量生長卵泡,較多接近成熟卵泡,提示菟絲子總黃酮可促進卵巢儲備功能減退大鼠卵巢各級卵泡發育。
血清性激素是反映卵巢儲備功能的指標。FSH是腺垂體促性腺激素細胞合成、分泌的糖蛋白類促性腺激素,其分泌可影響卵巢內卵泡的發育、排卵[14]。LH通過與卵巢膜細胞LH受體結合,刺激卵泡膜細胞分泌雄激素,從而為雌激素的產生提供原料。卵巢儲備功能減退初期,FSH、LH均上升,前者早于后者,且更顯著,FSH/LH比值升高則可預判卵巢儲備功能減退。E2由卵巢膜細胞、顆粒細胞分泌,在FSH和LH作用下合成,是評價卵巢儲備功能的常用指標[15]。膜細胞合成的雄激素進入顆粒細胞,在芳香化酶P450作用下轉化為雌激素。長期高E2、FSH/LH水平不利于優勢卵泡發育,因而恢復FSH、E2、LH水平對卵巢早衰的治療十分重要。本研究結果顯示,與模型組比較,菟絲子總黃酮組的FSH、E2、FSH/LH比值下降,提示菟絲子總黃酮具備調節血清性激素功能的作用,體現了其類雌激素樣作用。
卵泡是卵巢局部與循環雌激素的主要來源,雌激素水平受FSH調控,FSH調節卵巢顆粒細胞膜中芳香化酶基因表達,并觸發cAMP依賴的信號級聯調節芳香化酶基因轉錄,誘導雌激素生物合成。FSH-cAMP/PKA信號轉導通路是經典的調節卵巢功能的通路之一,FSH與顆粒細胞上分布的FSHR特異性結合,通過細胞膜上G蛋白受體激活cAMP,增加細胞中cAMP濃度,打破cAMP平衡[16]。據報道[17],cAMP在卵巢發育過程中可調控卵母細胞成熟與卵泡發育。高濃度的cAMP激活細胞內PKA,活化(磷酸化)的PKA轉錄激活目的基因,促使特異性蛋白合成并分泌至卵巢內,促進卵泡的發育。本研究結果顯示:從抑制劑組到模型組、抑制劑+菟絲子總黃酮組、菟絲子總黃酮組,卵巢組織中FSHR、p-PKA蛋白表達水平及cAMP含量逐漸升高,提示菟絲子總黃酮可能通過調節FSH,激活cAMP/PKA信號轉導通路,增加卵巢局部cAMP含量,促進卵泡發育,從而改善卵巢的儲備功能。
綜上所述,菟絲子總黃酮可能通過激活FSHcAMP/PKA信號轉導通路,發揮對卵巢儲備功能減退大鼠卵巢儲備功能的保護作用。

