妊娠期高血壓疾病的代謝組學研究進展
金銘 劉曉靜 張子怡 李楠 葉榮偉
妊娠期高血壓疾病(hypertensive disorders of pregnancy,HDP)是以婦女懷孕20周后首次出現高血壓、蛋白尿等癥狀為主要臨床表現的一組疾病,包括妊娠期高血壓,子癇前期-子癇,妊娠合并慢性高血壓,慢性高血壓并發子癇前期等幾種臨床表型,其中妊娠期高血壓(gestational hypertension,GH)和子癇前期(preeclampsia,PE)是最常見的亞型,越來越受到研究者的關注[1-2]。GH癥狀較輕,僅出現高血壓不伴有蛋白尿;PE表現為高血壓伴尿蛋白升高、母體器官功能受損及胎盤-胎兒受累[3]。國外研究報道全球HDP的發病率高達10%[4],而在中國HDP的患病率約為7.6%,華北地區則高達10.6%[5]。HDP是流產、早產、小于胎齡兒和孕婦圍產期死亡等不良妊娠結局的主要原因之一,也可影響子代近期和遠期健康[6]。HDP在我國可造成的孕產婦死亡率約為4.2/10萬,占孕產婦死亡總數的9.3%,是導致孕產婦死亡的第二大死因[5]。
目前HDP的病因及發病機制尚未明確,對其診斷依賴于臨床表現及實驗室指標,缺乏在孕早、中期進行可靠預測及早期診斷的方法,無法實現早期干預的目的[7]。利用代謝組學方法可對生物樣本中的代謝產物進行系統檢測,并將其與生物過程相關聯,進而幫助深入了解疾病的發生機制,尋找出疾病的預測、診斷及預后的生物標志物[8]。有研究表明在HDP臨床發作前已存在代謝產物水平的重要改變,并隨疾病進展而持續變化[9],這為代謝組學應用于探索HDP相關生物標志物,進行疾病預測、早期診斷、分型及機制探索提供了可能。因此,本文對HDP的代謝組學研究進展予以綜述,討論利用代謝組學方法對HDP進行預測、早期診斷及機制探索的研究現況,以便更好的了解代謝組學在HDP診療中的應用潛能。
一、HDP概述
HDP的病因及發病機制復雜,涉及炎癥反應、內皮功能障礙和氧化應激等多種病理改變[7],其中免疫機制在HDP的發生發展中起到至關重要的作用,主要涉及CD4+T細胞群的失衡,以及其他免疫細胞(包括巨噬細胞、樹突狀細胞、CD8+T細胞、B細胞和NK細胞)的過度激活或損傷[10]。高水平的膽固醇、尿酸鹽和葡萄糖會激活NLRP3炎癥小體,誘導產生IL-1β、IL-18和消皮素D等促炎因子,引發局部和全身性炎癥反應,進而導致交感神經興奮、腎素-血管緊張素-醛固酮系統激活、蛋白尿、溶血、肝損傷、免疫血栓形成和凝血病等,與HDP的病理改變密切相關[11]。PE是HDP中危害較嚴重的一類亞型,是國內外相關機制研究的熱點。目前普遍認為PE發病可歸納為兩個階段:胎盤形成不良階段和胎盤氧化應激階段。PE患者在胎盤形成早期滋養細胞侵襲子宮內膜不完全,子宮螺旋小動脈異常重塑,導致胎盤缺血和缺氧,進而釋放一系列促炎因子,進入母體血循環后造成血管內皮細胞受損,引起后續心血管癥狀的發生[7]。研究者通常按照發病時間對PE進行分型,于妊娠 34 周前診斷為早發型(early-onset preeclampsia,EO-PE),于妊娠34 周后診斷為晚發型(late-onset preeclampsia,LO-PE)。這兩種不同發病時間亞型的病因和臨床表現不同,EO-PE往往是由上述胎盤形成不良和氧化應激引起的,發生率相對于LO-PE更高,且往往導致更嚴重的胎兒生長受限。LO-PE則與發病前存在的母體血管疾病和其他合并癥關系更密切[12]。此外還發現DNA甲基化[13]、營養因素等都與HDP的發生密切相關,但目前對HDP的病因及發病機制仍未完全明確,需要結合更多的現代技術手段進行探索。
二、代謝組學
代謝組學是系統生物學領域的新興方法,它利用核磁共振波譜(NMR)、液相色譜質譜聯用(LC-MS)、超高效液相色譜與質譜聯用(UPLC-MS)、氣相色譜質譜聯用(GC-MS)等多種現代分析技術,對生物體體液、組織或其他生物樣本中廣泛的小分子代謝產物進行檢測、識別、定量和分類,并借助生物信息學將代謝產物與生物過程關聯起來,進而識別和解析多種生理及病理代謝過程的結果。代謝組學研究可用于尋找各種疾病的預測、診斷及預后的生物標志物,還可檢測到各種生物途徑的變化,幫助深入了解各種病理生理發生過程[8]。具體來講,代謝組學方法分為非靶向代謝組學和靶向代謝組學。非靶向代謝組學方法多用于定性分析,無偏向性地對內源性代謝產物進行系統全面的檢測,篩選潛在的生物標志物,覆蓋范圍廣。缺點是只能獲得待測樣本中代謝產物的相對含量,且費用較高,目前的主流研究多在美國、英國等發達國家開展。靶向代謝組學方法一般針對某一類特定的目標代謝產物,覆蓋范圍較局限,需要更高的檢測靈敏度,并基于代謝物標準品進行絕對定量,有助于深入探索疾病的具體發生機制[14]。
三、HDP代謝組學研究進展
1.研究基本情況:本文共系統回顧了22篇有關HDP代謝組學研究的文獻,發表在2008—2021年間。其中11項研究采用非靶向代謝組學方法篩選潛在的生物標志物或進行代謝通路分析,另11項研究則采用靶向方法針對特定代謝產物進行定量分析。20項研究的病例組為PE,或按EO-PE和LO-PE分層。14項研究分析孕早、中期診斷前的代謝產物,8項研究則比較確診后的代謝產物特征。血清是最常使用的生物樣本(n=12),其次是血漿(n=5)、胎盤組織(n=2),2項研究使用了尿液及血清。14項研究使用質譜法分析代謝產物,7項使用核磁共振技術,1項研究使用ELISA技術。
2.非靶向代謝組學:目前應用非靶向代謝組學方法已在血清、尿液、胎盤等多種生物樣本中發現,HDP病例和健康孕婦的代謝物譜存在廣泛差異,并已檢測出了包含線粒體功能障礙、脂質代謝紊亂等多種與HDP相關的代謝改變。其中3項研究開展于亞洲國家。Chen等在中國開展的一項病例對照研究中共檢測出49種代謝產物在PE病例和對照組孕婦血清中存在差異,主要包括酰基肉堿類、溶血磷脂酰膽堿類和磷脂類等,其中PC(14:0/00)、脯氨酸甜菜堿和L-脯氨酸可作為PE診斷及預后的潛在生物標志物。代謝通路分析結果顯示PE發病可能與甘氨酸降解及肌酸生物合成、iNOS信號傳導、骨骼肌細胞中的nNOS信號傳導、線粒體功能障礙、心血管系統中的一氧化氮信號傳導和瓜氨酸-一氧化氮循環等代謝途徑相關[15]。另一項在中國開展的研究則對比了嚴重先兆子癇病例與對照組的胎盤線粒體代謝物譜,發現包含11種氨基酸、13種不飽和脂肪酸以及10種飽和脂肪酸等的40種代謝產物在兩組間存在差異。嚴重先兆子癇病例胎盤線粒體中脂肪酸水平較高,脂肪酸分解代謝減少,提示可能存在包含脂質代謝紊亂在內的多種線粒體代謝功能障礙[16]。與上述研究結果不同的是,Kyozuka等在日本進行的病例對照研究并未發現GH病例與對照組孕早期血清帶電代謝物譜的顯著差異,僅發現GH病例血清中N-二甲基甘氨酸和S-甲基半胱氨酸偏高,而粘酸顯著低于對照組[17]。
此外,在歐美等發達國家開展的研究中也檢測到多種代謝產物差異。Sovio等在1193種非靶向檢測的代謝產物中,篩選出了100種代謝產物在足月產PE病例與對照組婦女孕20或28周血清中存在顯著差異,并提出孕36周血清4-羥基谷氨酸和C-糖基色氨酸可作為足月產PE的獨立預測指標[18]。Austdal等在挪威開展了一系列研究探索HDP病例的尿液及血清代謝物譜特征,他們在早期的病例對照研究中發現PE病例和健康孕婦之間共有15種尿代謝產物濃度顯著不一致;血清譜顯示PE病例低密度和極低密度脂蛋白水平較高,而高密度脂蛋白水平較低[19]。在后續的隊列研究中他們進一步發現尿液中馬尿酸鹽減少、尿肌酐升高和血脂水平升高是孕早期HDP病例組改變最顯著的3種代謝產物[20]。Sander等在英國開展的病例對照研究中檢測出了35種孕晚期血漿代謝產物在PE病例及對照組間顯著不一致,重要的差異代謝產物包括羥基六十二烷酸、二酰基甘油、甘油磷酸肌醇、煙酰胺腺嘌呤二核苷酸代謝物、膽汁酸和氨基酸代謝物[21]。Kenny等首先在奧克蘭開展巢式病例對照研究,檢測出了45種代謝產物在PE病例與對照組血漿中存在差異,包括氨基酸、碳水化合物、肉堿、類二十烷酸、脂肪酸、酮或羥基酸、脂質、磷脂、卟啉、磷脂酰絲氨酸和類固醇等;后續在阿德萊德利用不同的樣本開展病例對照研究進行驗證,其中34種代謝產物與在奧克蘭的研究出現一致的結果[22]。Ferranti等在美國非洲裔女性群體中開展病例對照研究,發現PE病例卟啉代謝、類固醇激素生物合成、視黃醇代謝和花生四烯酸代謝4條途徑發生顯著改變;GH病例有5條代謝途徑改變,包括氨基酸代謝、分解代謝及果糖代謝通路[9]。Harville等在美國進行的病例對照研究發現氨酰-tRNA生物合成、L-蘇氨酸代謝、腎臟分泌有機電解質、膽固醇轉運和代謝等途徑與HDP相關[23]。
3.靶向代謝組學:目前已利用隊列研究、病例對照研究及巢式病例對照研究等多種流行病學研究設計類型,通過靶向代謝組學方法在血清和胎盤等生物樣本中發現肉堿、氨基酸、甘油等多種代謝產物與HDP發病相關(表1)。Kenny等基于既往研究[24]的結果,靶向比較了PE病例與對照組孕中期血漿的45種代謝產物,發現病例組丙氨酸、尿酸、2-羥基-3-甲基丁酸、2-氧戊二酸、谷氨酸、木糖醇及肌酐水平偏高[25];他們在后續的隊列研究中進一步比較了47種根據潛在發病機制確定的代謝產物,發現PE病例血漿中血管生成素、C-反應蛋白、胱抑素C、彈性蛋白酶抑制劑、細胞間黏附分子-1、白細胞介素-1受體拮抗劑、瘦素和金屬蛋白酶組織抑制因子-1較正常孕婦水平偏高;腦鈉肽、瘦素受體和胎盤生長因子水平偏低[26]。這是目前靶向代謝組學研究中唯一一項采用了隊列設計的研究。隊列研究因果時序明確,偏倚較少,檢驗假設能力較強,但花費較高。與之相比,病例對照研究需追溯既往暴露史,偏倚較多,因果聯系的論證強度較低,但省時、省力,在目前的靶向代謝組學研究中應用較為廣泛。

表1 已有的HDP靶向代謝組學人群研究
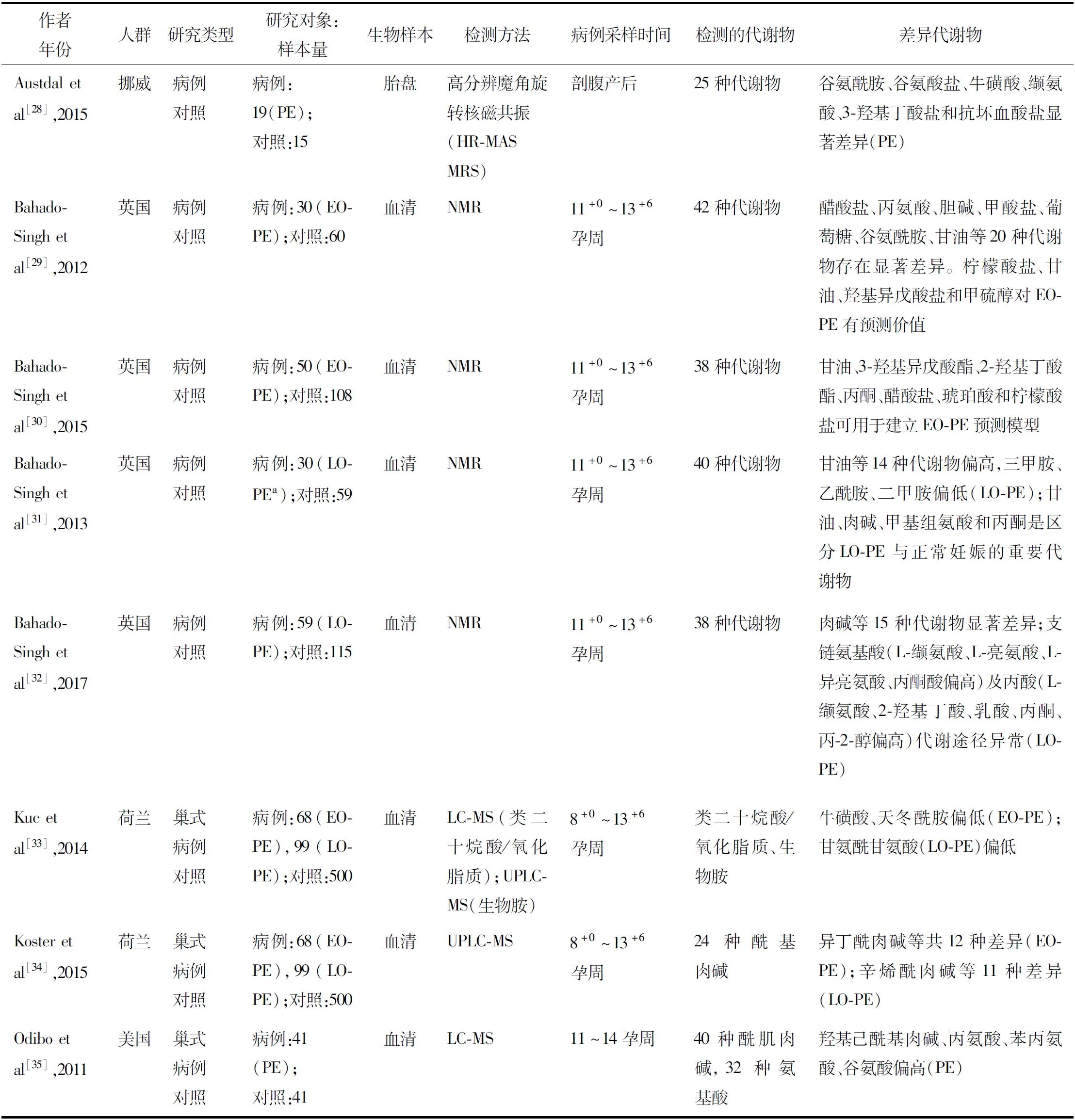
續表1
Liu等在中國開展的病例對照研究中靶向比較了PE病例與對照組血漿的花生四烯酸、omega-3多不飽和脂肪酸的類二十烷酸代謝物,發現PE病例花生四烯酸代謝產物、部分EPA及DHA脂肪氧化酶代謝產物水平增加,EPA及DHA細胞色素P450酶代謝產物水平降低;白三烯B4、14,15-二羥基二十碳四烯酸酯、16-羥基二十二碳六烯酸和8,9-環氧二十碳四烯酸與PE發病相關[27]。Austdal等在挪威開展的病例對照研究中共檢測了25種代謝產物,發現PE病例與對照組的胎盤組織中谷氨酰胺、谷氨酸鹽、牛磺酸、纈氨酸、3-羥基丁酸鹽和抗壞血酸鹽含量存在顯著差異[28]。Bahado-Singh等在英國開展了一系列病例對照研究,比較不同亞型PE的代謝組學特征:他們首先在2012年的研究中檢測了30例EO-PE病例與60例對照孕早期血清中的42種代謝產物,其中醋酸鹽、丙氨酸、膽堿、甲酸鹽、葡萄糖、谷氨酰胺和甘油等20種代謝產物存在顯著差異;檸檬酸鹽、甘油、羥基異戊酸鹽和甲硫醇對EO-PE發病具有較好預測價值[29]。2015年同一團隊對上述研究進一步補充了20例EO-PE病例與48例對照,共檢測38種血清代謝產物后發現甘油、3-羥基異戊酸酯、2-羥基丁酸酯、丙酮、醋酸鹽、琥珀酸和檸檬酸鹽可用于建立EO-PE預測模型[30]。針對LO-PE亞型,他們在2013年的研究中共檢測了30例病例與59例對照孕早期血清中的40種代謝產物,發現病例組甘油等14種代謝產物水平偏高,三甲胺、乙酰胺和二甲胺水平偏低;甘油、肉堿、甲基組氨酸和丙酮是區分LO-PE與正常妊娠的重要代謝產物[31]。研究者2017年在2013年研究的基礎上進一步增加29例LO-PE病例與56例對照后,在38種代謝產物中發現肉堿等15種存在顯著差異,LO-PE病例存在支鏈氨基酸及丙酸代謝途徑異常[32]。
巢式病例對照研究是在隊列的基礎上進行的病例對照研究設計,較隊列研究更經濟,同時因果推斷能力較傳統病例對照研究強。基于一項在荷蘭開展的大型孕早期篩查隊列,Kuc等通過巢式病例對照研究靶向比較EO-PE病例、LO-PE病例及對照組婦女孕早期血清類二十烷酸/氧化脂質及生物胺類代謝產物差異,EO-PE病例牛磺酸、天冬酰胺,以及LO-PE病例甘氨酰甘氨酸水平明顯低于對照組[33]。Koster等基于同一隊列開展的巢式病例對照研究則靶向比較了孕早期血清中的24種酰基肉堿,他們發現異丁酰肉堿等12種在EO-PE病例與對照組間存在差異,辛烯酰肉堿等11種在LO-PE病例與對照組間存在差異,其中9種酰基肉堿類代謝產物是兩種不同發病時間PE共有的差異代謝物[34]。Odibo等在美國開展巢式病例對照研究,靶向比較了孕早期血清中的40種酰肌肉堿及32種氨基酸,指出PE病例組羥基己酰基肉堿、丙氨酸、苯丙氨酸及谷氨酸水平較對照組偏高[35]。
四、討論
HDP是常見且對母嬰生命健康危害嚴重的妊娠期并發癥之一,早發現并進行有效干預能夠減輕對母嬰的健康危害,但目前尚缺乏對其進行預測及早期診斷的有效手段,且病因尚未闡明。代謝組學是繼基因組學、轉錄組學和蛋白質組學后迅速發展起來的新興學科,在闡述病因方面具有顯著的優勢。該組學最貼近于表型,是基因組、轉錄組、蛋白質組和表型組之間的橋梁,它的檢測較基因組及蛋白質組更簡單,不具有物種特異性,無需針對專門的物種建立大規模數據庫[36]。代謝物是基因表達的下游產物,基因和蛋白質層面的微小變化可在代謝物水平得以放大,因此代謝組學方法在疾病研究方面越來越受到關注。研究者可通過對血液、尿液等易于獲取的生物樣本進行代謝組學分析,找出潛在的生物標志物建立疾病的預測及早期診斷模型,有望實現HDP的預防、早期診斷及早期干預治療,同時實現對疾病病因及發病機制的深入探索,具有較高的臨床應用價值,能夠較大程度地降低疾病危害,減輕疾病負擔。
婦女在妊娠期經歷復雜的生理變化,可能會導致血栓形成、免疫抑制、血容量過多及血脂異常等狀態。有研究表明代謝組在整個妊娠期間都會發生變化,并在健康妊娠婦女的血清、血漿、尿液和羊水中確定了多種與非妊娠婦女存在顯著差異的代謝產物,包括肉堿、肌酐、丙酮酸、葡萄糖、氨基酸、膽堿及乳酸等上述“HDP標志物”[19,37]。另一方面,HDP相關代謝產物與許多其他疾病的相關代謝產物存在重疊。在與妊娠無關的高血壓疾病中檢測到肉堿、3-羥基異戊酸、馬尿酸鹽和甘氨酸等代謝產物的差異[38]。肥胖是HDP的危險因素,同時馬尿酸鹽、甘油三酯、磷脂、脂肪酸等也被視為肥胖相關代謝產物[39]。HDP與哮喘研究中檢測出的代謝產物間也有許多相似之處,例如醋酸鹽、腺苷、丙氨酸、馬尿酸鹽、琥珀酸鹽、蘇氨酸和反式烏頭酸鹽[40]。上述重合的代謝產物可能與機體氧化應激、炎癥反應、免疫失調及脂質代謝障礙等途徑相關,提示不同疾病間可能存在共同的病理機制。因此,在應用代謝組學方法識別HDP生物標志物及探索疾病機制時,有必要確定觀察到的代謝組變化是否為HDP所特有。
HDP代謝組學相關研究間的發現較為一致。脂質和肉堿是最常被報告的代謝產物,在HDP病例的各種生物樣本中均檢測到脂質代謝紊亂的代謝組學特征。并且正常妊娠婦女相比非妊娠婦女發生改變的代謝產物不包含脂質,提示其可能是HDP預測的敏感生物指標。EO-PE病例和LO-PE病例的代謝組間存在顯著差異,且EO-PE對胎兒、新生兒及母體的不良影響較LO-PE更大,提示不同亞型PE的病生理機制不完全相同,這增加了HDP疾病的臨床復雜性,為代謝組學研究的臨床應用帶來挑戰[41]。各項代謝組學研究結果表明,HDP的發病與部分基因組學、蛋白質組學的研究結果一致[42-43],因此通過將代謝組學與其他組學相結合有助于系統深入地闡述HDP的發生和發展。
五、結論與展望
代謝組學是深入研究HDP的有效工具。利用代謝組學方法已檢測出多種HDP生物標志物,有助于建立疾病的預測及早期診斷模型,改善疾病的一級和二級預防現狀,同時幫助理解疾病發生的復雜機制。但迄今為止尚未實現HDP代謝組學研究的臨床應用,未來還需要明確HDP的亞型鑒別,選擇理想的生物樣本,控制潛在的混雜因素,實現檢測技術的進步等。因此,研究者未來應該在具有不同表型的人群中進行更大規模的研究,囊括多種生物樣本,涵蓋廣泛而詳細的代謝組測定,并結合多組學技術,更全面、深刻地理解疾病的發生發展機制,建立有效且穩定的疾病預測模型,進而控制疾病風險,降低疾病危害,減輕疾病負擔。

