轉錄因子STAT5A啟動子熒光素酶報告基因質粒的構建及鑒定
陳敏娜,李春蘭,劉 靜,*
(1.汕頭大學醫學院附屬腫瘤醫院乳腺內科,廣東 汕頭 515041;2.汕頭大學醫學院廣東省乳腺癌診治研究重點實驗室/長江學者實驗室/生理學教研室,廣東 汕頭 515041)
在人體中,基因表達的調控是一個復雜而嚴謹的過程,其中轉錄水平的調控是極其重要的一環,也是分子生物學研究的重要內容。目前雙熒光素酶報告基因系統是轉錄水平調控研究重要的實驗方法。通過對啟動子序列和活性的分析,驗證啟動子結合元件的反式激活能力,進而驗證基因之間的轉錄調控關系[1]。
乳腺癌現已超過肺癌,成為全球最常見的惡性腫瘤。而作為體表腫瘤,乳腺癌的轉移是患者因癌癥死亡的主要原因[2]。根據文獻報道,在發育的乳腺中,催乳素(prolactin,PRL)所介導的PRL-JAK2-STAT5A是較經典的調控分子通路,可以調控乳腺發育、增殖、分化、泌乳等重要功能[3-4]。在催乳素的刺激下,持續表達活化的STAT5會抑制乳腺退化并促進乳腺腫瘤的形成,多認為其是原癌基因[5-6],但在乳腺癌患者中,STAT5的表達卻是影響乳腺癌患者預后的獨立因素[6-8]。乳腺癌轉移進展的過程會伴隨STAT5活化形式的丟失和/或轉錄水平下調[9-10]。Sultan等[9]發現催乳素激活STAT5表達可以抑制遷移侵襲,同時增加細胞表面黏連蛋白E-cadherin,但是對細胞總的E-cadherin的表達并無影響。研究表明,STAT5A活化在抑制乳腺癌的侵襲和轉移過程中起到重要作用,并預示患者良好的預后[9-10]。
構建可以有效監測STAT5A啟動子活性的平臺,將有利于研究STAT5A在乳腺癌中的轉錄調控機制。本研究組通過啟動子序列分析發現STAT5A啟動子部位存在Notch信號通路的結合序列,即CSL結合位點TGGGAA或GTGGGAA。因此,為進一步研究Notch信號通路是否在轉錄水平調控STAT5A的表達,我們構建STAT5A啟動子熒光素酶報告基因質粒,以及僅包含Notch結合序列的熒光素酶報告基因質粒,并進行雙熒光報告基因實驗,驗證構建質粒的有效性。
1 材料與方法
1.1材料
DNAzol(D104-01)購于北京康潤誠業生物科技有限公司;DNA純化回收試劑盒(#P214-03)、質粒小提試劑盒(DP103)、無內毒素質粒大提試劑盒(DP117)購于天根生化科技(北京)有限公司;TransStart FastPfu DNA Polymerase購自北京全式金生物技術有限公司;限制性內切酶KpnⅠ和HindⅢ、E.coliCompetent Cells DH5α購自TaKaRa公司;Thermo T4 DNA Ligase試劑盒(#EL0011)購于Thermo公司;載體質粒pGL3-Enhancer(圖1)及Dula-Luciferas Reporter Assay system試劑盒購自Promega公司。
1.2方法
1.2.1 人乳腺癌MCF7細胞基因組DNA提取 MCF7細胞購自上海中國科學院典型培養物保藏委員會細胞庫,使用含10%胎牛血清的DMEM細胞培養基(Gibco公司)培養于35 mm培養皿,適時更換培養基。當細胞匯合度達90%時,予PBS清洗后,按DNAzol說明書提取MCF7細胞的基因組DNA,作為擴增模板。使用核酸分析儀(Thermo公司)檢測所提基因組DNA的濃度及純度后,置于-80℃冰箱中儲存待用。

圖1 pGL3-Enhancer質粒圖譜(Promega公司)
1.2.2 引物設計 在NCBI上查找STAT5A基因序列,即NC_000017.11,并將其第一個外顯子往前2 000 bp的范圍視為啟動子區域,即本研究的目標序列。應用Primer Premier 5.0軟件設計擴增引物,同時加入正向酶切位點KpnⅠ和反向酶切位點HindⅢ以及相應的保護堿基,所采用的引物序列如下:STAT5A-pro正向,5′-GGGGTACCTCTGATCTTCCTGAACCCCCA-3′;反 向,5′-CCAAGCTTAGAAAAGTCCAGGGAGG GACC-3′。STAT5A-pro-Notch正向,5′-CGGGGTAC CTGCCAAATCCATTGCTCA-3′;反 向,5′-CCCAAG CTTTCTTGCCCCTTACTACCTC-3′。擴增片段長度分別為2 101和287 bp。所設計引物由生工生物工程(上海)股份有限公司合成。
1.2.3 目的片段擴增 本項目采用可以用于快速PCR擴增的高保真DNA聚合酶TransStart FastPfu DNA Polymerase,以MCF7細胞基因組DNA為模板,分別使用STAT5A-pro及STAT5A-pro-Notch引物擴增STAT5A啟動子區的目標DNA片段。PCR反應體系見表1,引物在使用前已提前測試并確定最適退火溫度,STAT5A-pro引物的最適退火溫度為66℃,STAT5A-pro-Notch引物的最適退火溫度為54℃,按說明書PCR反應條件進行擴增。然后分別使用1%及3%的瓊脂糖凝膠電泳,于紫外燈下觀察并切取正確長度的PCR產物,使用DNA純化回收試劑盒,按說明書步驟回收DNA。后續可進行下一步操作或儲存于-20℃冰箱中。

表1 擴增目的DNA片段的PCR反應體系(50μL)
1.2.4 報告基因質粒的構建 利用限制性內切酶KpnⅠ和HindⅢ對上述PCR產物及載體質粒pGL3-Enhancer進行雙酶切。反應條件為37℃,酶切1 h;而后轉為65℃,維持10 min滅活限制性內切酶。酶切后的產物進行瓊脂糖凝膠電泳,并切膠回收目的片段,以除去酶切下的小碎片。回收的DNA片段測濃度后儲存于-20℃冰箱中待用。
使用T4 DNA Ligase試劑盒,并按說明書步驟將所得到的目的片段和已行酶切的載體進行連接,目的片段與已酶切載體的物質的量比例為3∶1。連接體系為10×T4 Buffer 2μL,T4 DNA Ligase 0.2μL,目的片段及已酶切載體,最后加無菌水定容至20μL。
1.2.5 報告基因質粒序列的鑒定 連接反應完成后取上述連接產物5μL加入50μL感受態菌液(E.coliCompetent Cells DH5α)進行轉化,轉化后挑取單克隆菌落,進行質粒小提提取相應的質粒,并行雙酶切反應和直接測序法鑒定正確構建的質粒。選取序列正確的質粒進行質粒大提,再次行雙酶切反應以進一步確定質粒,確定后將擴增獲取的質粒存儲于-20℃待用。
直接測序法由生工生物工程(上海)股份有限公司完成。所構建成功的質粒根據插入序列的不同,分別命名為pGL3-STAT5A-pro-luc-E及pGL3-STAT5Apro-N-luc-E。

圖2 目的質粒雙酶切結果
1.2.6 報告基因質粒轉錄活性的檢測 本實驗選用空載體pGL3-enhance質粒作為陰性對照組,選用能表達螢火蟲熒光素酶pGL3-Control作為陽性對照,重組載體pGL3-STAT5A-pro-luc-E及pGL3-STAT5A-pro-Nluc-E作為實驗組,而表達海腎熒光素酶的pRL-SV40質粒作為內參,將上述兩種質粒共同轉染至細胞內,以檢測兩種熒光素酶的活性。
將MCF7細胞接種于24孔板中,于37℃、CO2體積分數為5%條件下培養,增殖至60%左右時,應用Lipofectamine 3000試劑盒轉染上述質粒,48 h后按照熒光素酶檢測系統方法處理轉染細胞,并通過LB9507系統測定熒光素酶活性。
1.3 統計學方法
實驗數據使用SPSS 19.0軟件進行分析。重組載體STAT5A-pro-luc-E/pGL3-STAT5A-pro-N-luc-E與空載體pGL3-Enhancer熒光素酶相對活性的差異分析采用Student'st檢驗。所有P值采用雙側檢測,以P<0.05為差異有統計學意義。
2 結果
2.1 STAT5A啟動子報告基因質粒構建成功
通過DNA擴增、酶切、連接、篩選等步驟,獲得到pGL3-STAT5A-pro-luc-E及pGL3-STAT5A-pro-Nluc-E兩個質粒。雙酶切反應結果顯示插入目的序列片斷長度正確,分別為2 101 bp及287 bp(圖2)。進一步測序結果顯示,克隆的STAT5A啟動子序列與NCBI數據庫中信息完全一致,提示插入片段序列正確,質粒構建成功。
2.2 STAT5A啟動子報告基因質粒具有啟動子活性
在MCF7細胞中共轉染pGL3-Enhancer和pRLSV40作為陰性對照組,重組載體pGL3-STAT5A-proluc-E/pGL3-STAT5A-pro-N-luc-E和pRL-SV40共轉染MCF7細胞后,兩者的熒光素酶的相對活性分別約為陰性對照pGL3-Enhancer的8倍和6倍(P<0.01),而陽性對照pGL3-Control的熒光素酶活性約為陰性對照pGL3-Enhancer的199倍(P<0.01)(圖3),提示pGL3-STAT5A-pro-luc-E、pGL3-STAT5A-pro-N-luc-E報告基因質粒能表達螢火蟲熒光素酶,反映構建的STAT5A啟動子具有轉錄活性。
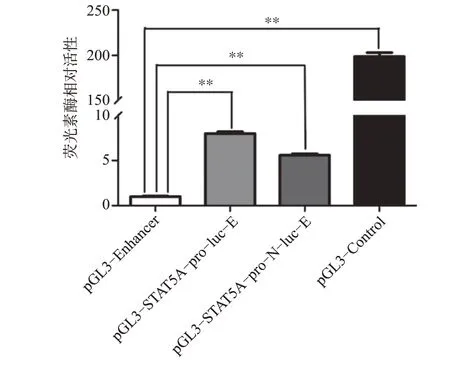
圖3 STAT 5A報告基因質粒的轉錄活性
3 討論
癌癥是全球的公共健康問題,癌癥的發病率和死亡率都在逐年增加,也是醫學的一個難題。2015年中國癌癥統計數據顯示,在中國乳腺癌占所有女性癌癥的15%,其死亡率也在不斷升高[11]。乳腺癌的轉移與復發是造成患者死亡的重要原因,腫瘤轉移是多個基因共同參與調控的復雜過程。因此,闡明乳腺癌轉移的分子機制,可為乳腺癌患者的個體化治療提供潛在的有效靶點,進而實現預防乳腺癌的復發與轉移,提高乳腺癌患者生存率的目的。而轉錄調控是基因表達調控的一個重要組成,目前雙熒光素酶報告基因系統是研究轉錄調控的重要實驗方法,通過對啟動子序列的研究,探討其轉錄因子的結合靶點,進而在實驗中證實轉錄因子對靶基因的轉錄作用。
本研究在分析轉錄因子STAT5A啟動子的基礎上,利用PCR方法擴增STAT5A啟動子序列,并成功構建了轉錄因子STAT5A啟動子熒光素酶報告基因質粒pGL3-STAT5A-pro-luc-E及pGL3-STAT5A-pro-Nluc-E。該系統不僅提供了反應STAT5A啟動子活性的報告系統,同時特異性的以致癌因子Notch信號通路為研究對象,構建Notch特異性結合的STAT5A啟動子活性的報告系統,為深入研究Notch信號通路的功能奠定了基礎,并為以Notch為治療靶點的小分子藥物的篩選提供了高通量篩選平臺。
而在乳腺癌細胞MCF7中轉染了報告基因質粒后對比陰性對照,兩種STAT5A啟動子熒光素酶報告基因質粒表達的熒光素酶活性均升高數倍,提示該質粒在STAT5A啟動子調控下可以表達熒光素酶蛋白,具有轉錄活性,為下一步實驗奠定了良好基礎和技術平臺。本項目在雙熒光素酶報告基因檢測過程中,以pGL3-Enhancer載體表達的螢火蟲熒光素酶活性為檢測指標,而pRL-SV40質粒表達海腎熒光素酶活性為內參指標,為樣品的加樣進行了有效的監控[12]。
綜上所述,本研究利用分子克隆的技術,以pGL3-Enhancer質粒為載體,成功構建了可以反映STAT5A啟動子轉錄活性的pGL3-STAT5A-pro-luc-E熒光素酶報告基因質粒,以及具有Notch特異性潛在結合的pGL3-STAT5A-pro-N-luc-E熒光素酶報告基因質粒,為STAT5A轉錄調控的研究提供了有效的鑒定平臺,也為Notch信號通路的研究提供了篩選手段。

