98例直腸癌患者DCE-MRI檢查相關影像學參數與其相關生物學指標、Dukes分期的關聯性分析
李新華 王春光 宋瑞敏 吳 鵬 河南省新鄉市中心醫院 新鄉醫學院第四臨床學院
1 醫學影像遠程診斷中心 2 放射科 3 CT室 453000; 4 原陽縣人民醫院放射科
直腸癌是臨床常見惡性腫瘤,發病率、病死率呈逐年升高且年輕化趨勢,治療難度較大,會嚴重影響患者生活質量[1]。臨床應積極采取措施準確判斷病情程度,指導治療方案的制定。人類表皮生長因子受體2(CerbB-2)、Ki67是促進新生血管生成及腫瘤細胞增殖的重要標志物,在直腸癌發生發展過程中具有重要作用[2];Dukes分期是結腸腫瘤分期的常用手段,能準確反映腫瘤浸潤、轉移情況。但上述兩種判斷方法均需在術后進行檢測,對治療前病情評估意義不大。磁共振成像動態增強(DCE-MRI)能通過清晰圖像直接呈現直腸癌形態學特征,并定量分析對比劑進出腫瘤的血流動力學過程、統計相關影像學參數,反映腫瘤血管滲透性[3]。基于此,本文選取我院直腸癌患者98例,根據直腸癌患者DCE-MRI檢查相關影像學參數與生物學指標、Dukes分期的關聯性分析其臨床應用價值,現報道如下。
1 資料和方法
1.1 一般資料 選取2019年3月—2020年3月我院直腸癌患者98例,其中男61例,女37例;年齡42~86歲,平均年齡(63.58±10.28)歲;分化程度:高分化26例,中分化42例,低分化30例;淋巴結轉移情況:轉移35例,未轉移63例。
1.2 選擇標準 (1)診斷標準:均符合《中國結直腸癌診療規范(2020年版)》中相關診斷標準[4];均經病理學檢查確診為直腸癌。(2)納入標準:均符合上述診斷標準;影像學資料及參數完整;均未接受任何治療且為初次入院;均簽署知情同意書。(3)排除標準:術前接受過治療;影像學圖像不清晰;既往盆腔手術史;合并其他部位惡性腫瘤或心、肝、腎等重要臟器功能障礙;影像學檢查禁忌證。
1.3 方法 (1)DCE-MRI檢查:采用MRI掃描儀及28通道體表相控陣列線圈,進行T1WI、T2WI、矢狀位、冠狀位掃描及DWI軸位掃描;然后采用T1VIBE序列進行掃描,重復時間(TR)=5.08ms,回波時間(TE)=1.77ms,視野(FOV)=260mm×260mm,矩陣=154×192,層厚=3.5mm,翻轉角度=15°;對比劑選擇釓雙胺注射液,自手背部采用高壓注射器進行靜脈注射,劑量為0.1mmol/kg,速度為3ml/s,不間斷掃描35個時相,8s/個,并在第3時相開始掃描時注入對比劑,注射后立即采用20ml生理鹽水沖洗管道,設置掃描時間為280s;DCE掃描后進行T1矢狀位、軸位、冠狀位進行常規增強掃描;然后將數據輸入工作站,邀請2名經驗豐富影像學醫師進行盲法閱片,根據腫瘤位置、形態,避開腫瘤壞死區及囊變區,選取腫瘤最大徑線連續層面,并在腫瘤實質強化明顯區選擇3個范圍為20~40mm2的類圓形感興趣區,對轉運常數(Ktrans)、速率常數(Kep)、血管外細胞外間隙容積分數(Ve)值進行定量測定。(2)生物學指標表達水平檢測,收集病理學標本,經甲醛固定、脫水,二甲苯透明,石蠟包埋后置于60℃烘箱中烘片;采用二甲苯脫蠟,并進行梯度酒精水化,檸檬酸鈉抗原修復加入一抗、二抗及二氨基聯苯胺(DAB)進行顯色,采用磷酸緩沖液(PBS)沖洗終止染色,采用蒸餾水進行沖洗、鹽酸酒精分化、酒精脫水干燥,于顯微鏡下觀察;染色定位于細胞核、細胞質,染色強度:陰性為0分,弱陽性為1分,陽性為2分;陽性細胞數占比:無陽性為0分,陽性細胞≤25%為1分,陽性細胞>25%為2分。染色強度+陽性細胞數占比評分總分>2分為高表達,≤2分為低表達。(3)Dukes分期:其中腫瘤浸潤深度至直腸壁內,未穿出深肌層,取淋巴結轉移為A期;腫瘤侵犯漿膜層,或侵入漿膜外或腸外周圍組織,但尚能整塊切除,淋巴結轉移為B期;腫瘤侵犯腸壁全層或未侵犯全層,但伴有淋巴結轉移為C期;腫瘤遠處器官轉移、局部廣泛浸潤或淋巴結廣泛轉移無法根治性切除為D期。
1.4 觀察指標 (1)統計直腸癌患者DCE-MRI檢查影像學參數、生物學指標水平、Dukes分期。(2)比較不同生物學指標直腸癌患者DCE-MRI檢查影像學參數。(3)比較不同Dukes分期直腸癌患者DCE-MRI檢查影像學參數。(4)采用Spearman分析直腸癌患者DCE-MRI檢查影像學參數與生物學指標、Dukes分期的相關性。(5)分析Ktrans、Kep及聯合檢測對C~D期直腸癌患者的診斷價值。
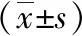
2 結果
2.1 影像學參數、生物學指標水平、Dukes分期 98例直腸癌患者DCE-MRI檢查影像學參數Ktrans為(0.36±0.06)min-1;Kep為(0.65±0.10)min-1;Ve為0.52±0.10;CerbB-2高表達33例,低表達65例;Ki67高表達41例,低表達57例;Dukes分期中A期25例、B期32例、C期24例、D期17例。
2.2 不同生物學指標直腸癌患者DCE-MRI檢查影像學參數 直腸癌CerbB-2、Ki67高表達患者DCE-MRI檢查影像學參數Ktrans、Kep大于低表達患者(P<0.05)。見表1。
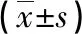
表1 不同生物學指標直腸癌患者DCE-MRI檢查影像學參數
2.3 不同Dukes分期直腸癌患者DCE-MRI檢查影像學參數 隨著直腸癌患者Dukes分期的提升,DCE-MRI檢查影像學參數Ktrans、Kep呈逐漸升高趨勢(P<0.05)。見表2。
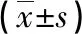
表2 不同Dukes分期直腸癌患者DCE-MRI檢查影像學參數比較
2.4 DCE-MRI檢查影像學參數與生物學指標、Dukes分期的相關性 經Spearman相關性分析,直腸癌患者DCE-MRI檢查影像學參數Ktrans、Kep與生物學指標CerbB-2、Ki67、Dukes分期呈正相關(P<0.05)。見表3。
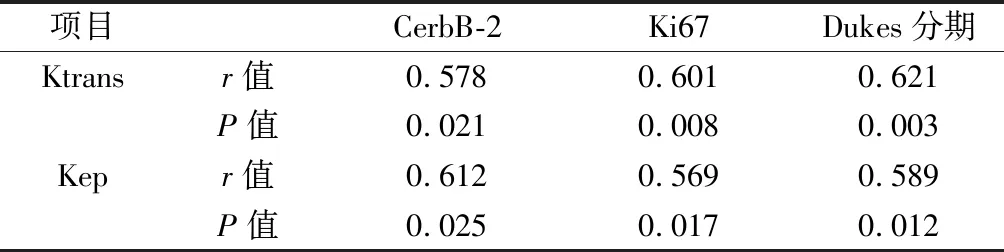
表3 DCE-MRI檢查影像學參數與生物學指標、Dukes分期的相關性
2.5 聯合檢測對C~D期直腸癌患者的診斷價值 根據Ktrans、Kep水平繪制ROC曲線,聯合診斷AUC值0.812、敏感度85.21%、特異度84.01%高于Ktrans、Kep單一檢測(P<0.05)。見表4。

表4 聯合檢測對C~D期直腸癌患者的診斷價值
3 討論
直腸癌腫瘤生長基礎為新生血管生成,與腫瘤分化程度、臨床分期、生物學指標密切相關,臨床應在治療前全面評估病情,輔助治療方案的制定,改善預后效果[5]。
腫瘤組織中生物學指標CerbB-2、Ki67是在腫瘤早期篩查診斷、療效評估中發揮重要作用,能反映組織生物學行為,其水平越高提示腫瘤惡性程度、侵襲轉移能力越強[6]。本文中直腸癌CerbB-2、Ki67高表達患者DCE-MRI檢查影像學參數Ktrans、Kep大于低表達患者(P<0.05)。DCE-MRI是通過注射對比劑后進行MRI掃描檢查,對病變內對比劑濃度進行量化MRI成像技術,連續掃描獲取病灶信號強度—時間變化圖,反映血供情況、血管通透性,間接反映病灶處微血管分布情況,并根據血管功能特征動態觀察強化血管情況[7]。其中Ktrans能描述對比劑從血管內轉移至細胞外間隙數值,與血液流經組織的血液含量、血管內皮通透性及表面積有關[8];而Kep是描述對比劑自細胞外間隙返回至血管間隙速率值,與腫瘤微血管生長狀態有關。因此,腫瘤惡性程度越高,生物學指標表達越明顯,組織血管更加豐富,細胞增殖越明顯,細胞核比例增大,單位體積內細胞密集程度增加,對比劑清除時間與分布量出現存在差異,Ktrans、Kep參數增大,二者變化趨勢具有一致性,呈正相關。同時,隨著直腸癌患者Dukes分期的提升,Ktrans、Kep呈逐漸升高趨勢(P<0.05)。分析其原因為,直腸癌惡性程度越高,不成熟新生血管越多,血流增大,血管內皮因子刺激性增強,會增加血管通透性,從而導致Ktrans、Kep值增大,與Dukes分期密切相關[9]。但Ve值隨著生物學指標、Dukes分期不同均無明顯變化,是由于腫瘤血供復雜,病情發展過程中細胞外間隙環境復雜多變。另外,本研究為進一步證實DCE-MRI檢查相關影像學參數檢測價值,通過繪制ROC曲線評估其聯合診斷優勢,結果表明聯合診斷C~D期直腸癌AUC值、敏感度、特異度高于單一檢測(P<0.05),提示聯合檢測能為臨床病情評估、診斷治療提供數據支持。
綜上所述,DCE-MRI檢查相關影像學參數能反映直腸癌患者生物學行為與Dukes分期,為臨床診斷治療提供科學合理的參考依據。

