丙泊酚調控miR-133a/AQP1表達改善H/R心肌細胞損傷
宋禹 張紅濤 任楠 李躍祥
(1天津市西青醫院麻醉科,天津 300380;天津市環湖醫院 2麻醉科;3手術室)
當缺血心肌在恢復供血后心肌組織損傷進一步加重的現象被稱為心肌缺血再灌注損傷(MIRI),MIRI可引起缺血區域心肌細胞結構改變、發生凋亡和心功能出現障礙等,使患者疾病加重,導致心血管疾病如急性心肌梗死、冠心病等臨床治療效果不佳〔1〕。體外循環下冠狀動脈搭橋術是缺血性心臟病再灌注治療的常用方法,丙泊酚是臨床常用的靜脈麻醉藥,在心血管手術麻醉過程中已得到廣泛應用〔2〕。已有研究指出,丙泊酚預處理對MIRI有一定的保護作用,具有較好臨床推廣價值,但還缺乏一定的實驗依據〔2,3〕。心肌組織經缺血再灌注損傷后,心肌組織中一些微小RNA(miRNAs)表達顯著改變,而這些miRNAs可通過影響心肌細胞凋亡、氧化應激和炎癥反應等在MIRI過程中發揮著重要作用〔4,5〕。miR-133a是這些miRNAs中的一員,被證實在MIRI過程中發揮著重要的保護作用〔6〕。水通道蛋白(AQP)1是水通道蛋白家族成員,在缺血再灌注大鼠心肌組織中異常高表達,其表達抑制是瑞芬太尼預處理和加減枳實薤白桂枝湯等發揮保護MIRI的重要機制〔7,8〕。有研究指出,丙泊酚可上調胰腺癌細胞中miR-133a的表達〔9,10〕,也可抑制腦缺血大鼠中AQP1的表達。本研究通過生物信息學軟件預測發現,AQP1可能是miR-133a的潛在靶基因,猜測丙泊酚可能通過miR-133a/AQP1軸發揮保護MIRI的作用。缺氧/復氧(H/R)模型是體外模擬MIRI的常用細胞模型,本研究通過觀察丙泊酚調控miR-133a/AQP1對H/R誘導的心肌細胞損傷的影響,以進一步揭示丙泊酚抗MIRI的分子機制。
1 材料與方法
1.1主要材料 大鼠心肌細胞株H9c2購于中科院典型培養物保藏委員會細胞庫。AQP1抗體和GAPDH抗體購于美國Santa Cruz Biotechnology公司,辣根酶標記的山羊抗兔IgG購于北京中杉金橋公司,四甲基偶氮唑藍(MTT)試劑購于美國Sigma公司,胎牛血清購于上海依科賽金公司,高糖DMEM培養基、胰蛋白酶、二甲基亞砜和全蛋白提取試劑盒購于Solarbio公司,Trizol試劑和轉染試劑脂質體2000購于美國Invitrogen公司,Annexin V-FIFC/PI試劑盒購于上海貝博生物公司,AMV第一鏈cDNA合成試劑盒購于上海生工生物工程公司,含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3活性檢測試劑盒和二喹啉甲酸(BCA)蛋白濃度測定試劑盒購于碧云天生物技術研究所,乳酸脫氫酶(LDH)測定試劑盒購于南京建成生物工程研究所。AQP1野生型(AQP1-WT)和AQP1突變型(AQP1-MUT)熒光素酶報告載體由百奧邁科生物公司構建。Facscallbar流式細胞儀購于美國Becton Dickinson公司,StepOne Plus實時熒光定量聚合酶鏈反應(PCR儀購于美國ABI公司。全自動凝膠成像分析儀和酶標儀購于美國Bio-Rad公司,CO2培養箱購于美國Thermo scientific公司,H/R裝置購于長沙長錦應用技術研究所。
1.2方法
1.2.1細胞培養、實驗分組和H/R處理 使用含10%胎牛血清、100 U/ml鏈霉素和100 U/ml青霉素的高糖DMEM培養基在細胞培養箱內常規培養H9c2細胞,其中培養箱條件為濕度飽和、溫度37℃和CO2體積分數5%。選取長勢良好的第3代對數生長期H9c2細胞進行實驗。實驗分為對照組(正常培養)、H/R組(H/R處理)、H/R+丙泊酚組(行H/R處理前給予濃度為25 μmol/L丙泊酚〔2〕預處理)。每組設置3個平行孔。H/R處理:使用經95%N2、5%CO2混合氣體飽和過的缺氧液替換原培養液后,置于持續通入95%N2、5%CO2混合氣體的缺氧容器中缺氧處理120 min。以5%CO2、95%O2混合氣體飽和過的培養液置換缺氧液后,置于5%CO2、95%O2培養箱內復氧處理30 min。H9c2細胞缺氧復氧的時間參照文獻〔2〕。
1.2.2MTT檢測H9c2細胞存活率 將對數生長期的H9c2細胞按5×104個/孔種植至96孔細胞板上,于培養箱中常規培養過夜。將H9c2細胞按照1.2.1中進行分組并給予相應處理,另以不含細胞的培養液作為調零組。待處理結束后,胰蛋白酶消化收集各組細胞,加入5 g/L MTT溶液20 μl/孔并孵育4 h后,棄培養液,再以二甲基亞砜150 μl/孔孵育10 min。采用酶標儀檢測各處理組細胞的OD值,并以(實驗組OD值-調零組OD值)/(對照組OD值-調零組OD值)×100%表示各組H9c2細胞存活率。重復檢測3次。
1.2.3LDH試劑盒檢測H9c2細胞上清液中LDH釋放量 收集處理結束后的對照組、H/R組和H/R+丙泊酚組細胞上清液,按照LDH試劑盒說明書測定各組H9c2細胞上清液中LDH的釋放量。重復檢測3次。
1.2.4流式細胞儀檢測H9c2細胞凋亡率 將對數生長期的H9c2細胞按照105個/孔接種至6孔細胞板上后,按照1.2分組處理細胞。處理結束后,胰蛋白酶消化收集各組細胞,按照Annexin V-FIFC/PI試劑盒說明書檢測對照組、H/R組和H/R+丙泊酚組中H9c2細胞凋亡率。重復檢測3次。
1.2.5H9c2細胞Caspase-3活性檢測 收集處理結束后的對照組、H/R組和H/R+丙泊酚組細胞,參照Caspase-3活性檢測試劑盒說明書檢測各組細胞的Caspase-3活性。重復檢測3次。
1.2.6實時熒光定量PCR檢測H9c2細胞中miR-133a 采用Trizol法提取對照組、H/R組和H/R+丙泊酚組細胞的總RNA后,參照AMV第一鏈cDNA合成試劑盒說明書將RNA逆轉錄合成cDNA。將cDNA作為模板,根據上海生工生物工程公司合成的PCR引物(miR-133a上游序列5′-ATGGTTCGTGCGTTTGGTCCCCTTCA-3′,下游序列5′-GCAGGGT-CCGAGGTATTC-3′;內參U6上游序列5′-CTCGCTTCGGCAGCACA-3′,下游序列5′-AACGCTTCAC-GAATTTGCGT-3′)按照94℃預變性5 min、(94℃變性60 s、60℃ 退火30 s、72℃延伸60 s)×40次的反應程序上PCR儀進行擴增,以U6為內參,采用2-△△Ct法檢測對照組、H/R組和H/R+丙泊酚組細胞中miR-133a的表達水平。
1.2.7Western印跡檢測H9c2細胞中AQP1蛋白 參照全蛋白提取試劑盒說明書提取對照組、H/R組和H/R+丙泊酚組細胞的總蛋白,并采用BCA法定量總蛋白的濃度。將蛋白樣品中加入4倍的5×上樣緩沖液并混勻后,在100℃下變性5 min。將熱變性后的蛋白樣品以每孔80 μg上樣至十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離。轉膜后,采用含5%脫脂奶粉的封閉液封膜2 h。加入1∶1 000比例稀釋的AQP1和GAPDH一抗工作液4℃下孵育過夜。次日,加入1∶5 000比例稀釋的辣根酶標記的山羊抗兔IgG室溫孵育1 h。經化學發光劑顯影曝光,采用全自動凝膠成像分析儀各組H9c2細胞中AQP1蛋白的表達水平。重復檢測3次。
1.2.8細胞轉染 將對數生長期的H9c2細胞按照每孔105個種植至6孔細胞板上后,置于培養箱中常規培養。待細胞達70%~80%融合度時,將細胞分為H/R+丙泊酚+anti-miR-133a組(轉染miR-133a inhibitor后行H/R和丙泊酚處理)和H/R+丙泊酚+anti-miR-NC組(轉染 inhibitor-NC后行H/R和丙泊酚處理),根據脂質體2000說明書按照實驗分組將miR-133a inhibitor及inhibitor-NC轉染至H9c2細胞中,轉染48 h后,參照1.2.1中的步驟進行H/R和丙泊酚處理。處理結束后,收集H/R+丙泊酚+anti-miR-133a組、H/R+丙泊酚+anti-miR-NC組及對照組、H/R組和H/R+丙泊酚組細胞,分別采用實時熒光定量PCR、Western印跡、MTT比色法、LDH試劑盒、流式細胞儀、Caspase-3活性檢測試劑盒分別檢測各組細胞中miR-133a和AQP1蛋白的表達水平、細胞存活率、細胞上清液中LDH釋放量、細胞凋亡率和Caspase-3活性。
1.2.9雙熒光素酶報告基因實驗檢測miR-133a和AQP1靶向關系 將對數生長期的H9c2細胞按照每孔106個種植于6孔細胞板上后,置于培養箱內常規培養。實驗分為AQP1-WT+miR-133a組、AQP1-WT+miR-NC組、AQP1-WT+anti-miR-133a組、AQP1-WT+anti-miR-NC組、AQP1-MUT+miR-133a組、AQP1-MUT+miR-NC組、AQP1-MUT+anti-miR-133a組、AQP1-MUT+anti-miR-NC組,待細胞達70%~80%融合度時,根據脂質體2000說明書將AQP1-WT和AQP1-MUT熒光素酶報告載體分別與miR-133a mimics、miR-133a inhibitor及其相應對照mimics-NC、inhibitor-NC共轉染48 h后,收集各組細胞并按照熒光素酶檢測試劑盒說明書檢測細胞熒光素酶活性。重復檢測3次。
1.3統計學方法 采用SPSS22.0軟件進行單因素方差分析、SNK-q、t檢驗。
2 結 果
2.1丙泊酚保護H/R誘導的H9c2細胞損傷 與對照組相比,H/R處理后H9c2細胞存活率明顯降低,且H9c2細胞上清液中LDH 釋放量和細胞凋亡率、Caspase-3活性均明顯升高(均P<0.05),H/R可引起H9c2細胞損傷;但給予丙泊酚處理后,H/R誘導的H9c2細胞損傷明顯得到改善,表現為H9c2細胞存活率明顯升高,且LDH 釋放量、細胞凋亡率和Caspase-3 活性明顯降低(均P<0.05)。見圖1,表1。

圖1 流式細胞儀檢測各組細胞凋亡
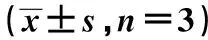
表1 各組細胞存活率、LDH 釋放量、細胞凋亡率和Caspase-3 活性比較
2.2丙泊酚上調H/R誘導的H9c2細胞中miR-133a表達 與對照組miR-133a表達水平(1.00±0.08)比較,H/R組(0.42±0.03)和H/R+丙泊酚組(0.73±0.05)均明顯降低(均P<0.05),但給予丙泊酚處理后H/R誘導的miR-133a表達下降明顯受到抑制(P<0.05)。
2.3丙泊酚下調H/R誘導的H9c2細胞中AQP1蛋白的表達 圖2和表3結果所示,與對照組AQP1蛋白(0.32±0.03)比較,H/R組(0.95±0.06)和H/R+丙泊酚組(0.48±0.03)均明顯升高(P<0.05);與H/R組比較,給予丙泊酚處理后H9c2細胞中AQP1蛋白表達水平明顯降低(P<0.05)。見圖2。

圖2 Western印跡檢測各組細胞AQP1蛋白表達水平
2.4miR-133a和AQP1靶向關系的驗證 TargetScan軟件預測結果見圖3。miR-133a與AQP1 3′ UTR存在互補的結合位點。與miR-NC組比較,同AQP1-WT共轉染的miR-133a組細胞的熒光素酶活性明顯降低(P<0.05);而同AQP1-WT共轉染的anti-miR-133a組細胞的熒光素酶活性較anti-miR-NC組明顯升高(P<0.05)。見表2。

圖3 miR-133a和AQP13′UTR的結合位點
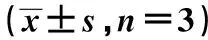
表2 各組細胞的熒光素酶活性
2.5下調miR-133a表達可逆轉丙泊酚對AQP1蛋白表達的抑制作用 與對照組比較,H/R后H9c2細胞中miR-133a表達水平明顯降低(P<0.05),但AQP1蛋白表達水平均明顯升高(P<0.05);與H/R組比較,丙泊酚處理后H9c2細胞中miR-133a表達水平均明顯升高,而AQP1蛋白的表達水平均明顯降低(均P<0.05);與H/R+丙泊酚組相比,轉染anti-miR-133a成功下調miR-133a表達后可引起H9c2細胞中AQP1蛋白表達升高(P<0.05)。見圖4,表3。

1~5:對照組,H/R組,H/R+丙泊酚組,H/R+丙泊酚+anti-miR-NC組,H/R+丙泊酚+anti-miR-133a組圖4 Western印跡檢測各組細胞中AQP1蛋白表達
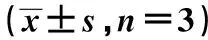
表3 各組細胞miR-133a和AQP1蛋白表達及細胞存活率、LDH 釋放量、細胞凋亡率和Caspase-3活性比較
2.6下調miR-133a逆轉丙泊酚對H/R誘導的H9c2細胞損傷的改善作用 與對照組比較,H/R處理可引起H9c2細胞存活率明顯降低,且細胞上清液中LDH釋放量和細胞凋亡率及Caspase-3活性明顯升高(P<0.05),表明H/R可誘導H9c2細胞損傷;給予丙泊酚處理后由H/R誘導H9c2細胞損傷明顯改善,表現為H9c2細胞存活率升高及LDH釋放量、細胞凋亡率、Caspase-3活性明顯降低(P<0.05);而轉染anti-miR-133a后丙泊酚對H/R誘導的H9c2細胞損傷的改善作用明顯受到抑制(P<0.05)。見表3,圖5。

圖5 流式細胞儀檢測各組細胞凋亡
3 討 論
心肌細胞凋亡是導致心肌細胞死亡的重要方式,被認為是MIRI發生的重要機制〔11,12〕,Caspase-3是細胞凋亡的重要執行因子,其活性的高低可反映細胞凋亡程度〔13〕。此外,心肌細胞壞死也是導致心肌細胞死亡的方式,而LDH是檢測細胞壞死的重要手段;LDH是一種重要的糖酵解酶,細胞膜受損后LDH外漏程度可反映細胞的受損程度〔14〕。本研究結果表明,H/R處理可引起心肌細胞損傷。此外,給予丙泊酚作用后,H/R引起的H9c2細胞損傷明顯減輕,該結果與Li等〔3〕得到的丙泊酚可通過降低H/R誘導的心肌細胞凋亡發揮保護MIRI的結果相一致。本研究進一步證實了丙泊酚可通過抑制心肌細胞凋亡改善H/R誘導的心肌細胞損傷。
miR-133a是一種高度保守的miRNA,包括miR-133a-1(位于18q11.2染色體)和miR-133a-2(位于20q13.33染色體)兩個亞型,與腫瘤和心血管疾病的發生發展密切相關〔15~17〕。本研究以H/R處理H9c2細胞后發現,miR-133a的表達明顯降低。該結果與Ren等〔18〕給予H/R處理后H9c2細胞中miR-133a表達下調的結果相吻合。本研究結果提示miR-133a可能在丙泊酚改善H/R誘導的心肌細胞損傷過程中發揮著重要作用。AQP1是一種細胞膜特異性水轉運蛋白,不僅參與水分子的轉運過程,在細胞凋亡和血管生成等相關〔19,20〕。在大鼠MIRI中AQP1表達升高〔21〕,而使用AQP1抑制劑乙酰唑胺可使心肌梗死面積減少,增加瑞芬太尼后處理對心肌缺血再灌注損傷的保護作用〔7〕。本研究結果提示,在丙泊酚改善H/R誘導的心肌細胞損傷過程中,AQP1可能發揮著重要作用。
本研究結果表明AQP1是miR-133a的靶基因,miR-133a可負向調控其表達。這提示丙泊酚可能通過上調miR-133a表達,進而引起miR-133a靶基因AQP1表達下調。田軼魁等〔6〕研究指出,上調miR-133a表達可通過抑制心肌細胞凋亡、減少梗死面積和改善心臟功能對MIRI起到保護作用。本研究結果提示miR-133a表達上調是丙泊酚改善H/R誘導的H9c2細胞損傷的重要機制。
綜上,丙泊酚可通過調控miR-133a/AQP1表達改善H/R誘導的H9c2細胞損傷。該結果為丙泊酚臨床抗MIRI提供了新的實驗依據。

