miR-637靶向調控FOXM1表達影響肺癌細胞增殖、遷移和侵襲
付珺 毛君 陳寶鈞
(華中科技大學同濟醫學院附屬武漢市中心醫院胸外科,湖北 武漢 430014)
多數早期肺癌患者無明顯癥狀,確診時已處于晚期階段〔1〕。隨著醫學水平的提高,盡管肺癌的診斷和治療有了較大改善,但肺癌患者預后仍然很差,局部晚期或轉移性肺癌患者的5年生存率低于5%〔2〕,因此,了解肺癌的發病機制并尋求新的治療靶點有重要意義。微小RNA(miRNA)是一類內源性小分子非編碼RNA,長度為18~25個核苷酸。miRNA通過調節腫瘤細胞的生長、侵襲和轉移,參與腫瘤的發生和發展〔3〕。研究表明,miR-637在乳頭狀甲狀腺癌、膠質瘤、宮頸癌等多種腫瘤組織或細胞中異常表達,與癌細胞的增殖、遷移和轉移密切相關〔4,6〕。叉頭框蛋白(FOX)M1屬于叉頭框基因家族成員,是一種已被證實的致癌因子〔7〕。FOXM1參與細胞的增殖、遷移、侵襲、血管生成等過程,是臨床腫瘤治療的靶點〔8〕。FOXM1在肺腺癌組織中高表達,與患者淋巴結轉移有關,是肺腺癌的新型腫瘤標志物〔9〕。非小細胞肺癌A549細胞中FOXM1高表達,RNA-149可靶向調控FOXM1的表達影響A549細胞的增殖和凋亡〔10〕。生物信息學顯示,miR-637可靶向調控FOXM1表達。但目前,miR-637在肺癌細胞中的表達和其對肺癌細胞增殖、遷移、侵襲的影響及miR-637是否通過調控FOXM1的表達影響肺癌細胞的增殖、遷移、侵襲還尚未有報道。本研究探討了miR-637在肺癌細胞中表達水平及其對肺癌細胞增殖、遷移和侵襲的影響和作用機制,為肺癌的臨床治療提供新靶點。
1 材料與方法
1.1細胞和實驗試劑 肺癌細胞株A549、SPC-A1和NCl-H460及正常肺上皮細胞BEAS-2B均購自中科院上海細胞生物研究所細胞庫;MTT和二甲基亞砜(DMSO)購自美國Sigma公司;胎牛血清(FBS)和RPMI1640 購自HyClone公司;LHC-8 MEDIUM無血清培養基購自上海浩然生物技術有限公司;Trizol試劑購自 Invitrogen公司;反轉錄試劑盒和PCR試劑盒購自上海聯邁生物工程有限公司;引物序列由金斯瑞生物科技公司提供;RIPA細胞裂解液購自北京奧維亞生物技術有限公司;二喹啉甲酸(BCA)蛋白試劑盒購自碧云天公司;FOXM1、細胞周期蛋白(Cyclin)D、p21和p27抗體購自美國Santa Crus公司;基質金屬蛋白酶(MMP)-2、MMP-9和MMP-14抗體購自北京博奧森生物技術有限公司;LipofectamineTM2000試劑盒購自上海瓦蘭生物科技有限公司;雙熒光素酶報告基因檢測試劑盒購自廣州伯信生物科技有限公司。
1.2實驗方法
1.2.1細胞培養 A549、SPC-A1和NCl-H460細胞復蘇后,加入含10%FBS的RPMI1640培養基,置于37℃、5%CO2培養箱中培養。BEAS-2B采用LHC-8 MEDIUM無血清培養基進行培養。待細胞融合至80%左右時,胰酶消化,進行傳代培養或用于后續實驗。
1.2.2細胞轉染 參照LipofectamineTM2000說明書操作。構建miR-493-3p過表達的A549細胞,分為miR-NC組和miR-637組,miR-NC組細胞未轉染,miR-637組細胞轉染miR-493-3p mimics。構建FOXM1低表達的A549細胞,分為si-NC組和si-FOXM1組,si-NC組細胞未轉染,si-FOXM1組細胞轉染si-FOXM1。構建miR-637和FOXM1均過表達的A549細胞,分為miR-637+pcDNA組和miR-637+pcDNA-FOXM1組,miR-216a+pcDNA組細胞共轉染miR-637與pcDNA,miR-216a+pcDNA-FOXM1組共轉染miR-637與pcDNA-FOXM1。
1.2.3MTT檢測細胞增殖 對數生長期的A549細胞,以2.5×104個/ml的濃度接種于96孔板中,每孔加入200 μl。分別培養24 h、48 h和72 h,每孔加入20 μl 5 mg/ml的MTT溶液,培養箱中繼續孵育4 h。棄上清液,每孔加入150 μl二甲基亞砜(DMSO),反應10 min后,混合均勻,使用酶標儀于490 nm測定OD值。
1.2.4Transwell檢測細胞遷移和侵襲 將基質膠使用不含FBS的RPMI1640培養基以1∶1的比例配置細胞外基質膠,在Transwell小室聚碳酸酯膜上面每室加入30 μl,包被細胞外基質膠。A549細胞胰酶消化,重懸于不含FBS的RPMI1640培養基中,細胞濃度1×105個/ml。細胞遷移實驗:使用未包被細胞外基質膠的Transwell小室,上室加入100 μl細胞懸液,下室加入600 μl含10%FBS的RPMI1640培養基,37℃、5%CO2培養箱中培養24 h。細胞侵襲實驗:使用包被了細胞外基質膠的Transwell小室,其余操作與細胞遷移實驗相同。每組設置3個復孔。培養結束后,取出上室,擦去小室濾膜內表面的細胞,4%多聚甲醛固定,0.1%結晶紫染色,顯微鏡下觀察,并對穿過膜的細胞進行計數,拍照。隨機選取5個視野,求平均值。
1.2.5qRT-PCR檢測基因表達 收集各組細胞,加入Trizol試劑提取RNA。微量核酸儀檢測RNA的純度和濃度,260 nm處吸光值與280 nm處的吸光值比值大于1.8時可用于cDNA合成。以cDNA為模板,進行PCR擴增。擴增條件:95℃預變性30 s,之后 95℃ 5 s,60℃ 30 s,72℃ 30 s,共進行40個循環。以U6為內參,采用 2-△△Ct法計算miR-493-3p和GDF15 mRNA相對表達水平。
1.2.6Western印跡檢測蛋白表達 收集各組細胞,加入RIPA細胞裂解液提取總蛋白,BCA法測定蛋白含量。取適量蛋白質進行十二烷基硫酸鈉(SDS)-聚丙烯酰胺凝膠電泳(PAGE)。電泳后,電轉移至硝酸纖維素膜,5%脫脂牛奶室溫條件下封閉1 h,加入一抗,4℃搖床孵育過夜。TBST洗膜,每次10 min,清洗3次。加入二抗,室溫孵育1 h。TBST洗膜后,加入電化學發光(ECL)試劑,避光顯影。Image J軟件分析條帶灰度值。
1.2.7雙熒光素酶報告基因實驗 A549細胞接種與6孔板中,待細胞融合至60%左右時用于轉染。實驗分為4組,miR-NC+WT-GDF15、miR-637+WT-GDF15、miR-NC+MUT-GDF15和miR-637+MUT-GDF15,每組設置3個復孔。細胞轉染后培養12 h,更換新鮮培養基,繼續培養48 h,依據雙熒光素酶報告基因檢測試劑盒操作說明,檢測熒光素酶的活性。
1.3統計學分析 采用SPSS22.0軟件進行獨立樣本t檢驗、單因素方差分析。
2 結 果
2.1miR-637和FOXM1在肺癌細胞和正常肺上皮細胞中的表達 與BEAS-2B細胞比,肺癌細胞A549、SPC-A1和NCl-H460中miR-637均顯著降低,差異有統計學意義(P<0.05),FOXM1 mRNA和蛋白表達均顯著升高,差異有統計學意義(P<0.05),說明肺癌細胞miR-637呈低表達,FOXM1呈高表達。見表1、圖1。
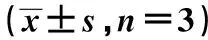
表1 肺癌細胞和正常肺上皮細胞的mRNA和蛋白表達量

圖1 FOXM1在肺癌細胞和正常肺上皮細胞中的表達
2.2miR-637過表達對肺癌A549細胞增殖的影響 miR-637組A549細胞中miR-637表達水平顯著高于miR-NC組,說明miR-637過表達的A549細胞構建成功。隨著培養時間的增加,miR-NC組和miR-637組細胞OD值均增大。培養48 h、72 h miR-637組細胞OD值顯著低于miR-NC組(P<0.05),說明miR-637過表達可抑制A549細胞增殖。與miR-NC組比,miR-637組CyclinD蛋白水平顯著降低(P<0.05),p21和p27蛋白水平顯著升高(P<0.05),提示miR-637過表達可能通過調控與增殖相關的蛋白表達抑制A549細胞增殖。見圖2、表2。

圖2 miR-637過表達對肺癌A549細胞增殖相關蛋白表達的影響
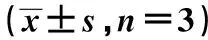
表2 miR-637的相對表達量及miR-637過表達對肺癌A549細胞增殖的影響
2.3miR-637過表達對肺癌A549細胞遷移侵襲的影響 miR-637組細胞遷移和侵襲的數量均顯著低于miR-NC組(P<0.05),說明miR-637過表達可抑制A549細胞遷移和侵襲。miR-637組MMP-2、MMP-9和MMP-14均顯著低于miR-NC組(P<0.05),提示miR-637過表達可能通過抑制MMP-2、MMP-9和MMP-14的表達抑制A549細胞的遷移和侵襲。見表3、圖3、圖4。
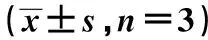
表3 miR-637 過表達對肺癌A549 細胞遷移侵襲的影響

圖3 肺癌A549細胞的遷移侵襲(結晶紫染色,×100)

圖4 miR-637過表達對肺癌A549細胞遷移侵襲相關蛋白表達的影響
2.4抑制FOXM1表達對肺癌A549細胞增殖、遷移、侵襲的影響 si-FOXM1組FOXM1蛋白表達顯著低于si-NC組(P<0.05),說明FOXM1低表達的A549細胞建立成功。si-NC組和si-FOXM1組細胞OD值均隨著培養時間的增加而增大。培養72 h si-FOXM1組細胞OD值低于si-NC組(P<0.05),說明抑制FOXM1表達可抑制A549細胞增殖。si-FOXM1組細胞遷移和侵襲的數量均顯著低于miR-NC組(P<0.05),說明抑制FOXM1表達可抑制A549細胞的遷移和侵襲。與miR-NC組比,si-FOXM1組細胞p21蛋白水平升高(P<0.05),CyclinD、MMP-2、MMP-9蛋白水平降低(P<0.05),說明抑制FOXM1的表達也能調控與增殖、遷移和侵襲相關的蛋白表達。見圖5、表4。

圖5 蛋白電泳
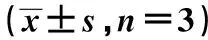
表4 抑制FOXM1表達對肺癌A549細胞增殖、遷移、侵襲的影響
2.5miR-637靶向調控FOXM1的表達 在線miRNA靶點預測工具預測結果顯示,FOXM1的3′UTR中含有與miR-637互補的核苷酸序列,推測miR-637可能靶向調控FOXM1表達。見圖6。雙熒光素酶報告實驗結果顯示,攜帶有WT-GDF15的miR-637組細胞熒光素酶活性顯著低于miR-NC組(P<0.05),而攜帶有MUT-GDF15的miR-637組細胞熒光素酶活性與miR-NC組無顯著差異(P>0.05),提示miR-637可靶向調控FOXM1表達。見表5。miR-637組FOXM1蛋白相對表達量顯著低于miR-NC組(0.21±0.03 vs 0.53±0.06,P<0.05)。anti-miR-493-3p組A549細胞FOXM1蛋白表達顯著高于anti-miR-NC組(0.85±0.09 vs 0.51±0.05,P<0.05),見圖7。說明miR-493-3p可負向調控FOXM1表達。

1~4:miR-NC組、miR-637組、anti-miR-NC組、anti-miR-637組圖6 FOXM1的3′UTR中含有與miR-637互補的核苷酸序列
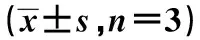
表5 miR-637與FOXM1的雙熒光素酶報告實驗

1~4:miR-NC組、miR-637組、anti-miR-NC組、anti-miR-637組圖7 miR-637調控FOXM1蛋白的表達
2.6FOXM1過表達逆轉了miR-637過表達對肺癌A549細胞增殖、遷移、侵襲的作用 miR-637+pcDNA-FOXM1組A549細胞中FOXM1蛋白水平顯著高于miR-637+pcDNA組。培養48 h、72 h,miR-637+pcDNA-FOXM1組細胞OD值高于miR-637+pcDNA組(P<0.05),說明FOXM1過表達可逆轉miR-637過表達對肺癌A549細胞的增殖作用。Transwell法檢測結果顯示,miR-637+pcDNA-FOXM1組細胞遷移和侵襲的數量均顯著高于miR-637+pcDNA組(P<0.05),說明FOXM1過表達可逆轉miR-637過表達對肺癌A549細胞的遷移和侵襲影響。與miR-637+pcDNA組比,miR-637+pcDNA-FOXM1組細胞p21蛋白水平降低(P<0.05),CyclinD、MMP-2、MMP-9蛋白水平升高(P<0.05),說明FOXM1過表達也能逆轉miR-637過表達對肺癌A549細胞增殖、遷移和侵襲相關蛋白表達的影響。見圖8、表6、表7。

1~4:miR-NC組、miR-637組、miR-637+pcDNA組、miR-637+pcDNA-FOXM1組圖8 Western印跡檢測蛋白表達
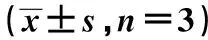
表6 FOXM1過表達逆轉miR-637過表達對肺癌A549細胞增殖的作用
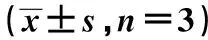
表7 FOXM1過表達逆轉miR-637 過表達對肺癌A549 細胞遷移、侵襲的作用
3 討 論
miR-637位于染色體19p13.3,具有自主轉錄單位。研究表明,miR-637在腫瘤的發生發展過程中起抑癌基因作用〔11〕。Li等〔12〕研究發現,人膽管癌組織中miR-637表達降低,miR-637過表達可抑制膽管癌細胞QBC939的增殖、遷移和侵襲能力,促進QBC939細胞凋亡。袁青領等〔13〕通過構建過表達miR-637的甲狀腺乳頭癌TPC-1細胞株發現,miR-637過表達可抑制TPC-1細胞的增殖。miR-637在肺癌細胞中的表達和其對肺癌細胞增殖、遷移侵襲的影響還未見報道。本研究結果提示肺癌細胞中miR-637低表達,miR-637可能也作為抑癌基因在肺癌中發揮作用。通過構建miR-637過表達的A549細胞,結果顯示,miR-637過表達可抑制A549細胞的增殖、遷移和侵襲,提示miR-637可能是肺癌治療的新靶點。細胞周期是細胞增殖的基礎,CyclinD是細胞周期中的關鍵蛋白〔14〕。CyclinD1驅動細胞從G0期向S期轉變,此過程受到p21與p27的負向調節〔15〕。本研究顯示,miR-637過表達可降低A549細胞CyclinD蛋白表達,促進p21和p27蛋白表達,提示miR-637過表達可能通過調控與細胞周期相關的蛋白表達抑制A549細胞增殖。基質金屬蛋白酶是一類可水解細胞外基質和基底膜的酶,能夠促進癌細胞的侵襲和轉移〔16〕。本研究結果顯示,miR-637過表達抑制了A549細胞MMP-2、MMP-9和MMP-14的表達,提示miR-637過表達可能通過下調A549細胞中MMP的表達進而抑制其遷移和侵襲。
FOXM1在肺癌組織或相關肺癌細胞中高表達,參與肺癌的發生和發展〔17,18〕。本研究也顯示,肺癌細胞A549、SPC-A1和NCl-H460中FOXM1呈高表達,抑制FOXM1表達可抑制A549細胞的增殖、遷移和侵襲能力。miRNA可與靶mRNA基因的3′端UTR區結合,抑制mRNA翻譯或裂解mRNA,進而調控基因的表達〔19〕。研究顯示,miR-498可通過下調FOXM1表達抑制A549的遷移和侵襲〔20〕。生物信息學發現,FOXM1也是miR-637的靶基因,因此,推測肺癌細胞中miR-637可能也通過調控FOXM1的表達影響肺癌細胞的增殖、遷移和侵襲。雙熒光素酶實驗報告基因檢測結果也證實,肺癌A549細胞中miR-637可調控FOXM1的表達。通過共轉染pcDNA、pcDNA-FOXM1與miR-637至A549細胞,結果發現,FOXM1過表達可逆轉miR-637過表達對肺癌A549細胞增殖、遷移和侵襲的作用,提示miR-637通過調控FOXM1表達影響A549細胞的增殖、遷移和侵襲能力。
綜上所述,肺癌細胞中miR-637低表達,FOXM1高表達,miR-637通過負向調控FOXM1表達抑制肺癌細胞的增殖、遷移和侵襲,為miR-637作為潛在治療肺癌增殖和轉移侵襲的新靶點提供了一定的實驗依據。

