常山和常山堿的藥理作用及減毒研究進展△
孫穎,趙旭,夏新華,肖小河*
1.湖南中醫藥大學 藥學院,湖南 長沙 410208;
2.解放軍總醫院 第五醫學中心 肝病醫學部,北京 100039
中藥常山為虎耳草科植物常山Dichroa febrifugaLour.的干燥根,味辛、苦,性寒,有毒,歸肺、肝、心經,功能為涌吐截瘧,用于痰飲停聚、瘧疾[1]。《金匱要略》中記載蜀漆散可治療“牝瘧”[2],《肘后備急方》治療寒熱瘧的39 方中有14 方含有常山[3],《本草綱目》記載常山有截瘧之功,書中附24 首使用常山治療瘧疾的方劑[4],近代亦有應用常山丸控制住大規模瘧疾暴發的案例[5]。現代藥理研究結果也表明常山中生物堿類成分抗瘧活性良好[6-7],而常山涌吐作用的研究起源于常山在抗瘧過程中顯現出來的催吐不良反應[7-9]。另外,目前已有常山抗腫瘤、抗炎、抗心律失常及興奮子宮平滑肌等藥理作用的探索[10-13]。
常山及常山堿抗瘧活性雖好,但至今仍未成藥,根本原因在于其容易造成嘔吐等胃腸道不良反應[8,14]。為減少常山的不良反應,國內外學者做了諸多探索。本文從制約常山苦寒偏性(中醫藥理論)、控制常山堿用量(藥理作用)、修飾常山堿結構(化學成分)3 個角度對常山和常山堿的減毒研究進行綜述,以促進常山的安全用藥。
1 常山的藥理作用及機制
1.1 抗瘧的藥效物質基礎及作用機制
常山含有喹唑酮類生物堿、香豆素、甾體和多酚等多類化學成分[15],目前已報道的具有抗瘧活性的成分主要有常山堿乙素(常山堿)、常山堿甲素(異常山堿)和常山堿丙素,由我國藥理學家張昌紹從常山中提取分離出來[16]。3 個生物堿藥效差異較大,常山堿甲素的抗瘧活性與奎寧相當[17],常山堿乙素的抗瘧藥效約為奎寧的40 倍[7],常山堿丙素的抗瘧藥效為奎寧的100 倍以上[6]。由于常山堿丙素的抗瘧作用最強但不良反應最大,常山堿甲素的活性較弱,因此,對常山抗瘧作用的研究主要圍繞常山堿乙素展開。
文獻調研發現,常山、常山提取物及常山堿的抗瘧機制研究較少,而針對常山堿衍生物常山酮的研究較多且更深入。常山的抗瘧機制研究主要從對宿主免疫細胞的影響、對宿主細胞因子的影響及對瘧原蟲胞質脯氨酸tRNA(prolyl-tRNA)合成酶的影響(瘧原蟲的血液階段)展開。Murata 等[18]將常山堿單體給予伯氏瘧原蟲感染的小鼠,發現在0.1~1.0 mg·kg-1·d-1可劑量依賴性地促進小鼠腹腔巨噬細胞中一氧化氮(NO)的生成(常山的甲醇提取物也可,但為非劑量依賴性促進)。而Kim 等[19]的發現與其相反,認為常山根的水提物可能抑制小鼠腹腔巨噬細胞中NO 的產生,且認為此結果可能與其給藥成分、給藥方式、給藥時間與Murata 等的不同及可能存在的污染有關。郭志廷等[20]研究了常山堿對小鼠巨噬細胞的影響,認為常山堿可顯著提高小鼠的免疫功能。Ⅰshih 等[21]考察了常山堿和異常山堿對感染瘧原蟲小鼠γ-干擾素(ⅠFN-γ)、白細胞介素-4(ⅠL-4)的影響,發現細胞因子水平的升高與小鼠存活率及寄生蟲血癥的改善程度呈正相關。Derbyshire等[22]考察了常山酮抑制瘧原蟲肝期的特性:在肝癌細胞HepG2 中,常山酮對伯氏瘧原蟲子孢子載量有抑制作用,半數抑制濃度(ⅠC50)為17 nmol·L-1,抑制時間進程分析表明,常山酮可影響寄生蟲發育的早期和晚期。Sundrud 等[23]發現常山酮可通過激活細胞保護信號通路-氨基酸饑餓反應(AAR)選擇性地抑制小鼠和人輔助性T 細胞(Th)17 的分化,此種抑制作用可通過添加過量的氨基酸逆轉,并且在選擇性氨基酸耗盡后可被激活的AAR 所模擬;常山酮對在紅細胞內生長的惡性瘧原蟲的抑制作用可隨脯氨酸的加入逆轉,在感染惡性瘧原蟲Dd2 株(氯喹耐藥株)的含氨基酸紅細胞培養基中加入5×脯氨酸,常山堿及常山酮的ⅠC50值分別增加約5倍和7倍,而對抗瘧藥阿莫地喹的ⅠC50值無影響,進一步體外實驗發現,瘧原蟲胞質prolyl-tRNA 合成酶可能是常山堿及其衍生物常山酮的雙階段作用靶點[24-25]。
1.2 涌吐作用及作用機制
常山涌吐作用的研究起源于抗瘧過程中顯現出的不良反應。常山為傳統有毒中藥,被列為下品,始載于《神農本草經》。《藥性論》中稱常山有“小毒”[26],《雷公炮炙論》記載:“勿令老人、久病服之”[27]。而早期臨床應用案例表明,常山的毒性反應為惡心嘔吐等胃腸道反應:周廷沖等[8]用常山粗制浸膏片治療間日瘧患者13 例,有惡心嘔吐反應者7例(占比53.8%);一項制止常山治療瘧疾時發生嘔吐不良反應的研究也發現常山可引發惡心和嘔吐現象(占比15.3%),且此不良反應可通過配伍檳榔子、按劑量冷服等方法減輕[9]。
初期對常山催吐機制的探索在鴿子中進行,認為常山堿丙素對鴿子的催吐作用是中樞性的[6]。由于鴿子不具有嘔吐動物所具有的催吐化學感應區,江文德等[28]在鴿子中研究了常山堿的催吐機制,實驗結果初步認為常山堿引發的嘔吐機制有外周反射和直接作用于嘔吐中樞2 種可能,又在手術犬中證明常山堿所致嘔吐作用主要由刺激胃腸道的反射作用引起[14]。隨著嘔吐研究新成果的出現[29],有研究采用小鼠和大鼠異食癖模型探索常山堿鹽(DAS)的催吐機制,發現嚙齒動物異食癖模型可有效表征常山堿鹽誘導的嘔吐現象,常山堿鹽可能同時通過5-羥色胺(5-HT)和P 物質(SP)2 種途徑誘導嘔吐反應[30-31],但常山堿鹽是刺激胃腸道通過迷走神經作用于中樞還是直接刺激嘔吐中樞尚不明確,還有待進一步研究。
1.3 常山的其他藥理作用
除抗瘧和催吐外,常山還具有抗腫瘤、抗纖維化、促進傷口愈合等藥理作用。孟丹華等[10]發現常山水提醇沉物可能通過干預細胞周期、促進細胞凋亡、抑制細胞能量代謝等途徑抑制食管癌細胞EC9706的增殖。Xu等[32]發現常山堿的同分異構體異常山堿可通過基質金屬蛋白酶(MMPs)影響人胃癌細胞SGC7901 的增殖、遷移和侵襲。閆燕艷等[33]發現常山酮可抑制人乳腺癌細胞MDA-MB-231 增殖活性。Zuo 等[34]發現在D-α-生育酚聚乙二醇1000 琥珀酸鹽(TPGS)聚合膠束中封裝的常山酮可通過破壞線粒體膜電位、促進活性氧形成誘導MDA-MB-231 細胞周期阻滯和凋亡,且具有較強的體外腫瘤抑制率(68.17%)。De Jonge等[35]在晚期實體瘤患者中評估了常山酮的劑量限制毒性(DLTs),確定其Ⅱ期臨床研究推薦劑量為0.5 mg·d-1(口服,每日1次)。Koon 等[36]在艾滋病相關的卡波西(Kaposi)肉瘤Ⅱ期臨床試驗中發現,僅在接受常山酮治療的病灶中Ⅰ型膠原顯著減少。常山的抗纖維化作用研究主要圍繞常山酮展開,常山酮可通過抑制轉化生長因子-β(TGF-β)信號通路下游的Smad 3 磷酸化,減少膠原蛋白的含量,減少細胞外基質沉積,選擇性預防Th17 細胞分化等途徑發揮抗纖維化作用[37],可用于治療杜氏肌營養不良癥[38],對刀豆蛋白A 誘導的大鼠肝纖維化有效[39],還可預防糖尿病腎病的細胞外基質沉積[40]、關節炎、硬皮病和慢性移植物抗宿主病[41-42]等。
常山及其活性成分常山堿、異常山堿、常山堿衍生物常山酮等的藥效研究概況見圖1。
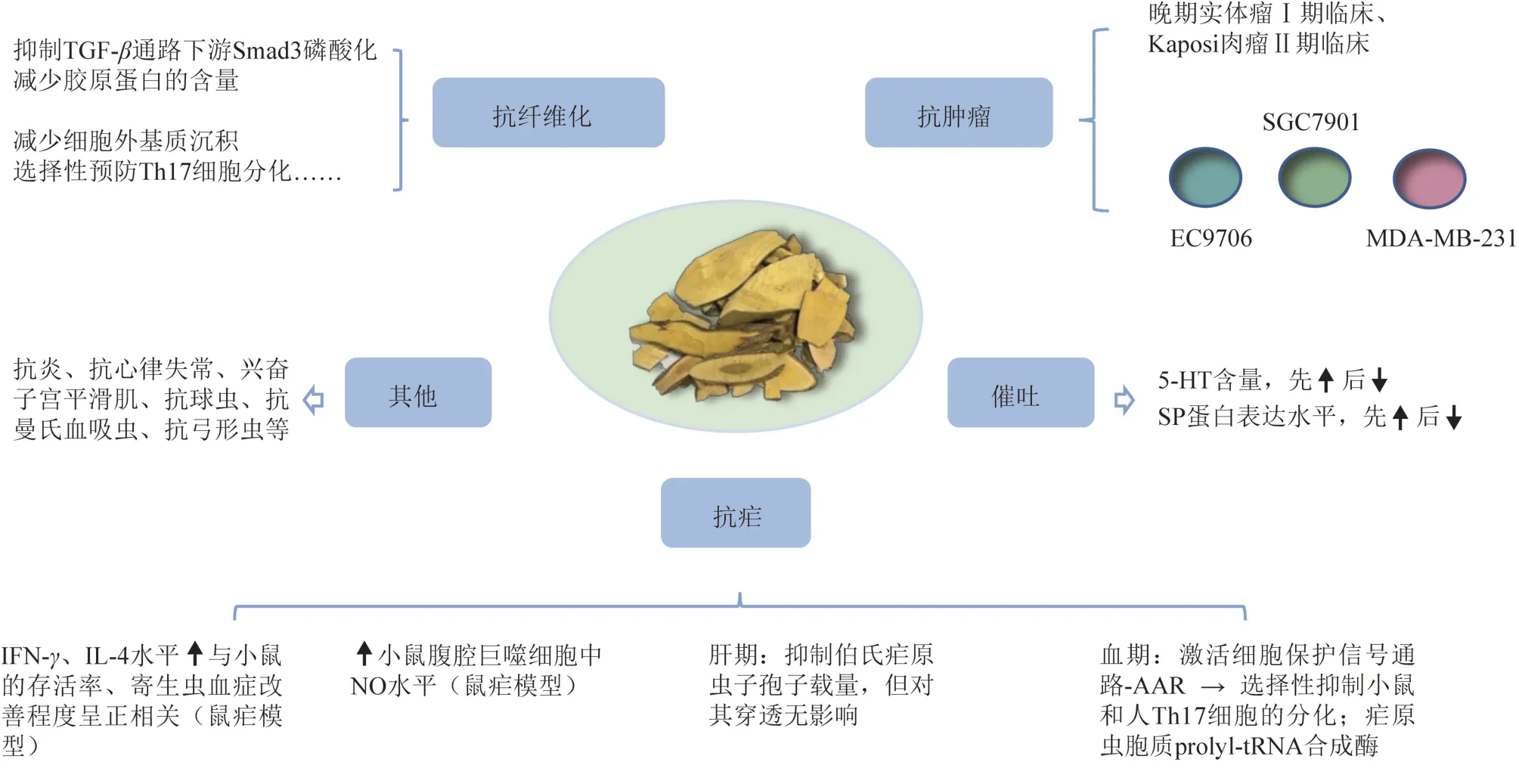
圖1 常山及其活性成分常山堿等的藥效研究概況
2 常山及常山堿的減毒研究進展
常山抗瘧藥效良好同時存在催吐的不良反應,從風險獲益角度講,常山屬于高獲益-低風險類藥物。進一步調研可發現,常山的毒性主要與以下幾個因素有關:首先,從中醫藥理論角度看,寒涼之品易致脾虛,中陽不足、升降失職、濁陰上逆而成嘔吐[43],常山藥性寒涼,易致嘔吐;其次,藥效學研究結果表明常山堿鹽0.5 mg·kg-1給藥時毒性較小,但平均瘧原蟲轉陰率僅為25%,2.0 mg·kg-1給藥時平均瘧原蟲轉陰率達100%,但小鼠的死亡率也高達90%,治療指數小,安全窗窄[44];最后,從化學角度看,結構是化合物內在活性和成藥性的基礎[45],常山堿的結構和毒性之間有密切關聯。
2.1 基于中醫藥理論的減毒研究
2.1.1炮制解毒 炮制可增效,可減毒,可緩和藥性,也可產生新藥效,常山藥性苦寒,炮制可緩其寒涼之性;同時,在加熱條件下常山堿的含量可隨溫度變化而產生可逆/不可逆的變化[46],因此,炮制是減輕常山寒涼致吐之性的可用方法。對常山炮制方法的探索最早見于東晉葛洪所著《肘后備急方》[3],彼時將生常山作涌吐藥使用,炙常山作抗瘧藥使用。歷代有記載的炮制方法除酒炙外,尚有清炒、醋炒、甘草水制及瓜蔞汁制等,近代保留下來的炮制方法主要有清炒、醋制和酒制[47],而《中華人民共和國藥典》2020 年版[1]所載常山飲片僅生品和炒品2 種。現代對常山炮制減毒的研究結合對活性成分常山堿(和異常山堿)含量的考察:楊肖衣等[48]考察了貴州不同產地生品常山中常山堿和異常山堿總含量的差異;葉定江等[49]發現,即使同一地區的常山,不同的炮制方法也會影響常山堿的含量(生常山>醋炒常山>清炒常山>酒炒常山),認為有必要進一步考察各種炮制方法對常山堿含量的影響;楊海軍等[50]以常山堿和異常山堿的含量為評價指標優化了酒常山的炮制工藝。
2.1.2相畏配伍 依據中醫對催吐機制的理解,常山藥性寒涼,易致嘔吐。在不減少用量的情況下,將寒涼藥性的常山配伍溫熱藥性和/或助陽止吐等作用的藥物可緩其寒涼之性,減其催吐作用,此為常山的相畏配伍。古有蜀漆散治療牝瘧[2],方中云母、龍骨具有助陽、鎮逆和胃之功,可緩解蜀漆(常山嫩葉)的寒涼催吐之性。近代有多例依據相畏配伍原理,將常山配伍藥性溫熱、兼具止吐作用中藥使用的案例:眉山血吸蟲治療組將常山與檳榔配伍治療瘧疾患者26 例,發現由藥物本身引起的惡心嘔吐僅4 例[9];湖北麻城醫務工作者將鮮常山配伍辛溫陳皮粉、生姜酊、法半夏粉等制造常山丸,控制住了大規模暴發的瘧疾且未見不良反應[5]。現代既有常山堿鹽與中藥活性成分的聯用減毒,也有其與化學鎮吐藥的聯用:王鳳玉[51]將常山堿鹽配伍具胃腸道保護作用的中藥活性成分姜黃素制成常山堿鹽-姜黃素復合脂質體,發現與單用常山堿鹽的脂質體相比,此復合脂質體的安全性和抗瘧藥效均明顯提高;將常山堿鹽與機制較明確的中樞鎮吐劑昂丹司瓊、阿瑞匹坦和甲氧氯普胺配伍,探索其催吐機制,發現常山堿鹽誘導的嘔吐現象可被5-HT3 受體拮抗劑昂丹司瓊、神經激肽-1(NK-1)受體拮抗劑阿瑞匹坦有效拮抗[30-31]。
2.2 基于藥理作用的減毒研究
常山抗瘧的主要藥效成分為常山堿,且藥理毒理研究表明其鹽常山堿鹽抗瘧時的治療指數小、安全窗窄[44]。20 世紀40 年代末常山堿作為抗瘧成分被發現[16],此后少見常山堿的聯用減毒研究,隨著生物科學技術的發展,近年來國內學者嘗試減少常山堿的用量,將常山堿鹽配伍青蒿素類衍生物以考察其毒效變化情況。李思迪等[44]將常山堿鹽(0.5 mg·kg-1)與青蒿素類抗瘧藥(青蒿素、雙氫青蒿素、蒿甲醚和青蒿琥酯)聯用,發現此配伍既減少了青蒿素類藥物單用時的瘧原蟲復燃現象及耐藥現象,也增強了常山堿鹽低劑量使用時的抗瘧活性,同時因為減少了常山堿鹽用量,其不良反應也減輕。除基礎研究外,還有應用領域的探索,葉祖光課題組[52-53]利用醇質體的促滲特性,將常山堿乙素和青蒿琥酯聯用制成凝膠膏劑等外用劑型,既增強了常山堿低劑量使用時的抗瘧藥效,且因為制備過程無需高溫加熱,亦最大程度地保存了有效成分的含量和藥效。
2.3 基于構效關系的減毒研究
2.3.1基于生物電子等排替換的減毒衍生物發現 與基于結構的藥物設計比,基于生物電子等排替換的藥物設計應用更為廣泛。常山堿的結構修飾研究主要集中在國外,常山堿的結構由喹唑酮環、丙酮連接基及右側的哌啶環3 部分組成,因此其結構修飾研究也從這三方面展開。對喹唑酮環的結構修飾研究由從小鼠肝臟酶S9(即肝微粒酶S9)分離出的2個主要代謝產物Feb-A(C-6 氧化)和Feb-B 開始[54];常山酮(C-6、C-7 位添加氯和溴原子)亦是常山堿喹唑酮環氧化的產物之一,20世紀60年代末作為抗球蟲藥被合成[55],2005 年Jiang 等[56]重新評價了其抗瘧活性,發現此種結構變化不僅未改變常山酮的抗瘧活性,還降低了其對宿主細胞的毒性(選擇性指數為常山堿的10倍)。綜上分析,對常山堿喹唑酮環的氧化不僅保存了常山堿的抗瘧活性,還可降低對宿主細胞的毒性。采用同樣的方法對常山堿的丙酮連接基和哌啶環加以修飾后,產物的抗瘧活性均有較大改變,甚至出現活性消除的現象:丙酮連接基方面,Kikuchi 等[57]將丙酮連接基的酮基完全去除并替換成酰胺類似物,發現所得產物對惡性瘧原蟲FCR-3株(氯喹敏感株)的活性降低,即使將其改造成具喹烷嗪環的丙酮縮合物也未能提高抗瘧活性;哌啶環修飾方面,20 世紀50 年代Baker 等[58]嘗試去除哌啶環上的羥基,合成了常山堿衍生物脫氧常山堿,但Takeuchi 等[59]發現其抗瘧活性弱于常山堿,并進一步改變氮原子在哌啶環上的位置,發現此類化合物的體內外抗瘧活性均完全喪失[60]。綜上,保持丙酮基和哌啶環的完整性對保存產物的抗瘧活性至關重要。常山堿及常山堿衍生物的結構信息見表1和圖2。

表1 常山堿及常山堿衍生物的結構信息
2.3.2計算機輔助的減毒衍生物發現 計算機輔助的虛擬預測/篩選方法可在短時間內開展大規模篩選,與傳統的化學合成法相比,該方法效率高、成本低。虛擬預測方面,隨著大量常山堿衍生物的發現,體內體外抗瘧數據也隨之產生,對這些數據的利用有助于新型常山堿衍生物的發現[61]。Autreto等[62]提出一種基于電子指數設計常山堿衍生物的方案,將常山堿、異常山堿及其他10 個常山堿衍生物的抗瘧活性、細胞毒性、選擇性指數與其電子結構數據相關聯建立預測模型,并基于此模型發現1 個具有高選擇性的分子。隨著常山堿抗瘧機制研究的深入,常山抗瘧靶點的研究也有較大進展[25]。2017年,Pandey 等[63]運用虛擬篩選方法篩選到39 個潛在化合物,檢測后發現其中24 個化合物毒性較小,且化合物FA12、FA21 對所有選定的參數均無毒性;進一步通過分子動力學方法模擬化合物FA12、FA21對瘧原蟲的雙重抑制作用,發現化合物FA12(圖2)為潛在的抗瘧原蟲漿蛋白酶Ⅱ(plasmepsin Ⅱ)和prolyl-tRNA合成酶的衍生物。

圖2 常山堿及常山堿衍生物的化學結構
減少常山及常山堿不良反應的方法有多種,既可兩藥聯用減其量存其效,也可相畏配伍或炮制以制常山寒涼偏性,還可修其結構以達減毒存效目的。各方法的研究現狀、優缺點及發展趨勢見表2。

表2 常山及常山堿的減毒方法比較
3 結語與討論
常山及常山堿的藥理作用研究主要圍繞其抗瘧作用和催吐作用進行,對其催吐作用的研究以輔助其抗瘧藥效的開發為目標,對其抗瘧作用的研究圍繞降低催吐等不良反應而開展;此外還有常山堿衍生物常山酮抗腫瘤、抗纖維化、抗炎等作用的探索。常山及抗瘧活性成分常山堿的減毒研究有所進展,但仍有很多工作需要做。首先,與炮制減毒相比,常山的配伍減毒研究更充分,尚有應用方面(凝膠膏劑、巴布劑等[51-53])的探索,可對現有研究成果加以開發。其次,上述減毒方法各有特色,但常山的抗瘧成分亦是毒性成分,常山堿的結構修飾研究存在固有缺陷;加之炮制會流失大量常山堿[64],相比之下常山的配伍減毒研究更具可行性。再次,數據挖掘技術可用于揭示中醫方劑的配伍規則,可運用關聯規則[65]等算法挖掘常山的古今用藥經驗,為其配伍減毒研究提供指引。最后,常山的抗瘧作用被關注較多,而催吐作用少有人關注,可從毒效轉化角度對常山的催吐作用加以利用。

