2017—2020年某院臨床分離耐碳青霉烯陰溝腸桿菌檢測及分析
侯辰蕊 陳東科 戎建榮 李亞楠 周永年 栗子洋 董怡然,*
(1 山西白求恩醫院(山西醫學科學院 同濟山西醫院),山西醫科大學第三醫院檢驗科,太原 030032;2 衛生部北京醫院檢驗科,北京 100730)
耐碳青霉烯革蘭陰性桿菌(carbapenem-resistant Gram-negative bacillus)已造成全球流行,并持續增長。世界衛生組織(WHO)將腸桿菌目細菌列為ESKAPE(耐萬古霉素屎腸球菌、 耐甲氧西林金黃色葡萄球菌、耐碳青酶烯肺炎克雷伯菌、耐碳青酶烯鮑曼不動桿菌、耐碳青酶烯銅綠假單胞菌、耐碳青酶烯腸桿菌)中一種,被認為是醫院感染的主要原因之一。2017年將碳青霉烯類耐藥腸桿菌目(CRE)細菌、碳青霉烯類耐藥銅綠假單胞菌(CRPA)和碳青霉烯類耐藥鮑曼不動桿菌(CRAB)列為最高危級別[1]。為了應對全球流行,盡早識別并持續監測耐碳青霉烯革蘭陰性菌非常重要。有證據表明,感染碳青霉烯耐藥菌的患者比感染敏感菌的患者發病率和死亡率更高[2],而多數原因是由于使用的抗生素對這些病原菌活性不佳或無活性所致[3]。因此,認識到碳青霉烯耐藥的風險和早期確定碳青霉烯耐藥機制是降低死亡率、住院時間和治療成本的關鍵因素[4-6]。陰溝腸桿菌是一種條件致病菌且已出現多重耐藥,作為醫院感染的重要病原菌給臨床治療和醫院感染控制帶來嚴峻的挑戰。本研究主要調查山西白求恩醫院(以下簡稱“本院”)2017—2020年臨床分離耐碳青霉烯陰溝腸桿菌的臨床分布、耐藥率、產碳青霉烯酶表型、耐藥基因檢出及傳播情況等,為臨床患者感染的診斷和治療提供參考依據。
1 材料與方法
1.1 菌株來源
收集本院2017年1月至2020年9月臨床分離陰溝腸桿菌531株,經過質譜儀鑒定復核菌種,根據2020年美國臨床實驗室標準化協會(CLSI)判斷標準和臨床藥敏報告篩選耐碳青霉烯陰溝腸桿菌33株(剔除同一患者同一部位重復分離菌株)。
1.2 儀器與試劑
全自動快速生物質譜檢測系統MALDI-TOF(美國Bruker, MicroflexLT/SH B);全自動微生物分析儀Vitek2(法國生物梅里埃);PCR擴增儀(杭州Bioter,TC96/G/H);電泳儀(Major Sciene/MINI-300);凝膠像儀(AlphalmagerHP,Proteinsimple)。引物(由北京博邁德生物公司合成);2×TaqPCR MasterMix(北京博邁德生物公司);質粒提取試劑盒(北京博邁德生物公司);10 μg美羅培南藥敏紙片(Oxoid公司);血平板(鄭州安圖,批號2020040501);質控菌株大腸埃希菌ATCC25922;質控菌株大腸埃希菌ATCC35218;受體菌大腸埃希菌EC600、肺炎克雷伯菌ATCCBAA-1705和肺炎克雷伯菌ATCCBAA-2146由軍事醫學科學院周冬生教授惠贈。
1.3 菌株鑒定及藥物敏感試驗
將篩選出的菌株用血平板傳代后置于35℃培養18~24 h,用質譜儀鑒定菌種并進行藥敏試驗。使用E-test條和MH平板復核藥敏試驗結果,大腸埃希菌ATCC25922作為質控菌株。
1.4 碳青霉烯酶表型及耐藥基因檢測
1.4.1 MALDI-TOF檢測碳青霉烯酶活性特征性蛋白
配置亞胺培南抗生素溶液(終濃度0.5 mg/mL)20 μL。用1 μL接種環取過夜孵育的待測菌株一環,均勻懸浮于含有亞胺培南抗生素溶液的離心管中,37℃孵育20 min,14000 g離心2 min。取孵育后的抗生素溶液上清1 μL至MSP靶板上,自然晾干后覆蓋1 μL基質溶液,晾干上機檢測。基質溶液為空白對照手動模式采集質譜圖(激光頻率60 Hz,單次激光照射次數為40)。保存并導入FlexAnalysis軟件分析。
1.4.2 mCIM及eCIM改良碳青霉烯滅活試驗
根據CLSI標準中改良碳青霉烯滅活試驗操作流程,進行mCIM及eCIM改良碳青霉烯滅活試驗。35℃生化培養箱孵育18~24 h后測量抑菌圈直徑判讀結果。肺炎克雷伯菌ATCCBAA-1705為產絲氨酸酶陽性對照菌,肺炎克雷伯菌ATCCBAA-2146為產金屬酶陽性對照菌。此試驗不適用于僅耐厄他培南菌株。
1.4.3 耐藥基因檢測
挑取一定量的新鮮菌落(傳代24 h內)懸濁于500 μL無RNA酶純水中,沸水浴15 min后,10000 r/min離心10 min,吸取上清液作為模板于-20℃以下保存備用。配置PCR體系:1 μL上下游引物、2 μL DNA模版、13 μL MasterMixPCR和8 μL無RNA酶的純水。PCR反應條件為95℃ 2 min、95℃ 30 s、退火30 s、72℃ 1 min,20個循環后72℃ 2 min。擴增產物使用1.5%瓊脂糖凝膠電泳,電壓為80 V,電流為100 mA。電泳完畢后置于凝膠成像儀成像,檢測是否有目的條帶。PCR陽性擴增產物送北京博邁德生物公司純化后雙向測序,序列經BLAST比對分析,以明確耐藥基因型。肺炎克雷伯菌ATCCBAA-1705為KPC陽性對照菌,肺炎克雷伯菌ATCCBAA-2146為NDM陽性對照菌。
1.5 多位點序列分型(MLST)及同源性分析
1.5.1 MLST分型
PCR擴增33株陰溝腸桿菌七對管家基因(dnaA、fusA、gyrB、leuS、pyrG、rplB和rpoB)序列(表2)。PCR反應條件為95℃ 5 min、95℃ 30 s、退火30 s、72℃ 1 min,30個循環后72℃ 5 min。將PCR擴增的產物送至北京博邁德生物公司進行測序,序列在MLST網站比對確定管家基因的等位基因序號,進一步確認菌株的ST型別。

表2 7對管家基因引物序列Tab.2 Seven pairs of housekeeper gene primer sequences
1.5.2 同源性分析
將所有菌株的7個基因位點的編號錄入BioNumerics(Version 8.0,Applied Maths,Belgium)軟件,用Categorical法計算相似性系數,用UPGMA方法構建聚類樹,使用MST方法構建最小生成樹。
1.6 質粒接合轉移實驗
以利福平耐藥大腸埃希菌EC600為受體菌(利福平750 μg/mL),供體菌為待檢陰溝腸桿菌(亞胺培南100 μg/mL)搖菌過夜。次日各取4 mL混合37℃孵育12~18 h,吸取100 μL混合菌液涂布于新的LB平板上(含利福平750 μg/mL和亞胺培南100 μg/mL)37℃過夜孵育篩選陽性接合子。通過MALDI-TOF鑒定接合子是否為大腸埃希菌,藥敏實驗檢測耐藥表型,PCR檢測基因是否在接合子中存在,驗證接合轉移是否成功。使用質粒提取試劑盒提取接合子中的質粒,對質粒進行測序后進行比對分析。

表1 耐碳青霉烯基因引物序列Tab.1 Primer sequence of carbapenem resistant gene
2 結果
2.1 耐藥菌株分布及藥物敏感試驗
篩選菌株顯示本院檢出耐碳青霉烯陰溝腸桿菌逐年遞增,2017年檢出1株,2018年檢出2株,2019年檢出7株,2020年檢出23株。33株菌患者來源前三位科室為神經外科9例、普通外科4例、骨科3例(圖1A)。標本來源前3位分別為痰液16例,尿液7例,引流液4例(圖1B)。藥敏試驗表明33株菌對多種抗生素耐藥,22株對美羅培南、亞胺培南和厄他培南全部耐藥,11株僅對厄他培南耐藥。除耐碳青霉烯類抗生素外,對頭孢類及含有酶抑制劑抗生素均耐藥,對喹諾酮類抗生素少數菌株敏感或中介,對氨基糖苷類抗生素大部分敏感或中介(表3)。
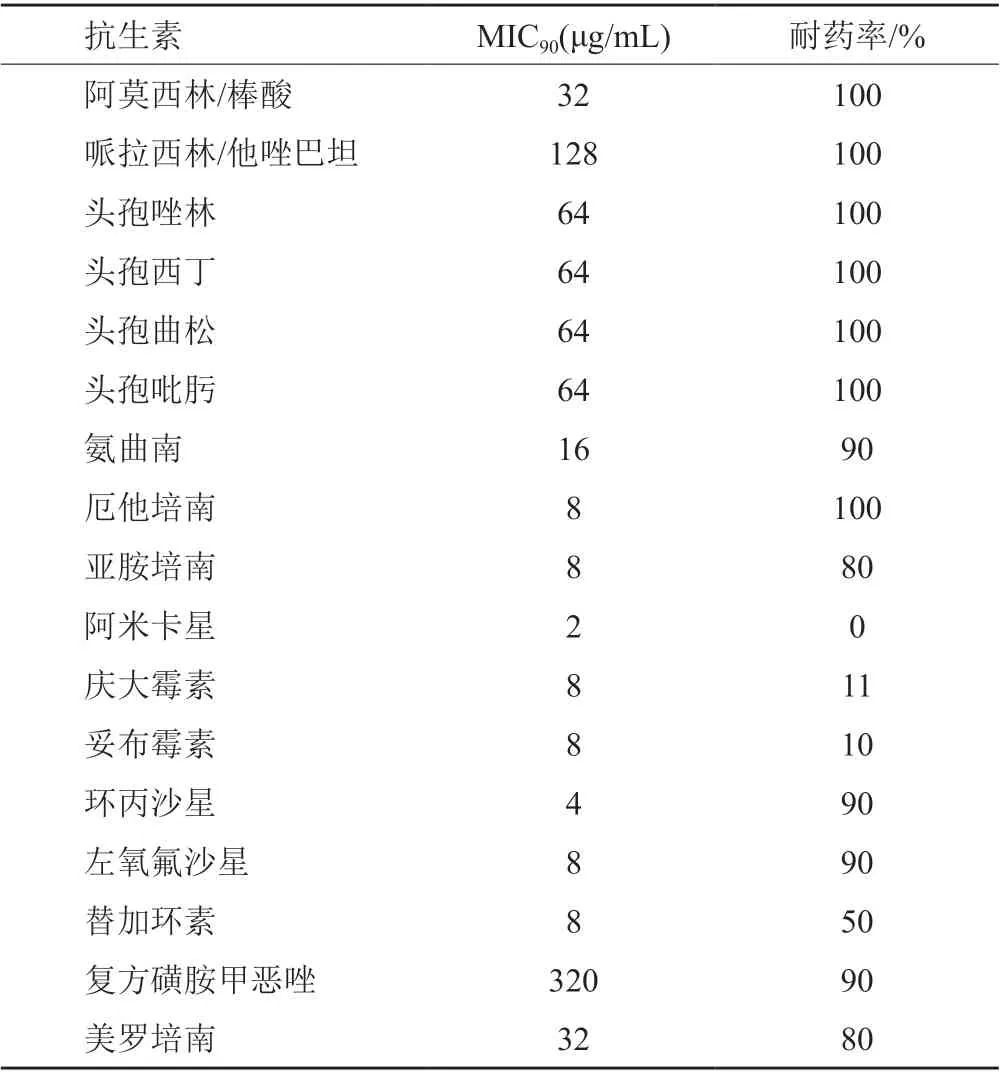
表3 33株耐碳青霉烯陰溝腸桿菌最低抑菌濃度結果Tab.3 Antimicrobial suscepbility testing results of 33 strains of carbapenem resistant Enterobacter cloacae
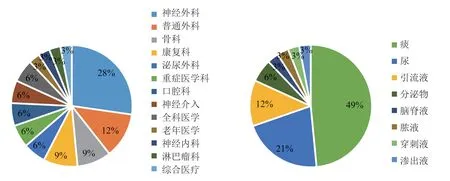
圖1 33株耐碳青霉烯陰溝腸桿菌科室分布和標本來源Fig.1 Department distribution and specimen source of 33 carbapenem resistant Enterobacter cloacae
2.2 MALDI-TOF檢測碳青霉烯酶活性特征性蛋白
在采集的質譜圖中位于289 Da和478 Da為非產酶株與亞胺培南孵育后的特異峰。產酶株中此兩峰均消失,同時在433 Da出現新的峰(圖2)。
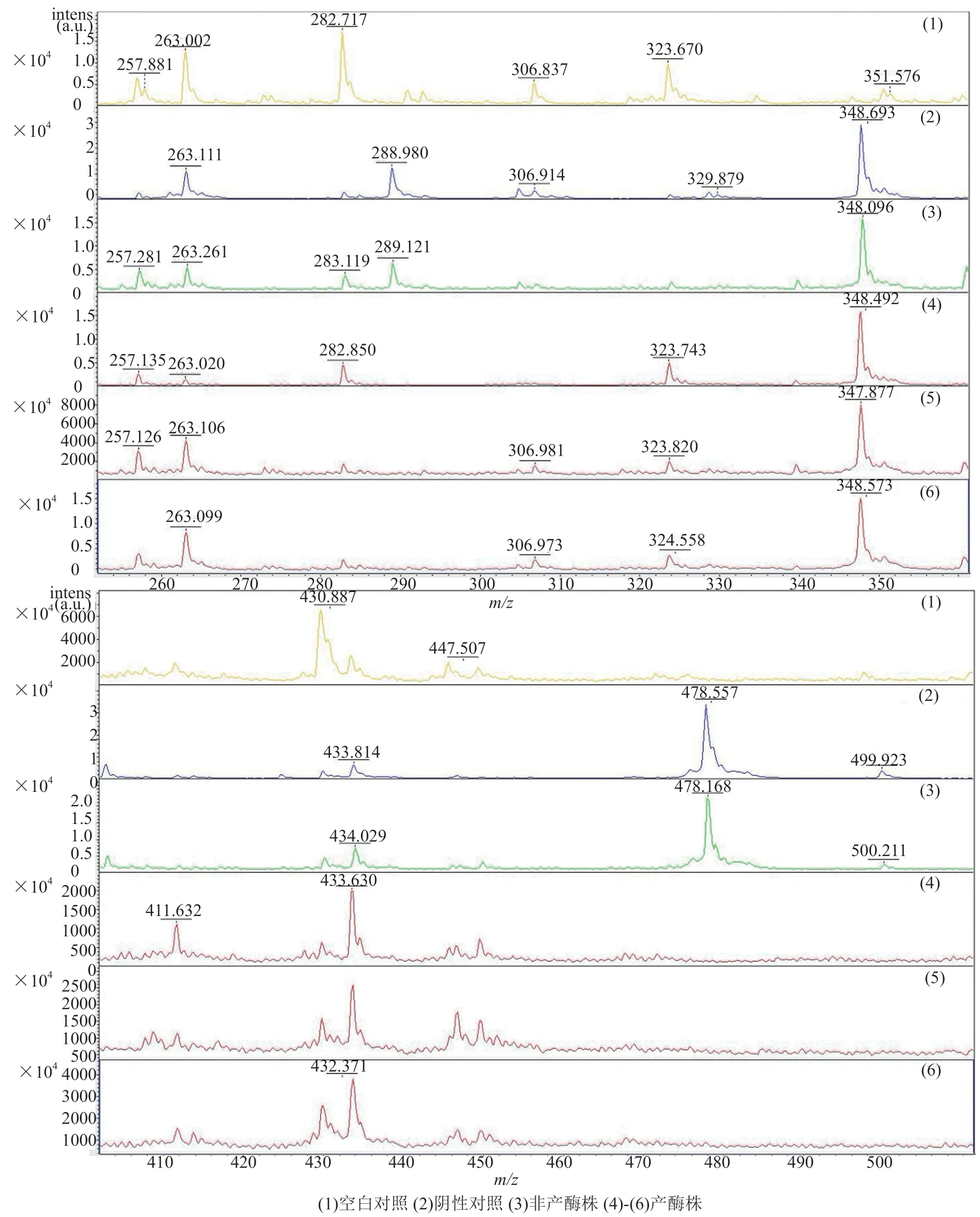
圖2 碳青霉烯酶活性質譜檢測譜圖Fig.2 MALDI-TOF test of carbapenemase activity
2.3 改良碳青霉烯滅活試驗
根據CLSI標準判讀結果22 株耐碳青霉烯(對美羅培南、亞胺培南和厄他培南全部耐藥)陰溝腸桿菌株mCIM均為陽性,提示為產碳青霉烯酶菌株。聯合eCIM 18株為陽性,2株菌(4和7號)為陰性,如圖3所示。
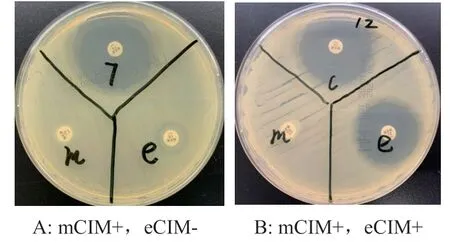
圖3 mCIM和eCIM實驗結果Fig.3 mCIM and eCIM results
2.4 耐藥基因檢測結果
用PCR方法對22株全耐碳青霉烯陰溝腸桿菌進行碳青霉烯酶基因篩查,檢出blaNDM、blaIMP-1和blaKPC耐藥基因。PCR擴增產物經北京博邁德生物公司進行測序后,序列進行BLAST比對后結果顯示16株陰溝腸桿菌產NDM-1(GenBank登錄號為 LC532143.1,序列符合率為100%),4株產NDM-5(GenBank登錄號為MN599031.1,序列符合率為100%),1株產KPC-2((GenBank登錄號為MN477223.1,序列符合率為99.61%)),10號菌株同時產NDM-1和KPC-2;4號和7號菌株2株產IPM-1(登錄號為LC548758.1,序列符合率為100%)。僅厄他培南耐藥菌株有兩株檢出NDM-1(E5和E8)基因,兩株檢出KPC-2基因(圖4)。
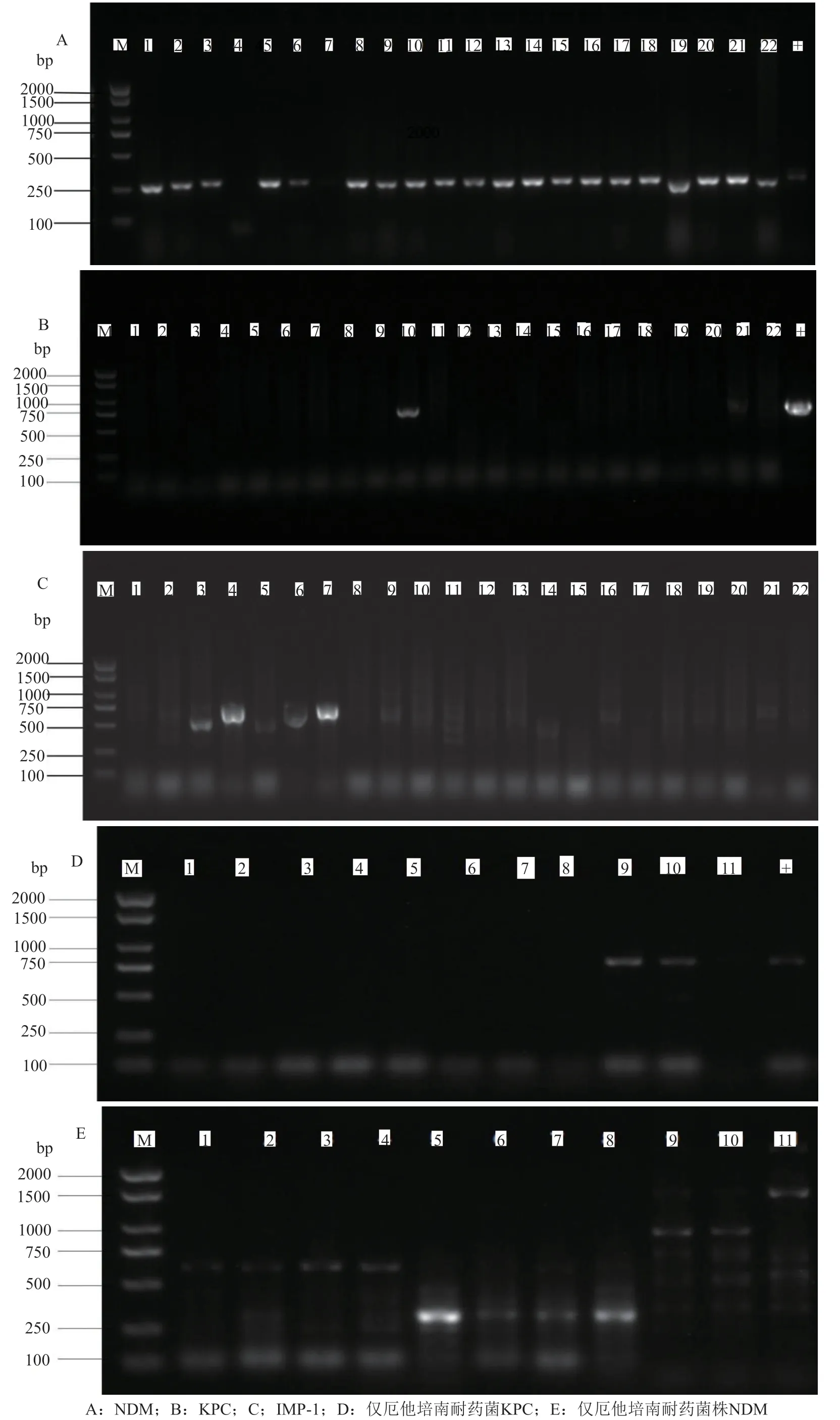
圖4 耐藥基因PCR擴增電泳圖Fig.4 Electrophoresis results of drug resistance gene amplification
2.5 多位點序列分析及聚類分析結果
篩選出的33株耐碳青霉烯陽性菌7對管家基因擴增測序MLST分析結果顯示最多為ST418型,其次為ST754 型。聚類分析結果顯示所有菌株同源性。以“標本來源”為特征生成最小生成樹(圖5)。
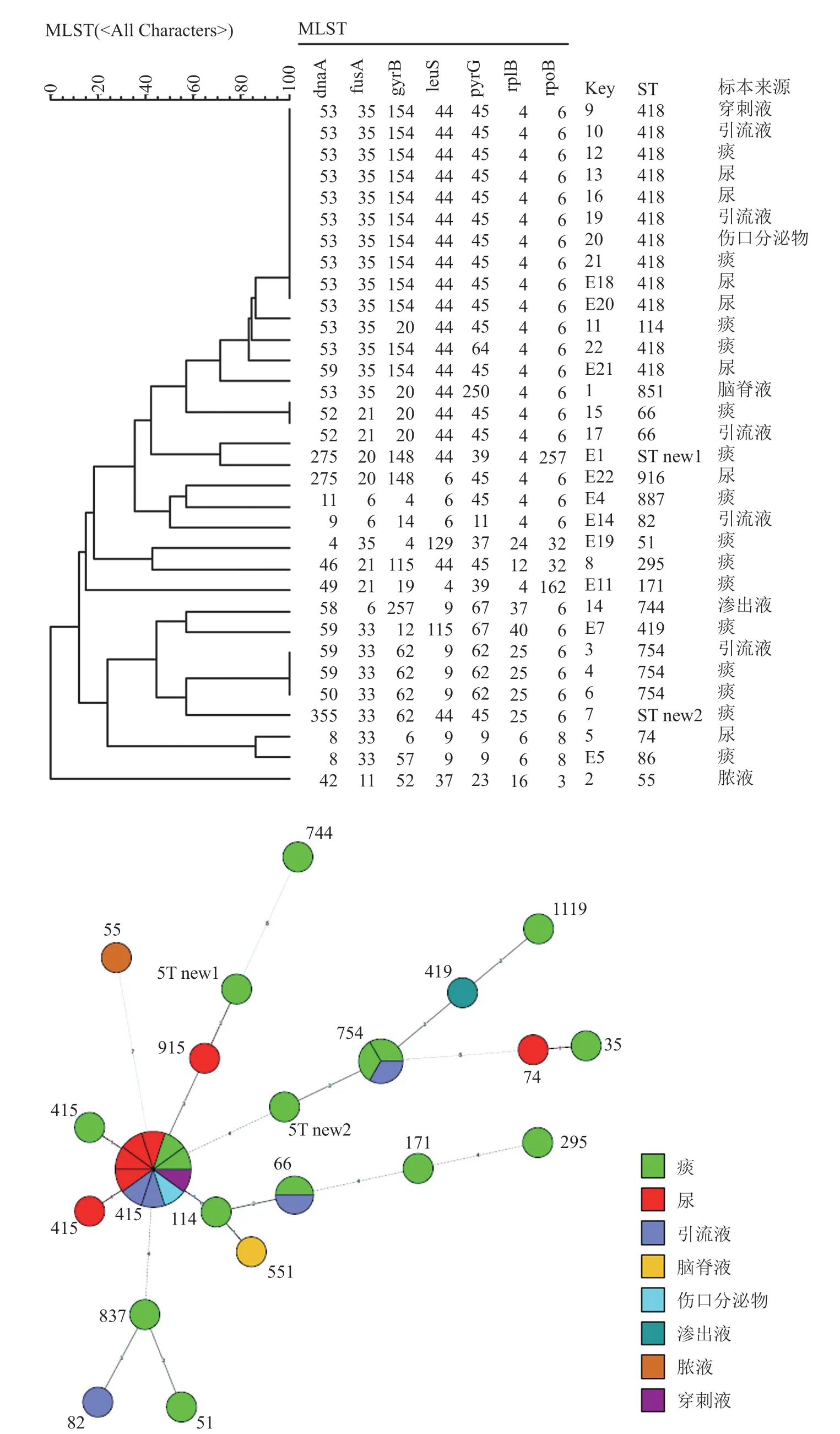
圖5 MLST分型聚類分析結果Fig.5 MLST typing cluster analysis results
2.6 質粒接合轉移實驗
22株全耐碳青霉烯陰溝桿菌中有8株的質粒成功轉移到大腸埃希菌EC600中。11株僅厄他培南耐藥陰溝腸桿菌沒有轉移成功的菌株。篩選的陽性接合子經質譜儀鑒定為大腸埃希菌,藥敏試驗結果美羅培南、亞胺培南、頭孢吡肟、頭孢他啶和哌拉西林/他唑巴坦等均耐藥。耐藥基因檢測檢出blaNDM,提取質粒測序比對后為IncX3型。
3 討論
陰溝腸桿菌是革蘭陰性粗短桿菌,廣泛存在于自然界的土壤、水、植物中,但在人體腸道內也可檢測出陰溝腸桿菌。陰溝腸桿菌被公認為醫院內感染主要病原體,是臨床上檢出除大腸埃希菌和肺炎克雷伯菌第三主要的腸桿菌目細菌[7]。隨著抗生素廣泛使用,在抗生素選擇壓力下耐藥陰溝腸桿菌迅速出現,給臨床抗感染治療工作和實驗室快速檢測帶來巨大挑戰[8]。1993年報道了第一例由產ESBLs的腸桿菌目菌株引起的醫院獲得性感染[9],隨后有不同的ESBLs酶(包括TEM, SHV和CTX-M)在陰溝腸桿菌中被檢出[10]。目前美國、西班牙、印度、澳大利亞及我國等許多國家都有耐碳青霉烯陰溝腸桿菌感染的報道[11-13]。本院近4年間檢出33株耐碳青霉烯陰溝腸桿菌,2017至2020年逐年增加。科室分布以神經外科(27%)最多,其次為普外科(12%)、骨科 (11%)和康復醫學科 (11%),經分析可能與前3位科室患者多有侵入性治療有關,而康復醫學科患者也多由前3位科室患者轉入繼續治療,造成耐藥菌株的傳播。標本來源是痰液標本(48%)最多,其次為尿液(21%)和引流液(12%),這可能與送檢不同樣本比例及患者接受氣管插管、尿管及引流管侵入性操作有關。查閱患者用藥史,檢出耐碳青霉烯陰溝腸桿菌患者均曾有亞胺培南、哌拉西林他唑巴坦、左氧氟沙星、頭孢噻肟、慶大霉素等多種抗生素聯合用藥,這與耐藥菌感染直接相關。臨床微生物實驗室陰溝腸桿菌常規藥敏通常只有一種或兩種碳青霉烯類抗生素藥敏結果,多為亞胺培南和美羅培南,如果遇到僅對厄他培南耐藥的菌株則無法及時發現。有研究建議厄他培南藥敏作為篩檢碳青霉烯耐藥菌的實驗[14]。
陰溝腸桿菌對碳青霉烯類抗生素敏感性降低的主要機制是由于產生碳青霉烯酶[15]。根據Ambler分類系統β-內酰胺酶分為4類(即A、B、C、D),其中,A類、B類和D類為碳青霉烯酶,而C類酶主要水解頭孢菌素[16]。A、C、D類酶的活性催化位點為絲氨酸,而B類酶的活性位點為金屬β-內酰胺酶(MBLs),活性位點為鋅[17]。A類酶代表多為KPC酶,而B類包括獲得性VIM、IMP和NDM酶[18],C類包括本身不是碳青霉烯酶的AmpC酶[19]。改良碳青霉烯酶滅活試驗是CLSI推薦的碳青霉烯酶表型檢測方法,本研究通過mCIM聯合eCIM試驗對菌株進行耐藥表型檢測,22株全耐藥陰溝腸桿菌株mCIM均為陽性,提示為產碳青霉烯酶菌株。聯合eCIM 2株(4、7)為陰性的菌株為黏液型陰溝腸桿菌判讀為產絲氨酸酶,但檢測耐藥基因為IMP。MALDI-TOF檢測碳青霉烯酶活性特征性蛋白的方法簡單快速,但不能區分產酶類型[20]。某報道陰溝腸桿菌產碳青霉烯酶以 A 類 KPC-2為主,B類和D類少見[21],但本研究經PCR檢測耐藥基因確認全耐碳青霉烯陰溝腸桿菌主要產金屬酶NDM(80%),此差異存在的原因可能與各地區間抗菌藥物使用情況以及地區環境不同所致。同時檢出NDM和KPC基因陰溝腸桿菌為我省首次報道,2017年曾有研究報道從慢性阻塞性肺疾病患者痰液中檢出1例[22],后續我們將對此菌株進一步做全基因組測序研究對比。另外本研究中1位患者同時檢出耐碳青霉烯陰溝腸桿菌和耐碳青霉烯肺炎克雷伯菌,兩株菌均產金屬酶NDM-5,說明耐藥基因在不同菌種間傳播。
MLST和聚類分析結果分析得出2017年僅1株散發(ST851),2018年兩株(ST55和ST754),2019年3株全耐碳青霉烯(兩株ST754和一株ST74),2020年16株全耐(其中9株ST418)。厄他培南耐藥陰溝腸桿菌在2019年檢出4株,2020年檢出7株。2020年暴發流行株為ST418型(共12株),與2018年Jin[23]研究報道的最主要流行菌株型別一致。2020年7號菌株來源于腦脊液,ST分型為新型,進一步研究將做全基因組測序確認后上傳序列。
綜上所述,本院臨床檢出耐碳青霉烯陰溝腸桿菌呈現逐年上升趨勢,主要耐藥基因是NDM,而且質粒接合轉移實驗說明耐藥基因具有水平傳播能力。臨床患者感染CRE直接影響其治療和預后,應當引起臨床和院感部門的重視,警惕合理使用抗生素的同時早發現早隔離,避免造成院內傳播。

