術前炎性反應指標評估非小細胞肺癌預后的價值
蘇俊飛,尹來波,胡思遠,朱佳龍
(1.石河子大學醫學院,新疆 石河子 832000;2.石河子大學第一附屬醫院心胸外科,新疆 石河子 832000)
肺癌是全世界發病率和死亡率最高的癌癥[1]。有兩種主要類型:非小細胞肺癌(NSCLC)和小細胞肺癌(SCLC),NSCLC占所有新肺癌診斷的約85%。目前,NSCLC的臨床治療決策和預后預測是基于腫瘤(TNM)分期的,然而,盡管手術技術和輔助化療技術取得很大進步,肺癌患者的術后總生存率(OS)仍尚短,給定疾病的診斷時患者已處于相對較晚的階段。因此,臨床實踐中應包括更多潛在的生物標志物,以改善NSCLC的預后預測。全身炎性反應在腫瘤發生進展起著重要作用,并且與術后患者生存相關聯[2-3]。幾種基于炎性因子的全身評分,如中性粒細胞與淋巴細胞之比(NLR),血小板與淋巴細胞之比(PLR)以及全身免疫炎性指數(SII),越來越多的研究發現SII是腫瘤預后不良獨立危險因素。目前臨床上很少研究其與NSCLC患者預后的關系。本研究通過檢測NSCLC患者初診時NLR、PLR、SII水平,觀察其與NSCLC患者預后的關系。本研究旨在探究術前SII與 NSCLC 患者OS的相關性,以調查和驗證術前SII在非小細胞肺癌患者中的預后價值。
1 資料和方法
1.1一般資料:收集石河子大學第一附屬醫院2010年1月~2015年12月行根治性切除術的NSCLC患者110例。納入標準:①術前具有完整的血常規分析檢驗結果;②行肺葉切除+淋巴結清掃(開胸手術);③術后病理證實為非小細胞肺癌;④所有均為初治,既往未實施放化療及手術治療的患者;⑤臨床病例資料和隨訪結果完整可靠。排除標準:①患者術前行化療或放療;②術前有臨床癥狀或微生物證實的感染患者;③患者合并有血液系統疾病或者合并自身免疫系統疾病;④手術前3個月內使用影響血常規檢查結果藥物的病例,如服用激素類、粒細胞集落刺激因子等藥物;⑤非腫瘤原因的死亡。根據上述標準,共有110例患者納入本研究,本次研究經過本院醫學倫理委員會同意。
1.2方法
1.2.1計算:術前7 d內抽取患者外周靜脈血進行血液學分析,檢測中性粒細胞、淋巴細胞、血小板等指標;NLR=中性粒細胞絕對數÷淋巴細胞絕對數;PLR=血小板計數絕對數÷淋巴細胞計數絕對數;SII=血小板計數×中性粒細胞計數/淋巴細胞計數。運用 SPSS26.0 軟件,根據受試者工作特征(ROC)曲線分析,選定 NLR、PLR以及SII的分界值。
1.2.2隨訪:利用病案記錄,以首次治療作為觀察起點開始隨訪,截至2020年6月30日,采用門診、短信或電話方式,根據病情行CT 或胸片、胸部B超等檢查。OS定義為從手術日期到死亡或最后一次隨訪日期。
1.3統計學分析:采用SPSS 26.0軟件進行統計學分析,計數資料組間比較采用χ2檢驗。Kaplan-Meier 方法計算生存曲線,用 Log-rank 法進行差異性檢驗。生存分析采用Cox單因素及多因素分析,以P<0.05為差異有統計學意義。
2 結果
2.1患者臨床資料:本研究最終納入110例NSCLC患者,男64例,女46例,年齡38~81歲,中位年齡63,平均61.41歲。 55例患者有吸煙史。其中49例發病部位在左肺,61例發病部位在右肺;周圍型肺癌80例,中央型肺癌30例;腺癌 70 例,鱗癌 40 例;低分化肺癌22例,中高分化肺癌88例; 根據《AJCC/UICC肺癌TNM分期》(第8版)行術后病理分期,Ⅰ期43例,Ⅱ期34例,Ⅲ期33例。
2.2NLR、PLR以及SII最佳截點的確定:根據ROC曲線(圖1),NLR、PLR及SII的最佳截點分別為1.78、142.02和502.60,其曲線下面積分別為0.627、 0.663及0.680。 NLR<1.78 者47例,占 42.72%,NLR≥1.78者 63 例 ,占 57.27% ;PLR<142.02者83例,占75.45%,PLR≥142.02 者 27例,占 24.55%;SII<520.60 者68例,占 61.82%,SII≥502.60者42例 ,占38.18%。
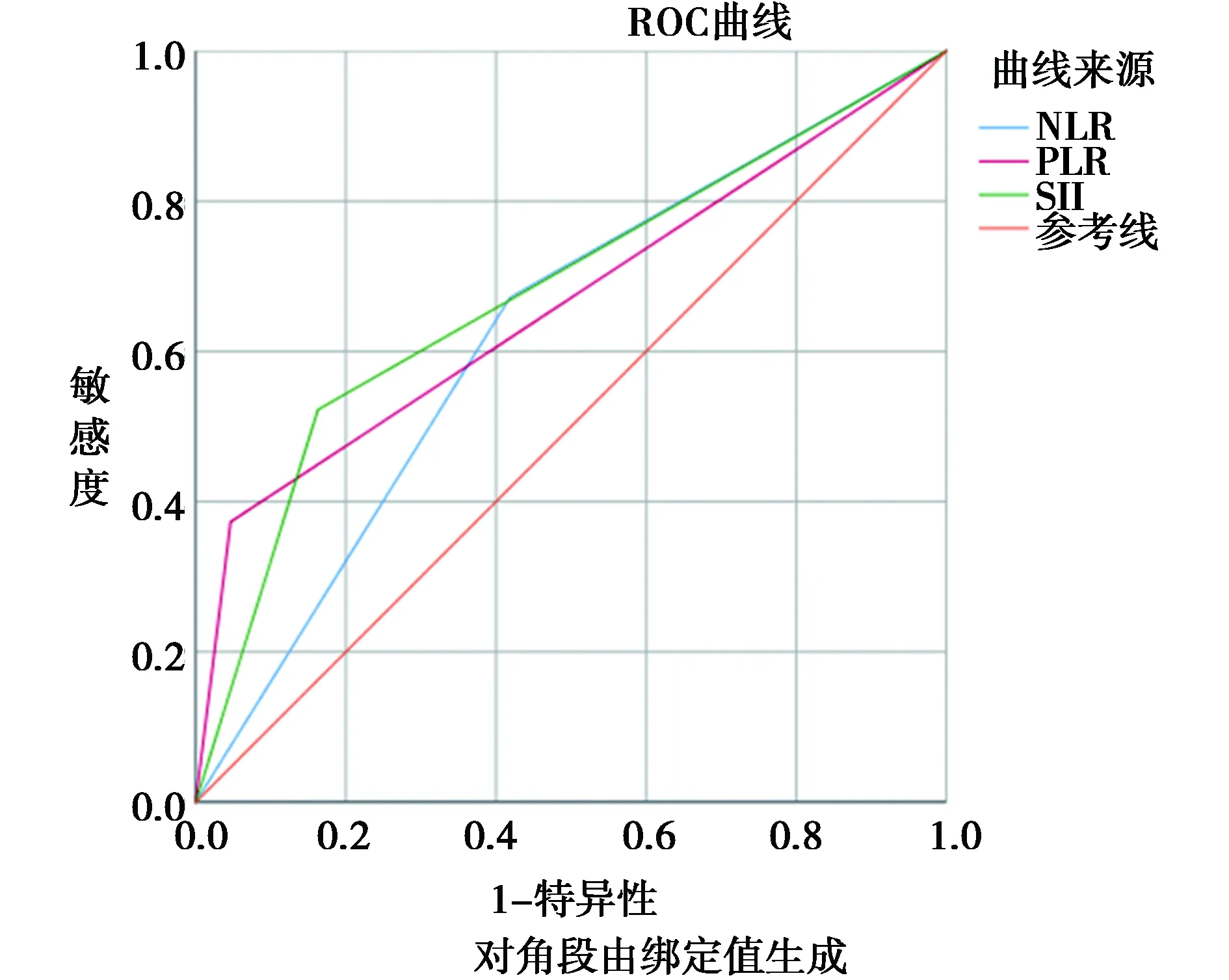
圖1 NLR、PLR及SII與OS相關的ROC曲線
2.3術前炎性指標與 NSCLC 患者臨床病理特征的相關性:表1中顯示了臨床病理參數與NLR、PLR和SII之間的相關性,術前NLR與性別相關(P<0.05);術前PLR與TNM分期相關(P<0.05);術前SII與TNM分期相關(P<0.05)。 未發現其他顯著差異。見表1。
2.4術前NLR、PLR及SII與預后的關系:NLR預測NSCLC患者預后的價值,低NLR組5年生存率為53.2%,高NLR組為28.6%,差異有統計學意義 (P<0.05);PLR預測NSCLC患者預后的價值,低PLR組5年生存率分別為54.2%,高PLR組為21.6%,差異有統計學意義(P=0.001);SII預測NSCLC患者預后的價值,低SII組5年生存率為52.9%,高SII組為16.7%,差異有統計學意義(P=0.001)。TNM分期預測NSCLC患者預后的價值,Ⅰ期5年生存率為55.8%,Ⅱ期5年生存率為38.2%,Ⅲ期5年生存率為18.2%,差異有統計學意義(P=0.001)。見表2。
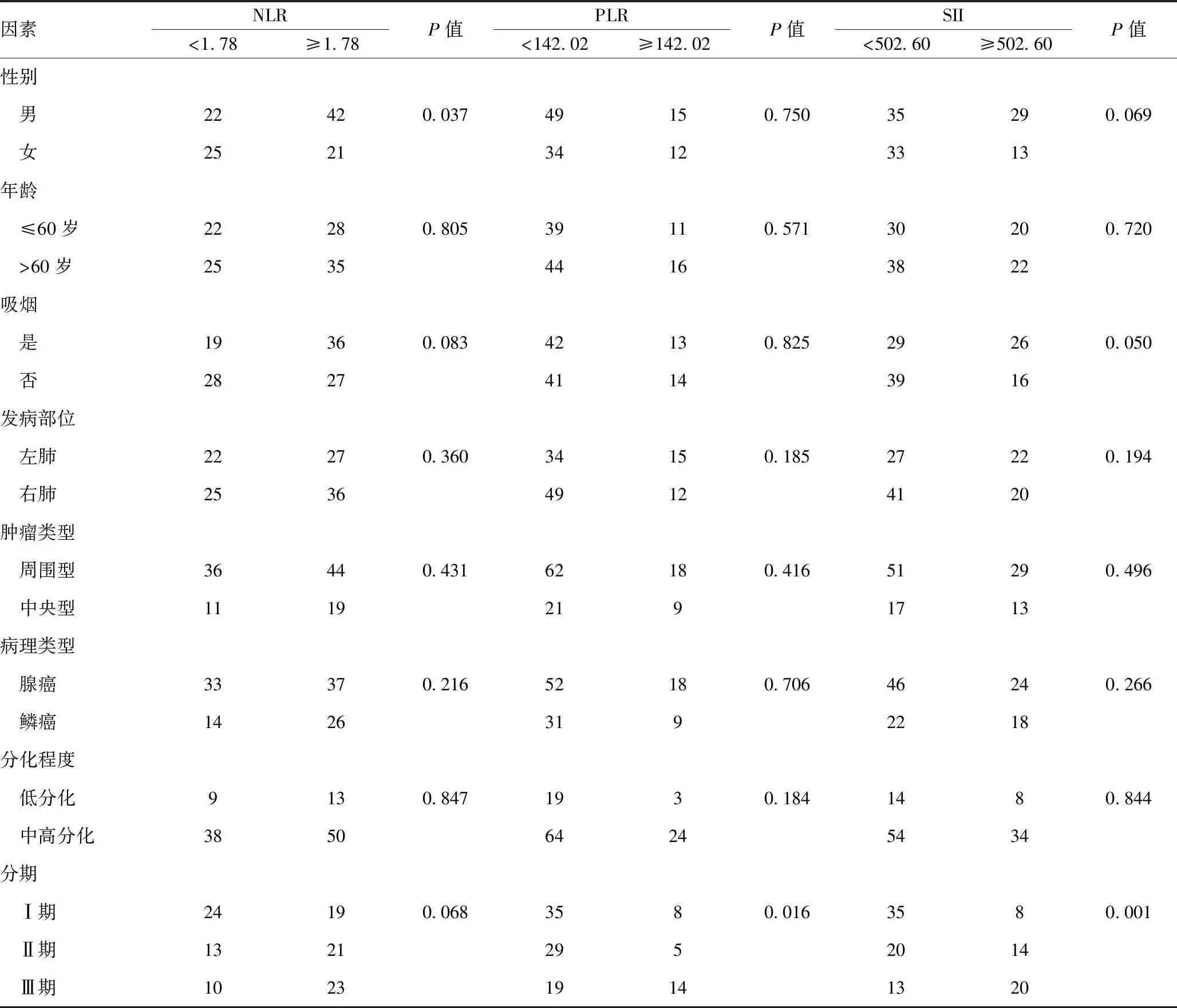
表1 術前NLR、PLR及SII與 NSCLC 患者臨床病理特征的相關性
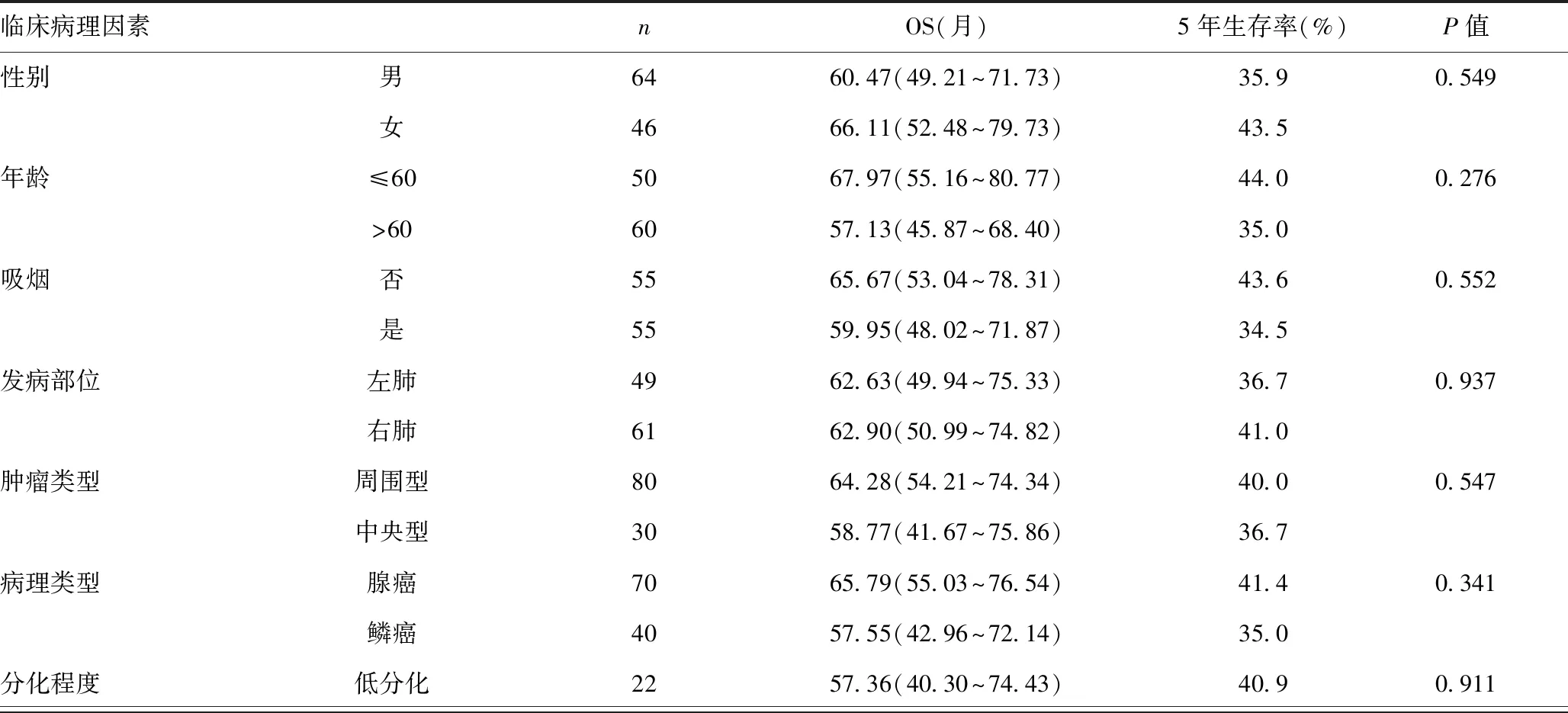
表2 110例NSCLC患者手術切除后的臨床和實驗室特征以及總生存期之間的關系
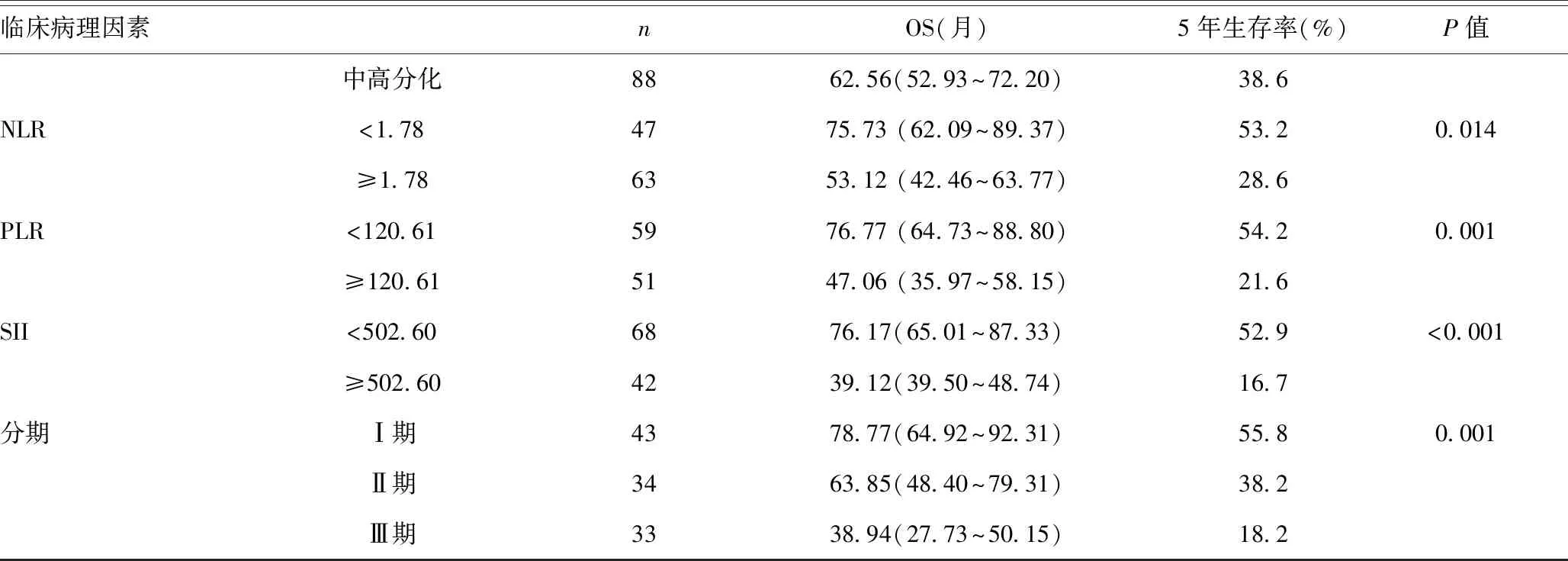
續表2 110例NSCLC患者手術切除后的臨床和實驗室特征以及總生存期之間的關系
2.5影響 NSCLC 患者預后的單因素及多因素分析:所有患者隨訪時間2~120個月,中位隨訪時間39個月,平均隨訪時間47.9個月,總體人群5年生存率為39.1% 。 單因素 Cox 分析顯示TNM分期、NLR、PLR以及SII與OS有關,P值分別為<0.001、0.017、 0.001、0.001(見表 4)。 將單因素分析中有意義的特征納入多因素分析,結果顯示,TNM 分期(HR:1.556,95%CI:1.137~2.128,P=0.006),SII(HR: 2.238,95%CI:1.358~3.689,P=0.002) 是影響OS的獨立危險因素。見表3、表4。
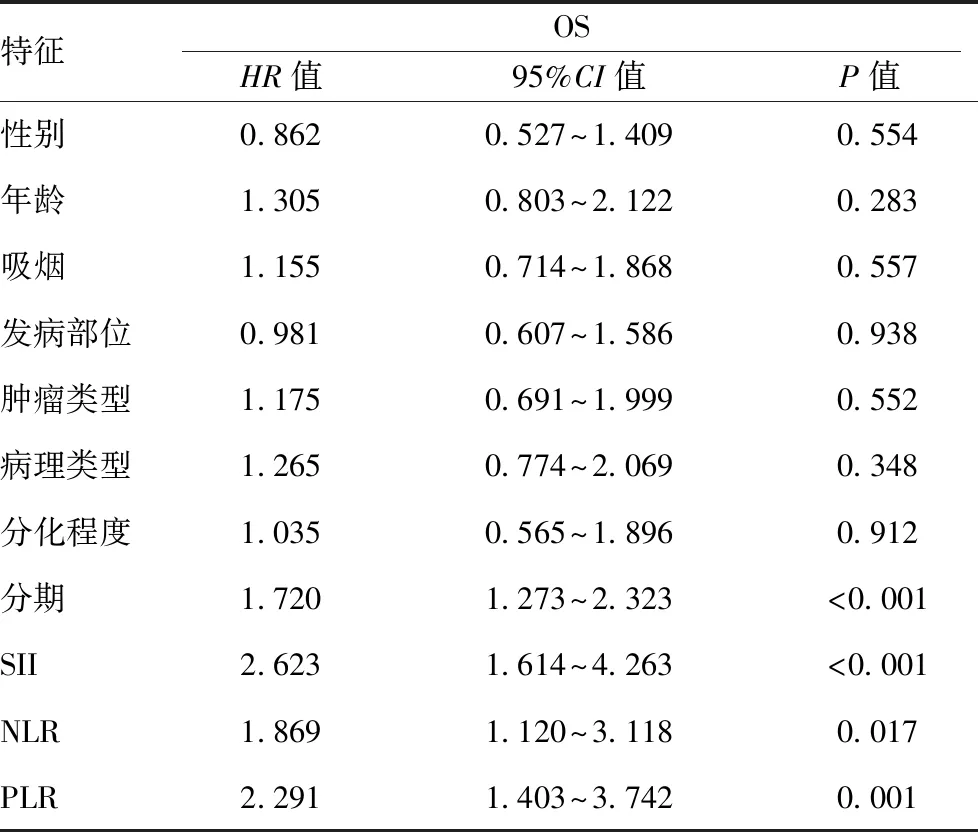
表3 影響非小細胞肺癌預后的單因素 Cox 回歸分析
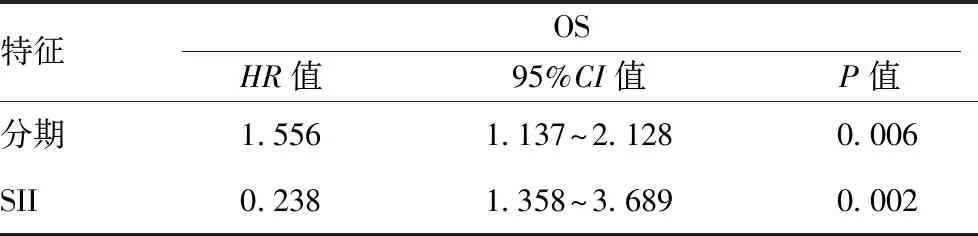
表4 影響非小細胞肺癌預后的多因素 Cox 回歸分析
2.6為了進一步評估基于全身炎性反應預后評分的預后值,進行了ROC分析,并比較了AUC值:見圖2。ROC曲線下面積可預測非小細胞肺癌患者術后的生存率。SII得分的AUC值(0.680;P=0.002)高于NLR、PLR和病理分期。見表5。
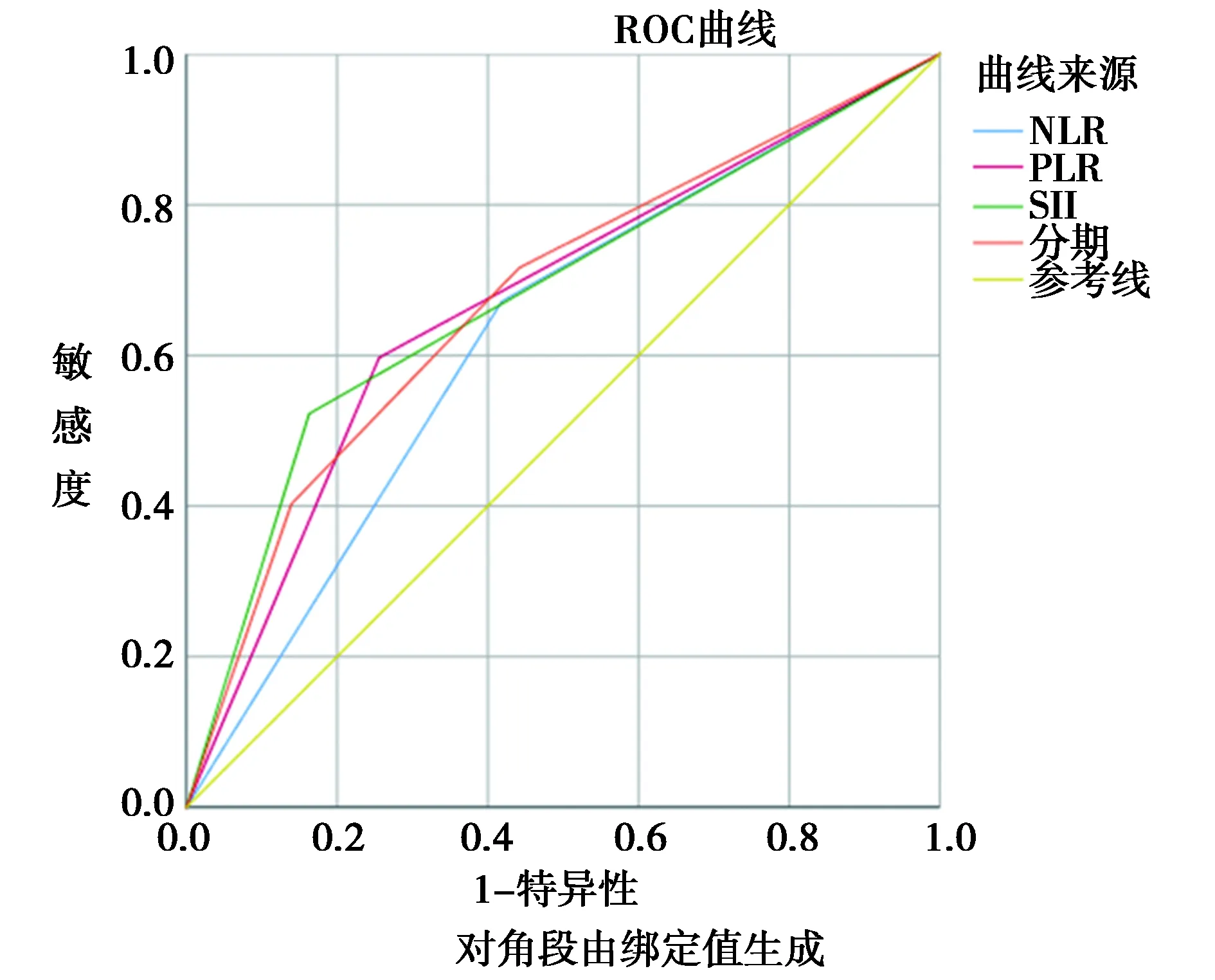
圖2 ROC曲線下面積可預測非小細胞肺癌患者術后的生存率
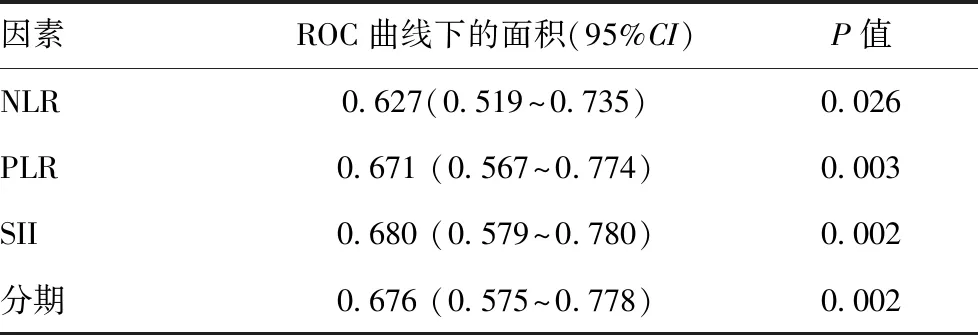
表5 基于四個因素的ROC曲線下方區域預后評分對110例術后總體生存率的預測
3 討論
在本研究結果中,NLR、PLR及SII的最佳截點分別為1.78、142.02和502.60,其曲線下面積分別為0.627、 0.663及0.680;術前NLR與性別相關(P<0.05);術前PLR與TNM分期相關(P<0.05);術前SII與TNM分期相關(P<0.05)。此外,通過單因素及多因素COX回歸分析顯示:術前SII是術前NSCLC患者OS的獨立預后生物標志物,SII的預后能力優于NLR和PLR。
近年來,越來越多的證據表明全身性炎性與癌癥的發展有關,炎性在癌變過程中起著多方面的作用,炎性促成癌變的可能機制如下:炎性是腫瘤發展的三個階段中不可或缺的組成部分: 起始、促進和進展。由組織損傷引起的炎性,通過刺激各種趨化因子和細胞因子的釋放,促進腫瘤的發生,這些趨化因子使血管系統允許炎性細胞和介質進入組織微環境。這些炎性介質可能導致氧化損傷,誘導DNA突變,以及微環境的其他變化,使其更有利于細胞轉化,提高細胞存活率和增殖[4]。
全身性炎性反應可誘發腫瘤行為,并與各種類型實體瘤患者的臨床預后不良相關。NLR及PLR作為新興的炎性標記物,在各種腫瘤預后中具備評價優勢[5-6]。然而,這兩種炎性指標僅整合兩種細胞類型,而SII是針對中性粒細胞、血小板和淋巴細胞,似乎是多種實體瘤的更強預后因素[7-8],包括非小細胞肺癌[9]。
中性粒細胞是炎性過程的重要成分,其被視為抵抗感染的第一道防線,占人體循環中所有白細胞的50%~70%。TANs是腫瘤內浸潤的中性粒細胞,在機體內腫瘤發生后,會產生相應的趨化因子,血液循環中的中性粒細胞則可被趨化因子吸引,透過血管壁進入腫瘤組織,從而形成TANs。TANs在腫瘤從惡性轉化到腫瘤進展、細胞外基質(ECM)修飾、血管生成、細胞遷移和免疫抑制等多個方面都有重要的作用[10];血小板是腫瘤發生發展中至關重要的因素,能夠促進原發灶和轉移灶腫瘤的生長。在原發灶,血小板被募集到腫瘤微環境中,直接與腫瘤細胞相互作用, 促進腫瘤細胞增殖,另外還間接釋放很多生長因子,包括促血管生成和促有絲分裂的蛋白。在轉移灶,血小板與腫瘤細胞相互作用形成癌栓,是腫瘤細胞發生轉移和遠端定位的關鍵[11];在炎性過程中,淋巴細胞先天免疫和適應性免疫應答中起非常重要的作用,并且可以通過抑制細胞增殖或遷移根除腫瘤細胞[12]。基于以上信息,有較高的SII可能與腫瘤血管生成,侵入和轉移相關,從而導致較差的存活。因此,SII升高與癌癥患者的不良生存相關。
綜上所述,SII是手術切除的NSCLC患者的獨立預后指標,SII顯示出比NLR和PLR更好的預后能力。但本研究是單中心回顧性研究,因此選擇偏倚是不可避免的。必須進行協作、多中心、前瞻性研究來確認本研究結果。

