攜P- SLex和TE單抗雙靶向超聲微泡的構建及高剪切力下靶向黏附能力的評價
朱正球,楊芳,陳苓珊,吳意贇,王銀萍,馬學慧,沈碧瀟,黃輝
(1.江蘇省中醫院,南京中醫藥大學附屬醫院 超聲醫學科,江蘇 南京 210029; 2.東南大學 生物科學與醫學工程學院,生物電子學國家重點實驗室,江蘇省生物材料與器件重點實驗室,江蘇 南京 210096;3.江蘇省中醫院,南京中醫藥大學附屬醫院 放射科,江蘇 南京 210029)
動脈粥樣硬化(atherosclerosis,AS)是心腦血管疾病的重要發病基礎。慢性炎癥貫穿于AS的發病全過程,其誘導的動脈管壁細胞外基質彈性蛋白的彈性生成(elastogenesis,EG)功能紊亂,是動脈結構重塑、彈性衰退及AS進展的重要機制。大量研究[1]證實,EG合成彈性蛋白的前體物質彈性蛋白原(tropoelastin,TE)在正常動脈細胞外基質中含量極低;然而當動脈EG功能紊亂時,TE可在細胞外基質中及內皮細胞表面大量蓄積。這一特征使得靶向TE的超聲微泡(microbubbles,MB)在理論上可實現活體狀態下實時評估動脈EG功能紊亂狀態。然而人體大動脈始終處于高速、高剪切力的血流狀態下,單靶向超聲微泡很難與動脈內皮細胞及其間隙細胞外基質上的靶分子實現有效結合。多聚唾液酸化路易斯X(polymeric sialyllewis X,P- SLex)是一種非抗體性的選擇素快速結合型配基,能與動脈內皮細胞表面的P- 選擇素快速但不牢固地結合[2]。這為TE緩慢結合型配基形成牢固結合提供了必不可少的時間窗與機會。本研究欲構建攜P- SLex和TE單抗的雙靶向超聲微泡,并體外驗證其在高剪切力下的靶向黏附能力。
1 材料與方法
1.1 P- SLex、TE雙靶向微泡的構建
按一定摩爾比取二棕櫚酰磷脂酰膽堿、磷脂酰乙醇胺和二硬脂酰磷脂酰乙醇胺生物素脂質(均為Avanti公司,美國)溶液,均勻混合后減壓旋轉蒸發除盡有機溶劑,在形成的脂質膜中加入磷酸鹽緩沖溶液(PBS),得脂質混懸液,再填充六氟化硫氣體(≥99.99%,安徽強源氣體有限公司),機械振蕩后加入親和素(Sigma- Aldrich公司,美國)混合,再分離純化后制備得到攜載生物素的空載微泡(MBC)。為制備靶向微泡,按照1×107個·ml-1微泡濃度加入3.0 μg的比例,分別加入P- SLex(GlycoNZ公司,新西蘭)、TE單克隆兔抗小鼠抗體(Bioss公司,中國)以及P- SLex∶TE抗體=1∶1的混合液體,均勻混合后離心分離取氣泡層樣品,即分別制備得到攜P- SLex的單靶向超聲微泡(MBP)、攜TE單抗的單靶向超聲微泡(MBT)以及攜P- SLex和TE單抗的雙靶向超聲微泡(MBPT)。
1.2 靶向微泡顯微表征、粒徑、Zeta電位和濃度檢測
將微泡溶液用PBS稀釋10倍后,取10 μl滴到載玻片上,采用熒光倒置顯微鏡(Nikon ECLIPSE TS100, 日本),在20倍物鏡下依次拍照觀察顯微表征(圖1)。取微泡溶液,使用PBS稀釋10倍后,取1.5 ml稀釋液加入到高靈敏度Zeta電位及粒度分析儀樣品池(Brookhaven 90Plus PALS,美國)中,測定其Zeta電位。在100 ml電解溶液中加入20 μl微泡分散液,使用顆粒細胞計數及粒度分析儀(Multisizer 4e,貝克曼公司,美國)測定其平均粒徑和微泡濃度。

圖1 MBC(A)、MBP(B)、MBT(C)和MBPT(D)的顯微光鏡表征
1.3 靶向微泡體外高剪切力靶向黏附能力評價
35 mm細胞培養皿用甲醇漂洗后干燥,再用PBS分別配備1 μg·ml-1的小鼠P- 選擇素Fc段溶液(R&D公司,美國)和小鼠TE抗原溶液(Sigma- Aldrich公司,美國),按1∶1比例混勻后,用移液器滴加 200 μl 在培養皿中央,4 ℃冰箱中放置12 h,用0.05%的PBS- 吐溫20溶液洗滌3遍,3%的Tris緩沖鹽溶液(TBS)-小牛血清白蛋白處理1 h,再用0.05%的PBS- 吐溫20溶液洗滌3遍后備用。
搭建好平行平板流動腔裝置(Glycotech31- 001,Circular Flow Chamber Kit Instructions,美國),分別在0.6、2.0、4.0 dyn·cm-2(1.0 dyn·cm-2=0.1 N·m-1)的剪切應力下注射微泡樣品(均約1×107個·ml-1),進行微泡結合實驗評價。微泡注射6 min期間,使用20倍物鏡進行視頻錄制(25幀·s-1)及定量分析(圖2)。

圖2 平行平板流動腔微泡結合實驗,注射微泡0(A)、2(B)、4(C)、6 min(D)的微泡結合情況
再使用生理鹽水沖洗平行流動板,清洗完靜止但未結合的微泡;從0.1 dyn·cm-2剪切力開始進行沖洗,每30 s增加1倍剪切力,至鏡下微泡完全解離或6 min 后達到409.6 dyn·cm-2,進行微泡解離實驗評價。沖洗過程使用顯微鏡(20倍物鏡)進行視頻錄制(25幀·s-1)(圖3),最后采用Image J軟件(NIH,美國)對視頻圖像進行微泡計數及定量分析。

圖3 平行平板流動腔微氣泡解離實驗,逐步增加剪切力下0(A)、2(B)、4(C)、6 min(D)的微泡解離情況
1.4 統計學處理
采用SPSS 22.0軟件對數據進行統計分析。計量資料以均值±標準差表示。不同剪切力下同一微泡類型組間比較及同一剪切下不同微泡類型組間差異比較均采用單因素方差分析,再利用析因分析分析不同微泡類型及不同剪切力兩因素之間是否存在交互效應,然后利用Bonferroni檢驗比較兩兩組間差異。P<0.05為差異具有統計學意義。
2 結 果
2.1 微泡基本物理特征評價
普通光學顯微鏡下本研究的生物素化脂質MB為透亮微氣泡(圖1),分布均勻,平均粒徑約為0.722 μm,平均濃度為3.89×109個·ml-1。制備的MBC、MBP、MBT及MBPT 4種微泡形態類似,平均粒徑為0.699~0.869 μm,Zeta電位為-11.37~-3.98 mV,微泡濃度為1.60×109~6.11×109個·ml-1(表1)。
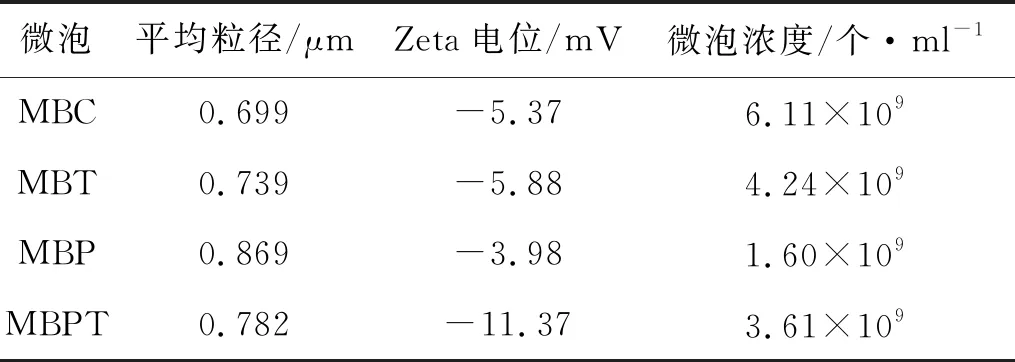
表1 MBC、MBP、MBT和MBPT的平均粒徑、Zeta電位及微泡濃度測定結果
2.2 微泡靶向黏附結合能力的體外評價
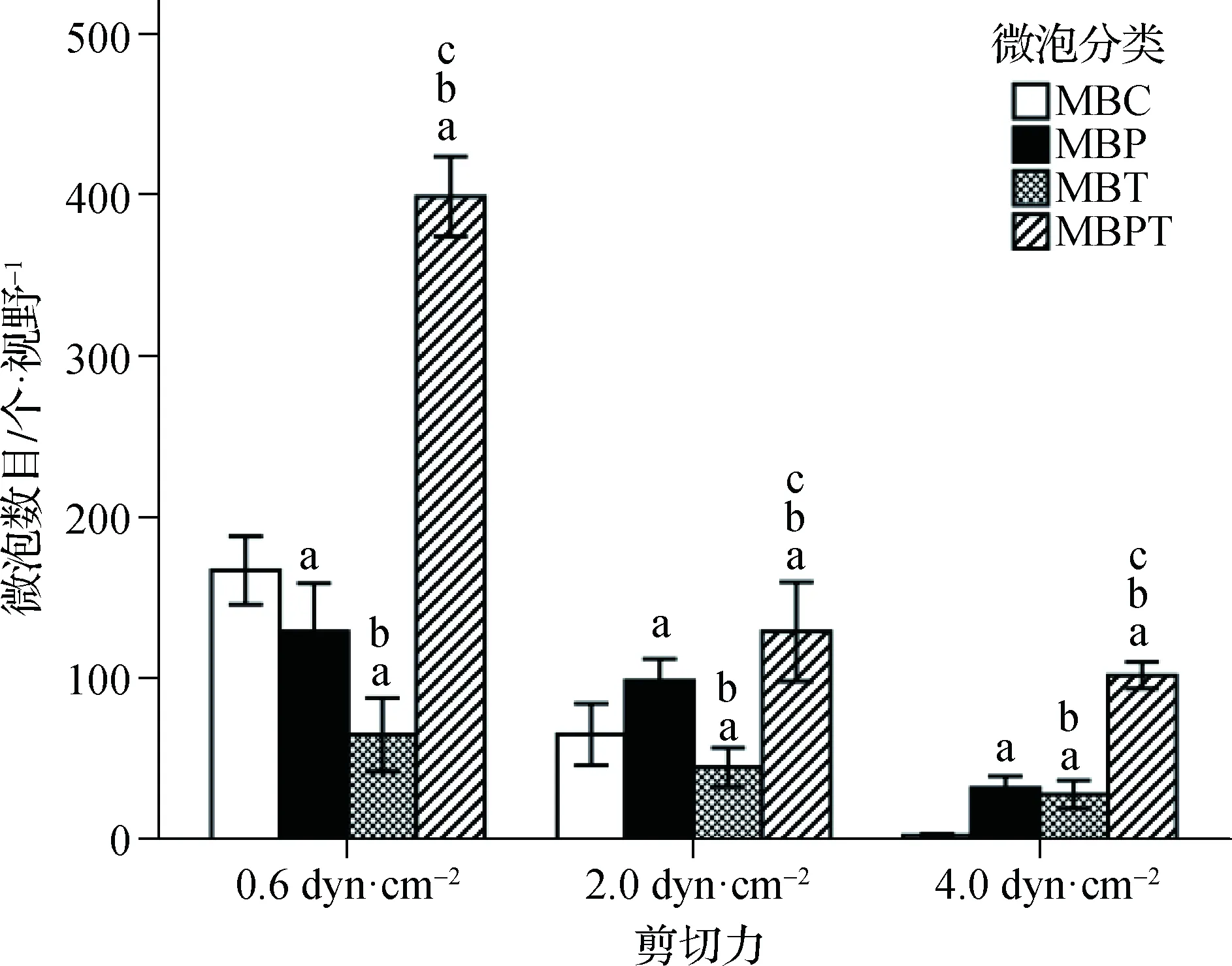
由低至高(0.6、2.0、4.0 dyn·cm-2)的3種剪切力作用下微泡的全程(6 min)結合數目MBPT分別是MBC的2.39、1.98及30.83倍,MBP的3.12、1.29及2.84倍,MBT的6.28、2.84及3.62倍(均P<0.001)(表2)。進一步組內兩兩比較證實,3種剪切力之間及4種微泡之間差異均有統計學意義(均P<0.001),且4種微泡結合數目均隨著剪切力的增高而顯著減少(均P<0.001)(圖4、5)。不同微泡類型及不同剪切力兩因素對微泡結合數目的影響存在交互效應(P<0.001)(表2)。
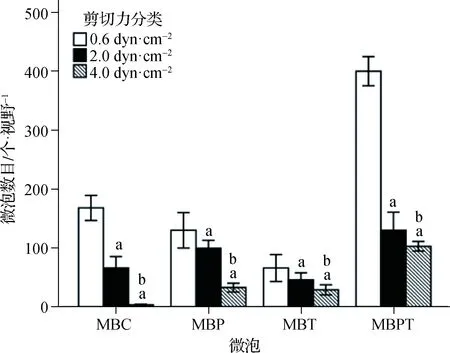
a與0.6 dyn·cm-2剪切力比較,P<0.001;b 與2.0 dyn·cm-2剪切力比較,P<0.001
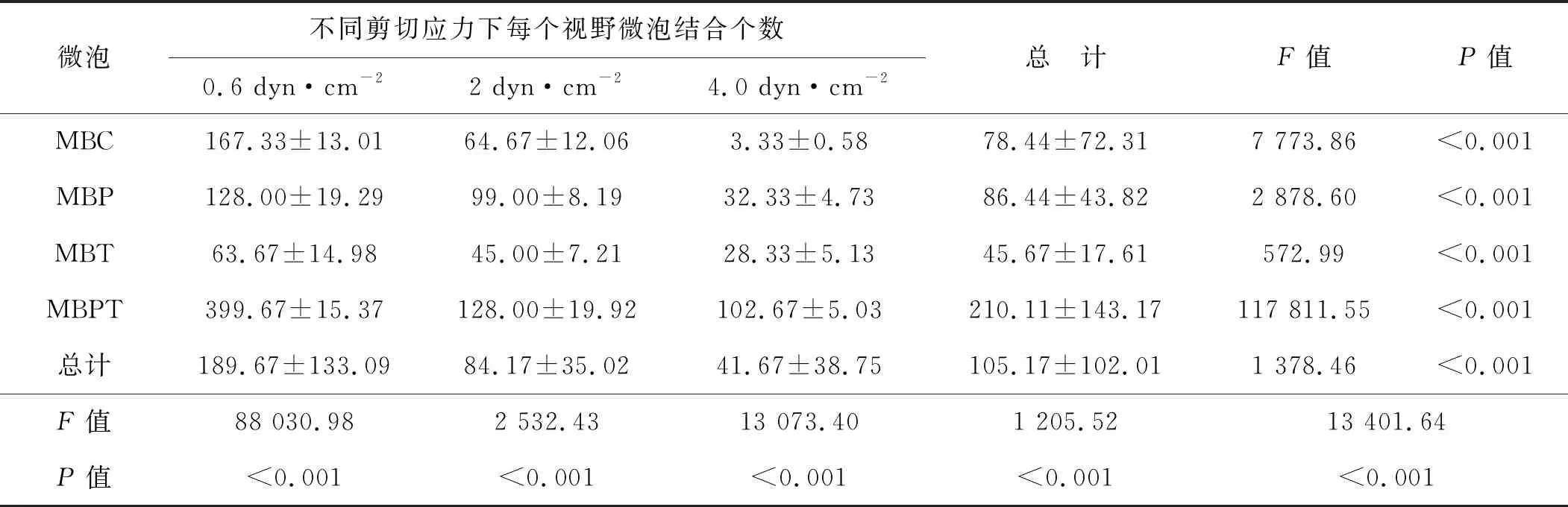
表2 不同剪切應力下的微泡結合數(6 min,n=3)
2.3 微泡靶向黏附解離能力的體外評價
在微泡解離實驗中,MBC、MBT、MBP及MBPT的半數解離剪切應力依次為(11.04±1.52)、(32.83±7.54)、(22.44±5.47)及(27.82±3.84)dyn·cm-2,4組間比較差異有統計學意義(P=0.004)。在(30.62±8.68)dyn·cm-2的剪切應力下,MBC即可達到完全解離,而MBT和MBP的完全解離剪切應力分別為(111.27±15.37)及(77.14±21.88)dyn·cm-2,MBPT則為(104.23±23.92)dyn·cm-2,4組間比較差異有統計學意義(P=0.003)。
a 與MBC比較,P<0.001;b 與MBP比較,P<0.001;c 與MBT比較,P<0.001
3 討 論
本研究利用TE的特異性單抗構建靶向超聲微泡用于超聲分子成像,有望實現精準化在體評估TE及EG功能紊亂狀態。我們的體外研究已證實,單靶向TE的MBT超聲微泡能與平行流動板的TE抗原有效結合,且其結合可較空載微泡MBC耐受更強的剪切力沖擊。然而,人體大血管始終處于高速、高剪切力的血流環境下,單靶向TE的超聲微泡很難與動脈內皮細胞及其間隙細胞外基質上的靶分子實現持續的有效結合,進而可能導致成像失敗[3]。本研究顯示,MBP的微泡結合總體數目顯著優于MBC及MBT,但其與MBC一樣不能很好地耐受4.0 dyn·cm-2高剪切力的沖擊;相反,盡管MBT能較好耐受4.0 dyn·cm-2剪切力的沖擊且擁有較高的半數及完全解離剪切力,但是其微泡在長達6 min的持續結合中的總體數目較MBP及MBC顯著減少。這說明,靶向微泡表面的TE抗體確實能與動脈管壁內皮細胞表面的TE形成較為牢固的結合,可以耐受高剪切力的持續沖擊。但若沒有P- SLex與P- 選擇素之間快速且較不牢固的結合所爭取的時間窗,其最終的結合數目仍然不盡如人意。這同時也說明,單靶向微泡MBT或MBP可能都很難勝任未來實現活體狀態下的大血管EG功能紊亂成像,聯合二者的優勢所構建的雙靶向超聲微泡MBPT可能才是解決問題的關鍵。
前已述及,慢性炎癥狀態在AS和心腦血管疾病的發生發展中扮演了核心機制的角色[4]。處在炎癥狀態的動脈管壁內皮細胞會在細胞膜表面高表達P- 選擇素,以便于白細胞通過P- 選擇素的相關受體與之快速結合并錨定在細胞表面,從而誘導管腔內的白細胞進入動脈管壁并發生慢性炎癥反應[5- 6]。正是利用這一特征,攜P- 選擇素的非抗體性配基P- SLex及TE單抗的雙靶向超聲微泡MBPT,本研究已證實其不僅可耐受4.0 dyn·cm-2的剪切力沖擊,還具有較高的半數解離剪切應力及完全解離剪切應力,特別是在高剪切力下結合數目分別為MBC的30.8倍、MBP的2.8倍及MBT的3.6倍。近期Ozawa等[7]已成功利用P- 選擇素配基及抗炎性分子單抗雙靶向微泡,在體外高剪切力下成功實現與靶分子的有效結合及體內的超聲分子成像。然而迄今為止,利用超聲分子成像技術在體評估動脈EG功能紊亂尚未見報道,故本研究所構建的雙靶向微泡MBPT有望在未來活體狀態的EG功能紊亂定量評估中發揮重要的可視化作用。
本研究具有一定的局限性,本研究為體外實驗,且平行平板流動腔設備所需剪切力為生理鹽水沖擊構建,與人體循環系統內環境存在一定的差異,故靶向微泡黏附能力在未來還需進一步動物實驗體內驗證。
總之,本研究利用P- SLex及TE單抗構建的雙靶向超聲微泡MBPT,在體外微泡結合及解離實驗中表現出區別于空載及單靶向微泡的黏附力和解離能力,能在較高剪切力下實現與靶分子的有效結合,有望在活體狀態下實現大動脈的超聲分子影像學成像并實時動態評估EG功能紊亂狀態。

