二甲雙胍通過FGFR4/MST1信號通路抑制皮膚瘢痕疙瘩成纖維細胞的上皮間質轉化
張永紅,李存濤,高明敏,張玉紅
(鄭州大學附屬鄭州中心醫院 皮膚科,河南 鄭州 450052)
瘢痕疙瘩是一種引起人體不適、機體功能受限以及心理障礙的皮膚疾病,瘢痕疙瘩內部常表現出缺血低氧特征[1- 3]。目前已證明上皮間質轉化(epithelial- mesenchymal transition, EMT)是參與瘢痕疙瘩形成和發展的關鍵細胞學改變[2- 3]。二甲雙胍(metformin, MET)是一種可以抑制腫瘤和糖尿病中EMT的關鍵藥物[4- 5];MET在體外也可抑制瘢痕疙瘩形成[6]。然而MET誘導抑制瘢痕疙瘩的完整機制仍然未知,因此本研究觀察MET對瘢痕疙瘩成纖維細胞(keloid fibroblasts,KFs)EMT的作用并探討其機制。
1 材料與方法
1.1 臨床樣本
瘢痕疙瘩標本及鄰近正常皮膚組織采集于我院皮膚科。4例瘢痕疙瘩患者均為黃種女性,年齡分別為26、31、32、35歲,瘢痕疙瘩位置均在耳垂。本研究中執行的所有程序均經我院醫學倫理委員會批準,所有受試者均簽署知情同意書。
KFs EMT的方法:在低氧培養箱中培養KFs以誘導EMT,KFs分為對照組和低氧組。用MET或其溶劑生理鹽水(生理鹽水組)低氧誘導KFs:在MET和低氧條件下用纖維母細胞生長因子受體4(fibroblast growth factor receptor 4,FGFR4)過表達載體(FGFR4overexpression vector,FGFR4- OE)或空載體(empty vector,EV)處理KFs或者在MET和低氧條件下用重組人(recombinant human,rh)巨噬細胞刺激1(macrophage stimulate 1,MST1)蛋白(rhMST1)處理KFs。
1.2 試劑與耗材
rhMST1(ab158921)購于美國Abcam公司。杜氏改良培養基(DMEM)和胎牛血清(10099- 141)購于美國Gibco公司。MET購于美國派普泰克公司。FGFR4- OE和空載體(empty vector, EV)購于上海GenePharma公司。Lipofectamine 2000試劑購于美國Invitrogen公司。細胞計數試劑盒- 8(CCK- 8)、PrimeScript RT反應混合物逆轉錄RNA試劑盒、Trizol試劑盒、SYBR Premix Ex Taq試劑盒購于上海碧云天公司。蛋白酶抑制劑的RIPA 緩沖液、聚偏二氟乙烯膜購于美國Sigma 公司。抗人FGFR4、E- 鈣黏蛋白、抗人波形蛋白、抗人MST1一抗購于美國Cell Signaling Technology公司。
1.3 細胞培養
原代人KFs根據文獻[6]報道進行分離。手術切除人瘢痕疙瘩組織的表皮和脂肪組織,只保留纖維組織的真皮層,隨后切成小塊。組織小塊在包含1倍膠原酶裂解緩沖液的DMEM中消化2 h,4 ℃下1 500 r·min-1離心5 min后,收集沉淀物并在補充有1%的青霉素-鏈霉素和15%胎牛血清的DMEM(37 ℃、5%CO2)中培養。
1.4 細胞活力檢測
CCK- 8實驗用于測量細胞活力。將KFs(每孔1×104個)接種到96孔板中。分別在常氧下(設為對照組)和低氧培養箱(37 ℃、1%O2、5%CO2、94%N2)中培養,低氧培養箱中細胞再分為生理鹽水組和MET組兩組。對照組細胞培養24 h,低氧培養的兩組分別加生理鹽水24 h或10 mmol·L-1MET處理細胞 24 h后,每孔加入10 μl CCK- 8,37 ℃孵育2 h。使用酶標儀在450 nm 處測量3組的吸光度值。
1.5 低氧培養條件下KFs細胞的處理與分組
根據制造商提供的說明,使用Lipofectamine 2000試劑將25 μmol·L-1的FGFR4- OE或25 μmol·L-1的EV轉入KFs細胞。將轉染的細胞培養24 h,并收集用于實時定量PCR(quantitative real- time PCR, qRT- PCR)和蛋白免疫印跡分析。
根據是否使用MET治療、聯合使用FGFR4過表達,或聯合使用rhMST1處理KFs,將KFs在低氧條件下進行實驗觀察。KFs在低氧條件下培養24 h,分為MET組、生理鹽水組、MET聯合FGFR4過表達載體轉染(MET+FGFR4- OE)組、MET聯合空載體(EV)(MET+EV)組、MET聯合rhMST1、MET+rhMST1組。MET在4 ℃下以10 mmol·L-1的濃度儲存。低氧培養環境下,MET組用10 mmol·L-1MET處理細胞24 h; 生理鹽水組用等體積的生理鹽水處理細胞24 h;MET+FGFR4- OE組在轉染25 μmol·L-1FGFR4- OE的同時用10 mol·L-1MET處理細胞24 h;MET+EV組在轉染25 μmol·L-1EV的同時用10 mmol·L-1MET處理細胞24 h,MET+rhMST1組用10 mmol·L-1MET和6 mmol·L-1rhMST1處理細胞24 h。
1.6 qRT- PCR
用Trizol試劑盒提取FGFR4- OE組和EV組KFs的總RNA。根據制造商提供的說明,使用PrimeScript RT反應混合物逆轉錄RNA。隨后的定量PCR在7500 qPCR系統中使用SYBR Premix Ex Taq試劑進行。具體引物如下:FGFR4:正向5′- GTGCTGCTGCTCGTGGTCCCTA- 3′,反向3′- GCTTCGCGTAGGACGAAGGTGTGTC- 5′;Twist- 1:正向5′- CATTCTCAAGAGGTCGTGCCA- 3′,反向5′- CAGGCCAGTTTGATCCCAGTA- 3;E- 鈣黏蛋白:正向5′- GCCCTGCCAATCCCGATGAAA- 3′,反向5′- GGGGTCAGTATCAGCCGCT- 3′;波形蛋白:正向5′- GCTTCAGAGAGAGGAAGCCGAAAA- 3′,反向5′- CCGTGAGGTCAGGCTTGGAAA- 3′;β- 肌動蛋白:正向5′- ACCGAGCGCGGCTACA- 3′,反向3′- CAGCCGTGGCCATCTCTT- 5′。根據制造商的協議,qPCR在總體積20 μl的反應混合物中進行,并按以下步驟進行擴增:95 ℃ 10 min,然后95 ℃ 15 s和60 ℃ 60 s循環40次。生物學重復為3。2-ΔΔCt方法用于計算,其中ΔCt=Ct目標基因-Ctβ- 肌動蛋白,ΔΔCt=ΔCt測定值-ΔCt校正值。
1.7 蛋白免疫印跡實驗
離心收集MET組、生理鹽水組、MET+FGFR4- OE組、MET+EV組、MET+rhMST1組的KFs,并用磷酸鹽緩沖液洗滌。細胞在含有蛋白酶抑制劑的RIPA緩沖液中裂解。裂解物通過十二烷基硫酸鈉- 聚丙烯酰胺凝膠電泳分離,隨后經電印跡轉移到聚偏二氟乙烯膜上。在用5%脫脂牛奶封閉后,將膜與一抗在4 ℃下孵育過夜。一抗包括抗人FGFR4、E- 鈣黏蛋白、抗人波形蛋白、抗人MST1和β- 肌動蛋白。然后將印跡與二抗在室溫下孵育 2 h。每個實驗重復3次。使用ECL系統(GE Healthcare)和Luminescent Image Analyzer LAS3000(富士膠片)將目標蛋白條帶顯色。用Imgae J軟件進行定量分析。
1.8 遷移小室法檢測細胞的遷移
收集對照MET組、生理鹽水組、MET+FGFR4- OE組、MET+EV組、MET+rhMST1組細胞,調整細胞為105個·ml-1,加入到的transwell小室的上室。溫育12 h 后,使用細胞用無菌棉簽小心除去膜上表面的細胞。最后將已經穿透侵入膜下表面的細胞用甲醇固定,用10%的Gimsa染色溶液染色15 min,并在顯微鏡下進行細胞計數。
1.9 統計學處理
采用SPSS 20.0統計軟件進行統計學處理。計量數據以均值±標準差表示,正態分布且方差齊性的數據采用單因素方差分析,組間兩兩比較采用LSD檢驗;方差不齊的數據采用Dunnett’s T3檢驗。P<0.05為差異具有統計學意義。非正態分布的數據采用非參數檢驗。
2 結 果
2.1 二甲雙胍抑制低氧誘導下KFs的增殖活性
檢測MET對低氧環境中KFs增殖活力的影響,結果(圖1)顯示,低氧誘導下KFs的增殖率明顯高于對照組(P<0.05)。而低氧下加入10 mmol·L-1的MET處理24 h后,與生理鹽水組相比,MET組KFs的增殖率明顯降低(P<0.05)。
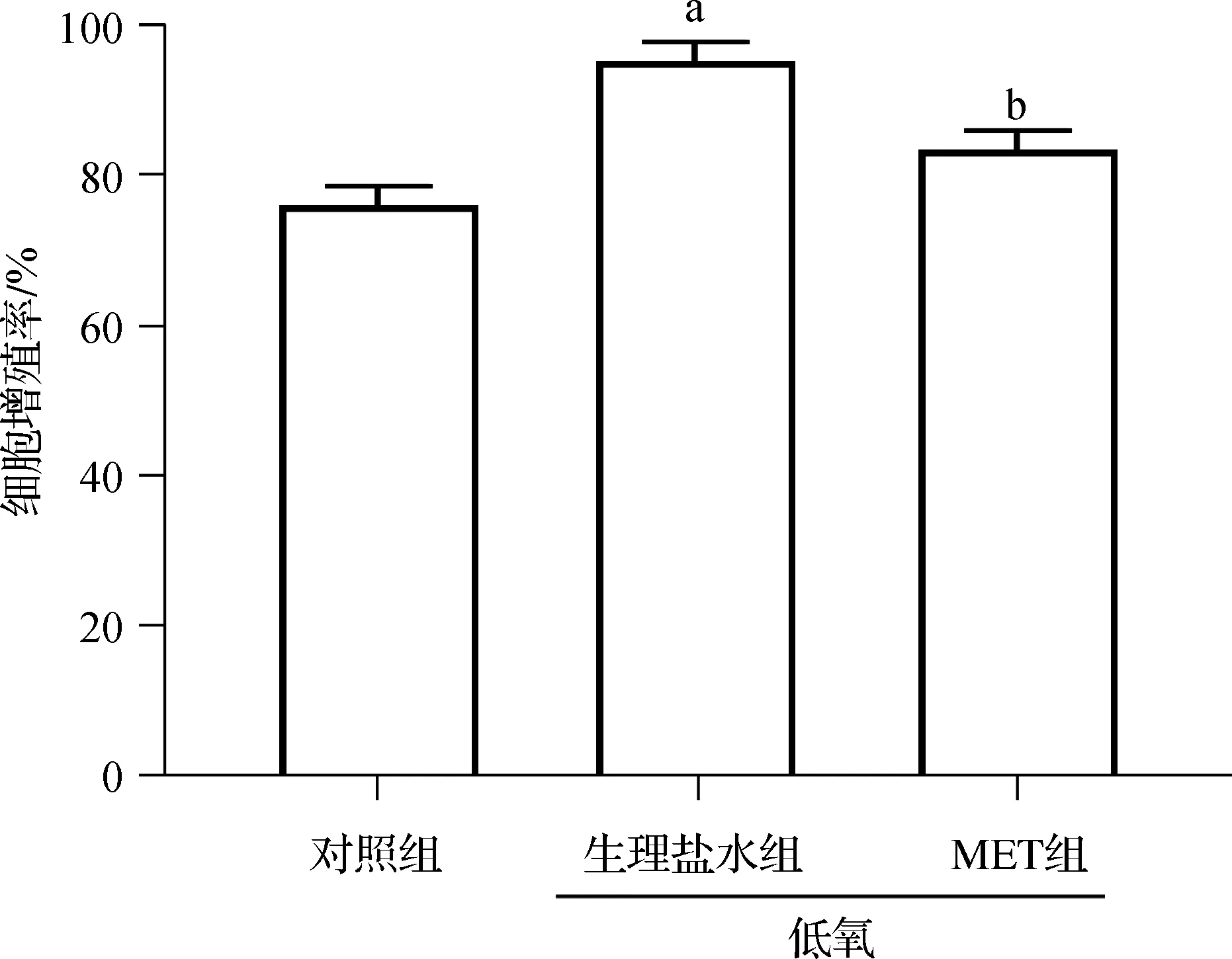
a與對照組比,P<0.05; b 與生理鹽水組比,P<0.05
2.2 MET抑制低氧誘導下KFs的遷移
進一步評估MET對低氧環境中KFs遷移能力的影響,結果如圖2所示,低氧下加入10 mmol·L-1的MET處理24 h后,與生理鹽水組比較,MET組KFs的遷移數目明顯減少(P<0.05)。

a 與生理鹽水組比較,P<0.05
2.3 MET調控KFs中EMT標志物和FGFR4/MST1信號蛋白的表達
通過蛋白免疫印跡法分析MET對FGFR4、MST1和EMT標志物Twist- 1、E- 鈣黏蛋白、波形蛋白的表達,結果如圖3。與生理鹽水組比,MET組中FGFR4、MST1、Twist- 1、波形蛋白的表達量明顯降低,而E- 鈣黏蛋白的表達明顯增加(P<0.05)。
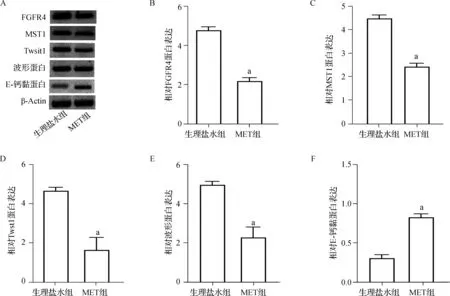
a 與生理鹽水組比較,P<0.05
2.4 FGFR4促進KFs中MST1的表達并誘導EMT
KFs細胞轉染FGFR4- OE或EV。與EV組比較,FGFR4- OE組FGFR4的mRNA和蛋白水平都增加(均P<0.05),并且MST1的表達顯著增加(均P<0.05)。FGFR4- OE組遷移細胞數和EMT標志物Twist- 1、波形蛋白的表達量均明顯增高,且E- 鈣黏蛋白的表達明顯降低(均P<0.05)。見圖4。
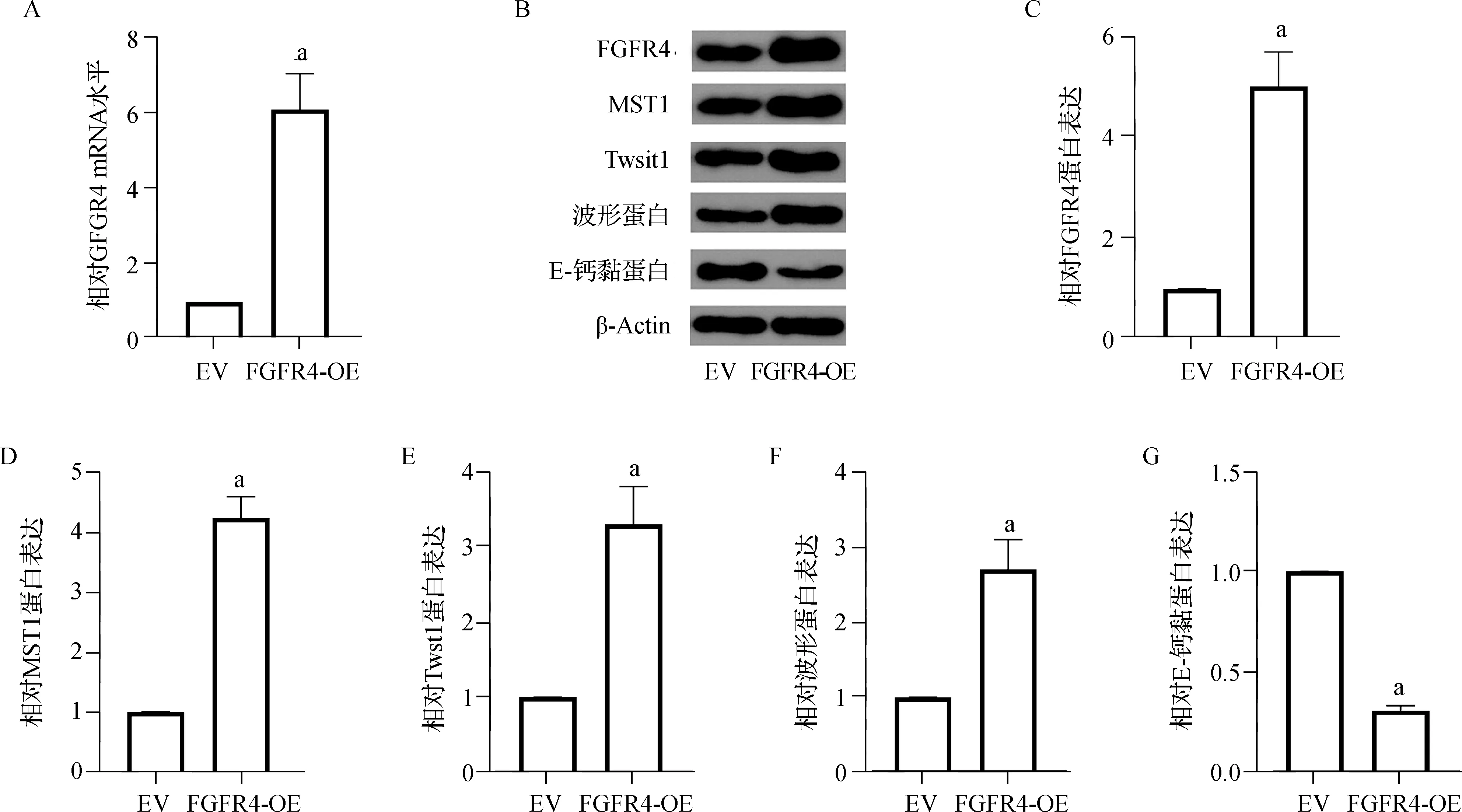
a 與EV組比較,P<0.05
2.5 MET通過抑制FGFR4/MST1通路抑制KFs的EMT
進一步研究MET影響瘢痕疙瘩EMT調控的機制,結果顯示:與MET+EV組比,MET+FGFR4- OE組中細胞的遷移細胞數和EMT標志物Twist- 1、波形蛋白的mRNA表達量均明顯增高,且E- 鈣黏蛋白明顯降低(均P<0.05);而與MET組比,MET+rhMST1組中遷移細胞數以及EMT標志物Twist- 1、波形蛋白的mRNA表達量都明顯增高,且E- 鈣黏蛋白明顯降低(均P<0.05)。見圖5。這表明MET可以抑制EMT,且其機制是通過抑制FGFR4/MST1通路抑制KFs的EMT。

a 與MET組比較,P<0.05; b 與MET+EV組比較,P<0.05
3 討 論
KFs是瘢痕疙瘩進展的主要誘導細胞。越來越多的研究認為KFs的EMT是誘導瘢痕疙瘩進展的關鍵因素[7],因此我們以KFs為研究對象,著重探討KFs在經MET處理后細胞增殖、遷移、EMT標志物的表達變化。根據本研究結果,我們發現:(1) 低氧誘導下KFs的增殖能力增加、遷移細胞數目增多,并且EMT標志物的表達明顯上調;(2) 抑制KFs中的FGFR4/MST1信號通路是MET抑制KFs增殖能力、遷移和EMT標志物表達的關鍵機制。本研究顯示MET可通過降低FGFR4和MST1來逆轉EMT,表明MET參與 FGFR4/MST1信號通路的失活以抑制瘢痕疙瘩的發展。
大量研究表明,FGFR4在促進上皮細胞的EMT和細胞遷移中起著關鍵作用[8- 9]。FGFR4通過EMT促進細胞纖維化[10- 11]。瘢痕疙瘩主要發生在外傷后,皮膚血管網絡被破壞,導致局部組織的低氧環境。此外,組織損傷引起的炎癥和修復過程中的高代謝狀態會顯著增加耗氧量并加劇低氧[12]。因為低氧微環境下,瘢痕疙瘩中的FGFR4往往上調,而且配體FGF23/FGFR4信號明顯促進心肌細胞的EMT和遷移能力[13- 14]。我們的研究結果證明,FGFR4過表達可以明顯促進KFs的EMT和遷移能力,而MET可以通過抑制FGFR4表達阻礙KFs的EMT和遷移。
MST1是哺乳動物腫瘤抑制通路的核心激酶,新發現的證據亦支持MST1在許多人類疾病如肝臟和腸道再生、先天免疫疾病[15- 16]中發揮微妙而復雜的作用。有研究表明MST1可調控細胞EMT[17- 18]。本研究也觀察到,人重組MST1蛋白能抑制KFs的遷移和EMT標志物Twist- 1、波形蛋白的表達,并促進E- 鈣黏蛋白的表達。多項研究表明,MST1是FGFR4特異性底物,而且MST1是FGFR4相關信號通路的關鍵下游效應因子[19]。本研究在KFs中過表達了FGFR4,同樣觀察到MST1的蛋白表達被FGFR4顯著上調。不僅如此,低氧誘導下,在FGFR4表達增高的同時,MST1表達也增高。本研究中我們觀察到FGFR4/MST1信號軸對低氧誘導下KFs的EMT至關重要,因為過表達FGFR4不僅促進了MST1的表達,同時逆轉了MET對低氧條件下EMT的抑制作用,而人重組MST1蛋白明顯促進KFs的遷移和EMT標志物的表達。我們的研究結果表明FGFR4/MST1信號參與了瘢痕疙瘩的EMT。
MET已被證實還可以發揮抗瘢痕疙瘩的作用[6]。本研究同樣觀察到MET對KFs增殖和遷移的抑制作用,而且MET可以通過抑制FGFR4/MST1信號通路逆轉KFs中低氧誘導的EMT。
綜上所述,本研究表明,低氧環境通過激活FGFR4誘導的EMT促進了KFs的遷移,MET通過FGFR4/MST1信號通路抑制KFs中低氧誘導的EMT。基于上述研究數據,我們提出FGFR4/MST1通路參與低氧誘導的瘢痕疙瘩EMT,因此MET可能是治療瘢痕疙瘩的潛在藥物,而且FGFR4/MST1信號通路是一種潛在的瘢痕疙瘩治療靶點。

