乙酰水楊酸對綿羊精子常溫保存的影響
陳潔梅
(安徽農業大學 230031)
相比低溫保存而言,精子的常溫保存操作簡便,成本低廉,便于短期運輸,可以有效提高養殖效益,是一種簡單易學的保種方法。在精子保存過程中,精子質膜易受到外部環境的影響,致使質膜結構和理化特性發生改變,使精子活力顯著下降或喪失。
乙酰水楊酸 (Acetylsalicylic acid,ASA), 又稱阿司匹林 (Aspirin),為一種白色結晶或結晶性粉末,無臭或微帶醋酸臭,微溶于水,為水楊酸衍生物,醫學領域用于抗炎、鎮痛、解熱,預防心臟病發作和中風[1],誘導各種癌細胞凋亡[2],作為常用的細胞質膜保護劑,在治療人的矽肺病和風濕性關節炎中廣泛應用,簡稱ASA[3~5]。在精子保存過程中尚未有相關研究。在本次試驗中,以綿羊精子為觀察對象,通過檢測質膜完整性(Membrane integrity,MI)和頂體完整性 (Acrosome integrity ,AI),探討在常溫條件下ASA對綿羊精子活力,質膜和頂體的保護作用。
1 試驗材料及方法
1.1 試驗材料
1.1.1 試驗動物
從安徽農業大學江淮分水嶺試驗站選取7只精液品質優良、行為活躍,年齡為2歲的杜泊羊作為采精對象。試驗公羊采用全舍飼單獨飼養,配有運動場。使用全株青貯甜高粱作為日糧,同時每天補飼適量苜蓿和雞蛋,稻草自由采食、飲水。采精頻率為每兩天1次,采精時間均選在下午飼喂之前,采精后放牧,增加運動量。
1.1.2 試驗試劑
Tris(Solarbio, Cat.No.T8060); D-果糖 (源葉生物,J31M9R62568); 檸檬酸-水物 (源葉生物,J12A9R58108); 青霉素鈉 (源葉生物,W25/9H59574);鏈霉素硫酸鹽 (源葉生物,H23A9Z68568);D(+)-無水葡萄糖 (源葉生物,Z23A9X68427);PBS磷酸緩沖液 (源葉生物,L11S9G69902);檸檬酸三鈉 (國藥集團化學試劑有限公司,6132-04-3) (源葉生物,);戊二醛固定液 (2.5%) (源葉生物,L08S9G699 05);甲醛溶液 (上海振企化學試劑有限公司,XK13-201-00395);吉姆薩染色液 (源葉生物,L08S9G69895)。
1.1.3 試驗器材
數顯不銹鋼電熱板 (金壇市晶玻實驗儀器廠,DB-2);生物顯微鏡 (Nikon,JAPAN,Y-T TV); 顯微鏡熱臺 (Gold Cyto,85-240VAC); 微型計算機 (HP,1HM21AV); 精子成像系統 (BASLER,acA780-75gc);潔凈工作臺 (上海博迅,Boxun);數顯恒溫水浴鍋 (常州普天儀器,HH-S6);低速離心機 (安徽中科中佳,SC-3614);精子活力測定軟件 (SPERM CLASS ANALYZER,SCA); 顯微鏡成像裝置 (OPLENIC,PSC600-05C); 計數及拍照軟件 (OPLENIC-CAMERA)。
1.2 試驗方法
1.2.1 試劑配制及分組
將1.449g D-果糖、1.725g D (+)-無水葡萄糖、4.0595g Tris、1.978g檸檬酸-水物、115.000IU青霉素鈉和115.000IU鏈霉素硫酸鹽倒入雙蒸水 (高壓過的蒸餾水)攪拌至溶解,定容至100ml。置于4℃冰箱保存、備用,此液可長期保存。
將精液稀釋液分為 4組 (n=3): Control組 (0mm/L)、 A1組 (20mm/L)、 A2 組 (50mm/L)和 A1 組 (100mm/L)。
1.2.2 精液保存程序
結合傳統的一步稀釋法和兩步稀釋法,在精液中先將一半稀釋液注入精液后,用移液槍槍頭將精液和稀釋液混勻,使精子均勻地分布于稀釋液中,再將另一部分稀釋液注入精液,以此降低大量稀釋液注入精液導致的副作用,最終比例為1:8,將稀釋好的精液分裝為待檢次數的2倍,用封口膜封口,防止進水,放入20℃恒溫水浴鍋避光保存,0、6、24、48、72、96h時分別進行檢測。
1.2.3 精子活力檢測方法
將待檢精液置于38℃數顯不銹鋼電熱板上預熱5min,取3μl精液滴于提前預熱好的載玻片上,蓋上蓋玻片,放于37℃的顯微鏡熱臺上,利用SCA軟件在顯微鏡下檢測精子的活力。每次檢測至少取兩份精液進行檢測,記錄精液活力及參數的平均值,每份精液的活力需在3個不同視野中進行軟件統計,取均值作為結果。
精子活力=快速前向運動 (a級)+慢速前向運動 (b級)
1.2.4 質膜完整率檢測
低滲腫脹試驗 (HOST)檢測精子的MI,用838mg的檸檬酸三鈉和1.38g果糖溶在100ml雙蒸水中,150mOsm的滲透壓檢測效果最好。
分裝HOST放于37℃恒溫熱水浴鍋5min以上,在300μl的HOST液中注入50μl的精液,用移液槍將HOST液與精液輕輕混勻,封口膜封口,然后將HOST液與精液的混合液放于37℃恒溫熱水浴鍋中預熱,60min后取10μl混合液滴于載玻片抹片,風干,2.5%戊二醛固定15min,用純水沖洗,風干,在40×的顯微鏡下,利用OPLENIC-CAMERA軟件在計算機屏幕上隨機計數100個精子。
計數標準:尾尖膨出、主片彎曲自折或尾尖卷曲的精子為質膜完整的精子;而精子依舊為直尾,沒有任何彎曲特征的精子被視為質膜功能受損的精子。
MI/%=彎曲精子數/精子總數×100
1.2.5 頂體完整率檢測
吸取10μl待檢精液,滴于載玻片抹片,待其風干后,用1ml 4%的甲醛固定液布滿整個玻片,靜止固定15min,用純水洗去4%甲醛,自然風干。吸取約0.8ml吉姆薩染色液,使之均勻地分布于整個抹片。90min后用純水沖洗,自然風干。利用40×的光學顯微鏡,投影在電腦上利用OPLENIC-CAMERA軟件隨機計數100個精子。
計數標準:正常精子頂體的特征為:頂體較為完整,完整著色,頂體不完整的精子特征為:頭部缺陷 (微觀和宏觀的頭部缺陷、頭部斷裂、梨形頭)、中片異常、近端、遠端、附件、尾部異常 (尾巴纏繞頭部,尾巴中間彎曲、雙尾)。
AI/%=頂體完整精子數/精子總數×100
1.3 數據分析
結果均用 “平均值 (mean)±標準差”表示。單因素分析確定差異顯著性。使用組間兩兩比較確定組間差異顯著性,<0.05表示差異顯著。
2 試驗結果
2.1 乙酰水楊酸對精子活力的影響
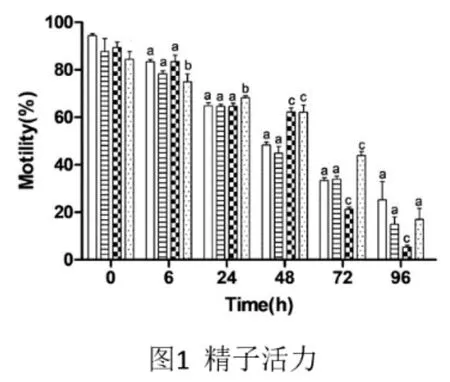
由圖1可知,48h時A2組的精子活力極顯著高于對照組,72h時A3組的精子活力極顯著高于對照組。這說明50 mM的ASA有利于48h內的精子常溫保存,100mM的ASA更有利于72h內的常溫保存。
2.2 乙酰水楊酸對精子質膜完整性的影響
由圖2所示,48h時,A3組的MI顯著高于對照組 (45.8±4.32%vs40.4±5.03%, <0.05); 在精子保存后期,A3組MI較對照組高,進一步說明ASA對精子質膜的保護作用。

2.3 乙酰水楊酸對精子頂體完整性的影響
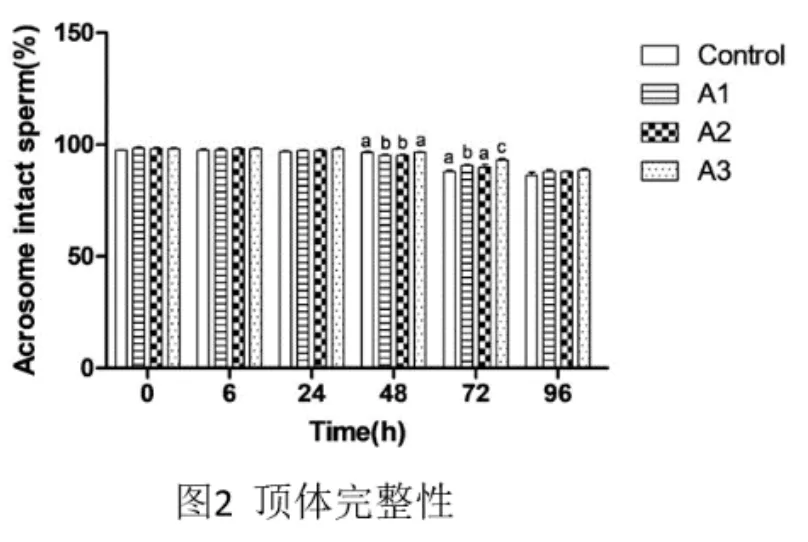
由圖3可知,48h時,A1和A2組的AI顯著高于對照組(95.2±0.84%、 95.2±0.84%vs 96.4±1.14%, <0.05); 72h 時, 添加 100mM的 A3組極顯著高于對照組 (93±1.41%vs 87.8±1.3%, <0.01)。說明在精子長期保存中,添加了100mM的ASA更有利于保護精子頂體。
3 討論
精子常溫保存除了對營養物質的需要,更需要保護精子質膜和頂體的完整性,這是延長精子壽命的必備條件。精子質膜和頂體是影響精子整體質量的重要因素,包括精子活力[6]。
從試驗結果可以看出,加入50mM的ASA有利于精子48h內的保存,而加入100mM的ASA更有利于72h內的精子保存,但生產上,常溫保存一般不會達到72h,再者,適量的ASA對細胞有保護作用,而過量的ASA對細胞有毒害作用[7]。研究發現,過量的ASA對雄性動物生殖器官有損害作用[8~10],所以,在稀釋液中加入50mM的ASA為最佳選擇。

