系統免疫炎癥指數與新輔助化療乳腺癌預后的相關性分析
魏宇昕,關勝男,姜 麗
乳腺癌是女性發病率最高的惡性腫瘤,2018年新增乳腺癌210萬例,且近年來其發病率呈增高趨勢,嚴重影響女性身心健康[1-2]。隨著輔助化療、靶向治療的應用,乳腺癌患者預后得到一定程度的改善,但其病死率特別是晚期乳腺癌患者的病死率仍處在較高水平[3]。因此,早期預測乳腺癌患者的預后情況,并及時采用個體化干預,可能有助于改善其預后。近年來,炎癥反應在腫瘤發生及預后評估中的作用逐漸得到重視。如中性粒細胞與淋巴細胞比值(NLR)與食管癌、宮頸癌、淋巴瘤患者的預后關系密切[4-6]。但NLR僅反映炎癥狀況,指標較單一,在腫瘤預后評估中的作用有限。系統免疫炎癥指數(SII)可同時反映免疫狀況和炎癥反應水平,在胰腺導管腺癌總生存期(OS)、小細胞肺癌腦轉移的預測中有較高的準確性[7-8],但其與乳腺癌預后的關系研究較少。本研究探討SII對新輔助化療乳腺癌患者病理完全緩解(pCR)的預測作用及對預后影響,內容報告如下。
1 資料與方法
1.1一般資料 回顧性分析2015年2月—2020年2月我院378例行新輔助化療乳腺癌的臨床資料。均為女性,年齡(50.76±10.34)歲;臨床分期Ⅰ期33例,Ⅱ期258例,Ⅲ期65例,Ⅳ期22例;人表皮生長因子受體-2(HER-2)陽性148例,雌激素受體(ER)/孕激素受體(PR)陽性236例,Ki-67表達>14%者255例。①納入標準:均行手術切除,且術前經穿刺活檢證實為原發性乳腺浸潤性導管癌;具有新輔助化療指征[9],術前均行新輔助化療;治療結果完整者。②排除標準:化療前進行內分泌治療、放療者;合并其他腫瘤者;患有血液系統、免疫系統疾病者;近期使用免疫抑制劑者;近期急性感染者。
1.2方法
1.2.1化療前資料收集:通過電子病歷系統收集患者年齡、白蛋白、血紅蛋白、中性粒細胞、淋巴細胞、血小板、臨床分期、脈管癌栓等臨床和病理資料。其中,臨床分期的判斷依據美國癌癥聯合委員會發布的第8版乳腺癌分期系統。SII=中性粒細胞×血小板/淋巴細胞。
1.2.2新輔助化療方案:患者均行新輔助化療,其方案根據免疫組織化學、患者及家屬意愿進行選擇。應用TEC方案96例,EC-T方案102例,AC方案85例,TAC方案58例,AC-T方案37例,具體用藥劑量參照《中國乳腺癌新輔助治療專家共識(2019年版)》[9]。新輔助化療以每21天為1個周期,至少完成4個周期。
1.3療效判定 患者每化療2個周期行乳腺彩超及鉬靶X線檢查,應用RECIST 1.1標準評估病灶變化,然后進行手術切除及術后相應治療(根據術后組織病理結果)。pCR為手術切除后組織病理未見惡性腫瘤證據,或僅存原位癌成分[10]。隨訪(每3個月隨訪1次,末次隨訪時間為2020年12月31日)并記錄患者OS。
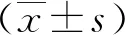
2 結果
2.1新輔助化療療效 378例乳腺癌中,經新輔助化療后共72例獲得pCR,pCR率為19.05%。
2.2NLR和SII預測pCR的效能分析 ROC曲線分析顯示,新輔助化療前NLR預測乳腺癌患者獲得pCR的曲線下面積(AUC)為0.760(95%CI:0.677,0.843;P<0.001),最佳截斷值為2.35。SII預測乳腺癌患者獲得pCR的AUC為0.831(95%CI:0.777,0.884;P<0.001),最佳截斷值為658.27。NLR預測乳腺癌患者獲得pCR的AUC低于SII(P<0.01)。見圖1。
圖1 NLR和SII預測乳腺癌患者獲得pCR的ROC曲線
2.3不同SII水平乳腺癌患者臨床資料比較 以SII的最佳截斷值658.27為界將患者分為高SII組(>658.27)292例和低SII組(≤658.27)86例。高SII組OS、生存率、年齡、白蛋白水平均低于低SII組,NLR水平、臨床分期Ⅲ~Ⅳ期、有脈管瘤栓、Ki-67表達>14%比率高于低SII組(P<0.05,P<0.01)。兩組血紅蛋白水平、ER/PR和HER-2表達比較差異無統計學意義(P>0.05)。見表1和圖2。
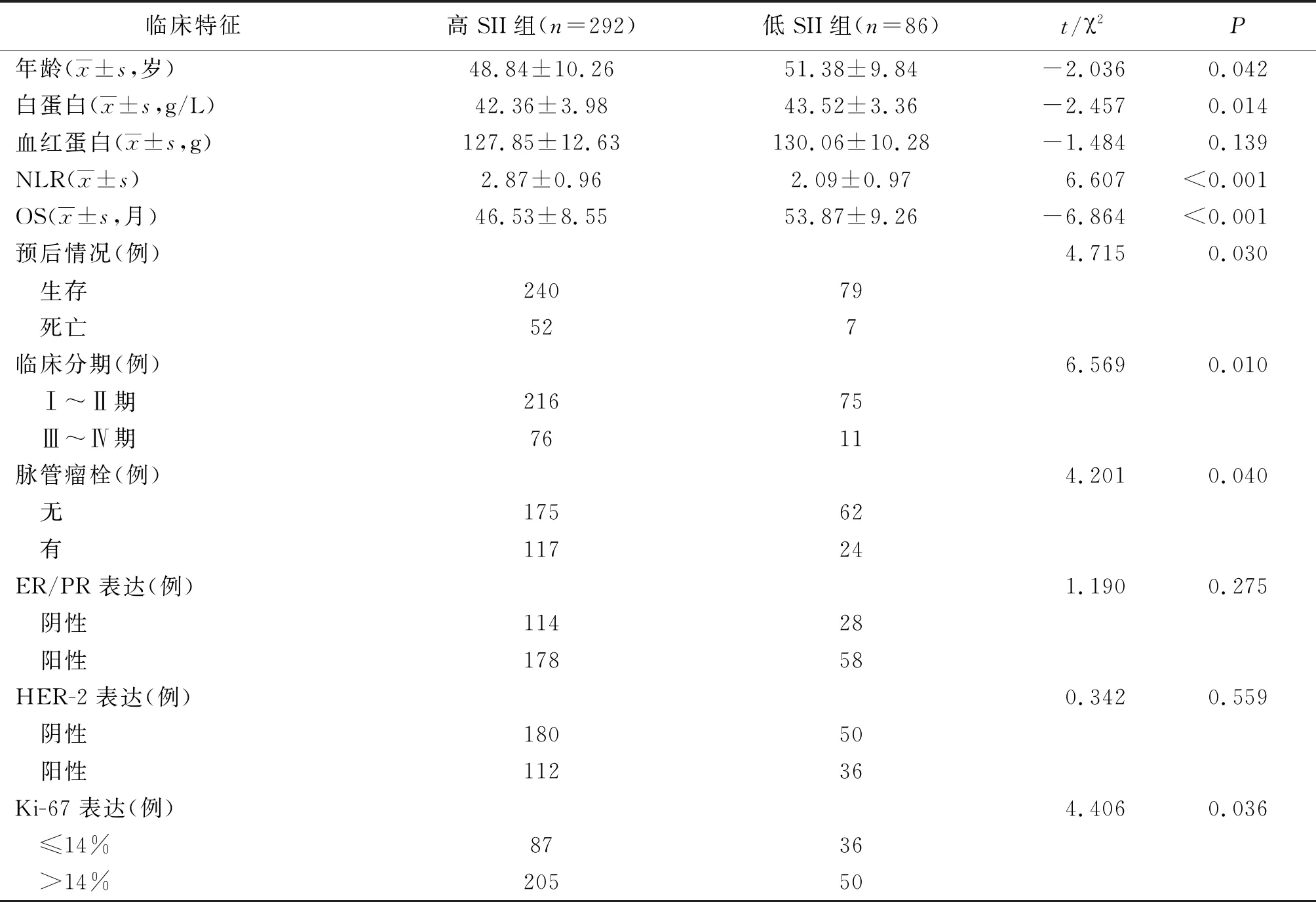
表1 不同SII水平乳腺癌患者臨床資料比較
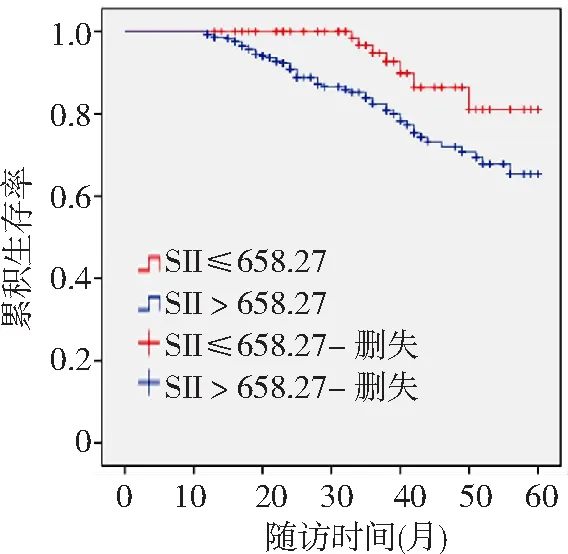
圖2 不同SII水平乳腺癌患者的Kaplan-Meier生存曲線
2.4單因素分析 非pCR組白蛋白低于pCR組,NLR、SII、臨床分期Ⅲ~Ⅳ期、有脈管瘤栓、Ki-67表達>14%比率高于pCR組(P<0.05,P<0.01)。兩組年齡、血紅蛋白、ER/PR和HER-2表達比較差異無統計學意義(P>0.05)。見表2。
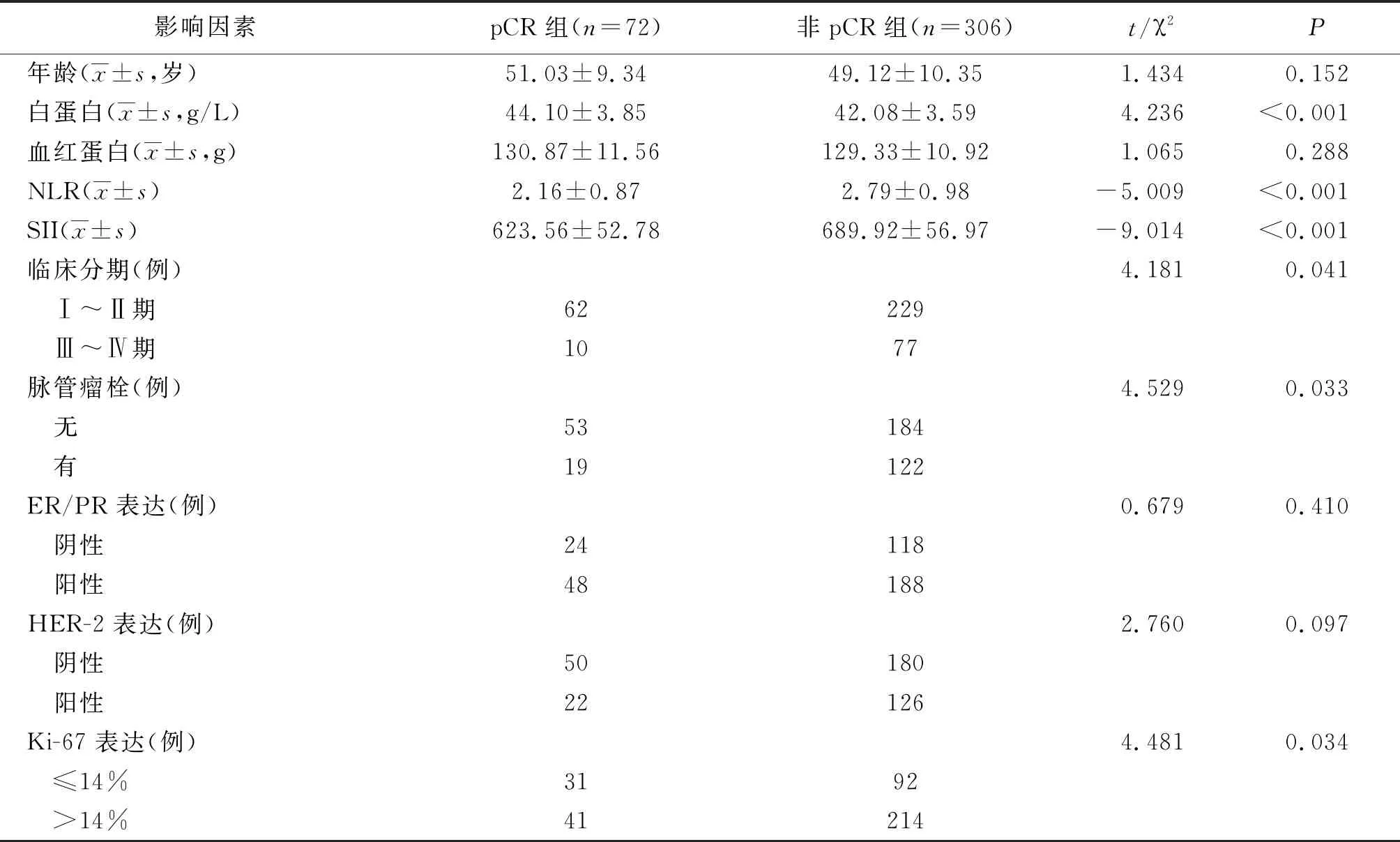
表2 影響新輔助化療乳腺癌患者獲得pCR的單因素分析
2.5多因素Logistic回歸分析 以單因素分析中差異有統計學意義的指標為自變量,新輔助化療乳腺癌患者是否獲得pCR為因變量納入多因素Logistic回歸分析,結果顯示NLR>2.35、SII>658.27、有脈管瘤栓、臨床分期Ⅲ~Ⅳ期是新輔助化療乳腺癌患者未獲得pCR的獨立危險因素(P<0.05,P<0.01)。見表3。
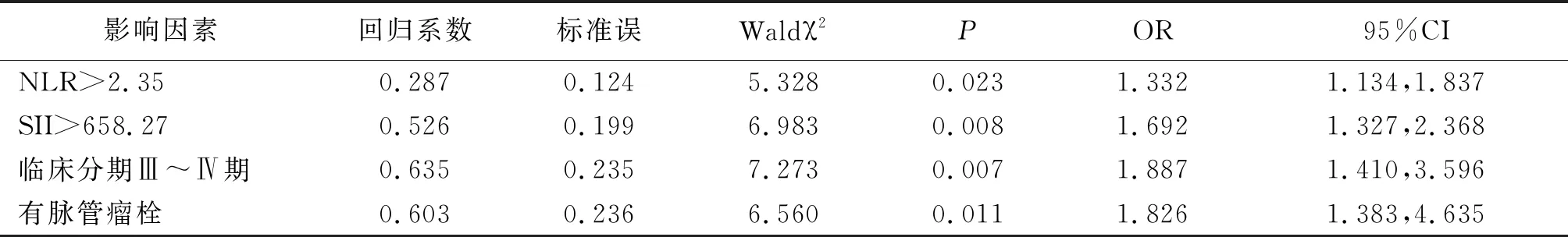
表3 影響新輔助化療乳腺癌患者獲得pCR的多因素Logistic回歸分析
3 討論
近年來,雖然我國醫療水平有了很大提高,但乳腺癌患者預后仍不樂觀。調查顯示,我國乳腺癌5年生存率約為82.0%,明顯低于西方發達國家的90.9%[11]。本研究中,378例乳腺癌患者死亡59例(15.61%),符合上述報道。由于我國為人口大國,患病人數多,因此乳腺癌的精準治療具有重要意義。
新輔助化療在乳腺癌治療中的作用已得到證實,其適應證包括炎性乳腺癌、cT4、cN2以上及具有保乳意愿而原發灶過大期待降期保乳治療者[12]。王麗春[13]研究顯示,新輔助化療聯合保乳術治療,能改善乳腺癌患者預后,其有效率為91.43%。朱月梅等[14]對107例乳腺癌的研究中也得到了類似的結果。但并非所有符合適應證的乳腺癌患者經新輔助化療聯合手術治療后,均能得到理想的預后。pCR是新輔助化療后療效評估的常用指標,獲得pCR的胃癌患者預后較好,3年總生存率超過95%,無復發生存率超過90%[15]。關于新輔助化療后的pCR率,目前不同的研究中結果并不一致。姜聰和黃元夕[16]對387例行新輔助化療乳腺癌的研究發現,pCR率為18.7%。高國璇等[12]研究發現,乳腺癌新輔助化療的pCR率為21.9%。陳卓等[17]研究發現,乳腺癌患者的pCR率為29.6%。本研究經回顧性分析顯示,pCR率為19.05%,與相關文獻報道結果相近[18],也符合上述報道范圍。分析不同研究間pCR率存在較大差異的原因為:①入選患者的臨床特征不同,如pCR在三陰性乳腺癌或HER-2陽性乳腺癌中應用最廣泛,但其對激素受體陽性或HER-2陰性Luminal型乳腺癌的適用性降低,此類患者的pCR率較低,但如獲得pCR,其預后亦可能較好;②患者的基本特征、研究的樣本量存在差異,檢驗效能各不相同。因此,早期預測乳腺癌患者預后,有助于改善治療結局。但常規使用的乳腺癌預后預測指標如臨床分型、腫瘤分期等準確性有限,相關基因檢測如MCL-1、BRCA等價格昂貴,難以普及應用,故尋找預測乳腺癌預后的新型指標具有重要意義。
隨著研究的深入,免疫和炎癥反應在腫瘤發生及預后評估中的作用逐漸引起重視。在腫瘤的侵襲過程中,其抗原性及釋放的組織因子能夠激活免疫系統,并通過多種途徑發揮抗腫瘤作用[19-20]。NLR是常用的新型標志物,已被證實是多種腫瘤預后不良的危險因素[21]。但最新的研究分析結果顯示,治療前NLR并不能評估食管癌患者預后[22-23]。可能是由于NLR僅能反映炎癥狀況,而缺乏對免疫狀況的評估。本研究經多因素Logistic回歸分析發現,NLR>2.35是新輔助化療乳腺癌患者未獲得pCR的獨立危險因素,但ROC曲線分析顯示,其預測效能較SII低。提示NLR與新輔助化療乳腺癌患者獲得pCR之間有一定的相關性。
SII能更全面反映患者的免疫功能與炎癥反應之間的平衡狀態。SII升高提示血小板及中性粒細胞增多,或淋巴細胞減少,表明體內炎癥反應增強,而免疫功能較弱。中性粒細胞增多能夠從多個方面促進腫瘤的發生及發展,包括促進氧自由基釋放、引起細胞DNA損傷、使抑癌基因失活和癌基因激活、增強腫瘤細胞侵襲能力、促進腫瘤轉移等[24-25];還能抑制T淋巴細胞活化,降低機體免疫系統對腫瘤細胞的清除能力。血栓形成是腫瘤進展的重要機制,血小板增多不但能增加血液的黏性,引起循環腫瘤細胞的邊集化,利于其穿透基底膜而發生遠處轉移;而且血小板增多會釋放趨化因子及多種蛋白水解酶,增強腫瘤細胞的侵襲性[26-27]。另外,淋巴細胞減少能使機體的免疫監視功能降低,有利于腫瘤的生長及侵襲。孔梁好等[28]研究顯示,高SII膽囊癌患者的1、3、5年生存率顯著低于低SII患者。meta分析顯示,高SII是胰腺癌患者預后不良的獨立危險因素[29]。在行新輔助化療的乳腺癌患者中,亦得到了類似的結果,高SII與更短的預后生存期及更高的復發率關系密切[30]。在HER-2陽性或三陰性乳腺癌患者中,高SII與其生存期縮短呈正相關[31-32]。本研究結果顯示,高SII組OS、生存率、年齡、白蛋白水平均低于低SII組,NLR水平、臨床分期Ⅲ~Ⅳ期、有脈管瘤栓、Ki-67表達>14%比率高于低SII組,提示SII升高與腫瘤分期較高及預后較差相關。多因素Logistic回歸分析顯示,SII>658.27是新輔助化療乳腺癌患者未獲得pCR的獨立危險因素,且ROC曲線分析顯示,SII具有較高的預測效能。
綜上所述,SII升高是新輔助化療乳腺癌患者未獲得pCR的獨立危險因素,且與患者預后不良有關。本研究尚有一定的局限性,一方面為單中心、小樣本量的回顧性分析,可能存在混雜因素的干擾;另一方面,未對SII進行動態監測分析。

