4種脾虛造模法的橫向對比研究*
王啟航,陸瑞敏,陳萌,張冬梅
(1.北京中醫藥大學中醫學院,北京 100029;2.北京中醫藥大學東直門醫院,北京 100700)
隨著社會的發展,人們壓力增大、飲食不規律等問題日益增多,結合暖期多虛寒的疾病譜特征[1],致當代脾胃疾病多發。而脾氣的健運與否也很大程度決定了人體健康與否。在越來越重視“治未病”的今天,展開脾胃生理功能、脾虛發生機制的研究,無疑有著重要的時代意義。中醫造模實驗是一種現代形式的“比類取象”,它使整個生物科學成為了中醫學發展的基礎[2],研究脾虛動物模型是研究脾胃理論的理想切入點。有關脾虛模型的復制方法逐漸多樣化、復雜化[3],但是缺少模型間的橫向對比及導致脾虛的病因探討。有鑒于此,筆者復制了苦寒瀉下、飲食失節、勞倦過度、利血平注射4種經典脾虛模型,并從宏觀、免疫、消化、血液、線粒體功能角度進行系統評價以比較模型損傷程度及適用性,希冀為脾虛的發生機制提供研究價值。
1 材料與方法
1.1 動物 SPF級雄性昆明小鼠100只,體質量18~22 g,購于斯貝福(北京)生物技術有限公司,許可證編號SYXK2019-0010。常規飼養于北京中醫藥大學SPF級動物房。
1.2 藥物與試劑 番瀉葉配方顆粒150 g,北京康仁堂藥業有限公司生產,購于北京中醫藥大學東直門醫院;利血平粉末(RH45599-1)購于北京百諾威生物科技有限公司;冰乙酸(20180911)購于天津市富宇精細化工有限公司;血清D-木糖檢測試劑盒(20180504)購于南京建成生物工程研究所;Trizol(A8404-1)購于 Invitrogen公司;SYBR Premix EX TaqII Kit(AK2901)、Prime Script TMR Treagent Kit(AK2003)購于 TaKaRa公司;DEPCH2O(20190811)、磷酸鹽緩沖液(20190522)、PCR 引物(20190818)、TIA Namp Genomic DNA Kit(201900526)、DNaseI(20190928)、Promega(M610A)購于北京晶萊生物有限公司。
1.3 儀器設備 DK-8D型電熱恒溫水浴鍋(上海一恒科技有限公司)、MB10Kpw型電子天平(上海海康電子儀器廠)、BC-2300型血液分析儀(深圳邁瑞生物醫療電子股份有限公司)、精密電子天平(JA2003 SHP07003,上海恒平科學儀器有限公司)、TU-1800S型紫外分光光度計、Scanspeed1730R型低溫離心機(Labogene公司)、Rotor-Gene 3000 Realtime PCR儀(Orbett Research公司)、EDTA抗凝血管(博士德生物工程有限公司)。
1.4 模型制備 將小鼠適應性喂養3 d后,按如下分組,見表1。

表1 各組小鼠造模方法Tab.1 Modeling methods of mice in each group
記錄各組小鼠進食量、體質量。造模持續10 d后,隨機取10只小鼠做相關指標檢測,10只小鼠自然恢復10 d,觀察各組宏觀指標的穩定性。
1.5 宏觀指標評價 記錄各組小鼠進食量、體質量變化,觀察小鼠是否出現懶動、拱背、扎堆、瞇眼、毛色枯黃、毛色稀少、耳尾色白、腹面被毛憔悴、抓取無力掙扎、受驚動時無神、軟便、便溏、泄瀉、受激排便率增高等癥狀,出現某一癥狀記1分,對各組小鼠得分進行統計學分析,比較宏觀體征得分[5]。
1.6 宏觀指標穩定性評價 分別記錄脾虛模型造模結束后和自然恢復10 d后各組小鼠體質量、進食量變化。然后,采用綁尾迫使小鼠強制游泳至力竭,游泳水溫為22℃,小鼠游泳以連續“冒泡”5次為力竭標志,記錄游泳時長。
1.7 理化指標檢測 造模結束后,小鼠摘眼球取血,血液分析儀檢測紅細胞(RBC)、白細胞(WBC)、血紅蛋白(HGB)。4℃靜置2 h后,以5 000 r/min,4℃離心5 min,離心半徑18 cm,取上清,比色法測定血清D-木糖水平,操作按試劑盒說明進行。碘-淀粉酶比色法測定小鼠血清淀粉酶活性。記錄胸腺、脾臟質量,計算胸腺、脾臟指數。臟器指數=臟器質量(mg)/體質量(g)。
1.8 mtDNA拷貝數及線粒體自噬相關蛋白Pink1、Parkin mRNA的表達 采用實時熒光定量PCR法進行檢測。取1 mm3大小的新鮮肝組織若干塊,按TIA Namp Genomic DNA Kit說明書提取總DNA。根據SYBR Premix EX TaqII Kit說明書進行擴增,擴增程序為:95 ℃×60 s,(95 ℃×15 s,60 ℃×60 s)×40 個循環,以 β-actin 為內參照,所得 CT 值按照 2-ΔΔCt的方法進行均一化處理后再進行統計分析,得出相對mtDNA拷貝數。引物序列如下,見表2。

表2 ND1 及 β-actin 引物序列(3′-5′)Tab.2 ND1 and β-actin primer sequences(3′-5′)
取適量組織,按Total RNA Extraction Kit說明書提取總RNA,DNaseI去基因組并用紫外分光光度儀檢測純度與完整性。根據Prime Script TMR Treagent Kit說明書進行反轉錄,cDNA-20℃保存。按照mRNA/lncRNA qPCR Kit說明書進行擴增,擴增程序為:95 ℃×60 s,(95 ℃×10 s,58℃×30 s)×39 個循環,以β-actin為內參照,將所得CT值按照2-ΔΔCt的方法進行均一化處理再進行統計分析,得出線粒體自噬相關蛋白Pink1、Parkin mRNA水平。引物序列如下,見表3。

表3 Pink1、Parkin 及內參引物序列(3′-5′)Tab.3 Pink1,Parkin,and the internal reference primer sequences(3′-5′)
1.9 統計學方法 實驗數據用SPSS 24.0軟件處理。計量資料以均值±標準差(±s)表示,數據正態且方差齊多組間比較采用單因素方差分析,組間兩兩比較采用LSD法,非正態或方差不齊組間比較采用非參數檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組小鼠宏觀指標比較 與空白對照組相比,各組宏觀體征均有顯著變化(P<0.05)。其中,利血平組宏觀體征得分最高,飲食失節組最低。與空白對照組相比,各造模組小鼠造模后體質量與進食量平均值均有所下降(P<0.05),差異具有統計學意義,以利血平組差異明顯。綜上利血平組小鼠脾虛癥狀表現、進食量與體質量變化最為顯著,飲食不節法因造模方法沖突故不參與統計。見表4。
表4 脾虛小鼠宏觀指標比較(±s)Tab.4 Comparison of macroscopic indicators in spleen deficiency mice(±s)
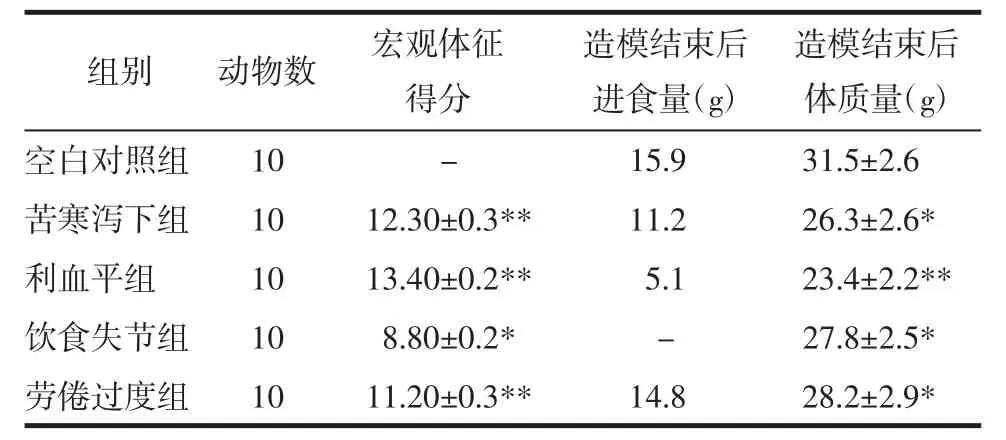
表4 脾虛小鼠宏觀指標比較(±s)Tab.4 Comparison of macroscopic indicators in spleen deficiency mice(±s)
注:與空白對照組比較,*P<0.05,**P<0.01。
造模結束后體質量(g)空白對照組 10 - 15.9 31.5±2.6苦寒瀉下組 10 12.30±0.3** 11.2 26.3±2.6*利血平組 10 13.40±0.2** 5.1 23.4±2.2**飲食失節組 10 8.80±0.2* - 27.8±2.5*勞倦過度組 10 11.20±0.3** 14.8 28.2±2.9*組別 動物數 宏觀體征得分造模結束后進食量(g)
2.2 各組小鼠宏觀指標穩定性比較 自然恢復10 d后,與空白對照組相比,苦寒瀉下組、利血平組、飲食失節組體質量仍未達到正常水平(P<0.05),差異具有統計學意義,勞倦過度組體質量水平無統計學差異(P>0.05);各模型組小鼠進食量恢復并超出空白對照組水平,進食量發生“報復式”增長。其中,利血平組增長最多,苦寒瀉下組增長最少;造模結束后,苦寒瀉下組、飲食失節組、勞倦過度組小鼠游泳至力竭的時長均降低(P<0.05),以利血平組與苦寒瀉下組差異顯著(P<0.01),差異均具有統計學意義。自然恢復10 d后,苦寒瀉下組與飲食失節組小鼠仍有低于對照組的趨勢(P<0.05),差異具有統計學意義。綜上苦寒瀉下組與飲食失節組小鼠癥狀更穩定,飲食不節組與勞倦過度組因造模方法沖突故不參與統計。見表5。
表5 脾虛小鼠宏觀指標穩定性比較(±s)Tab.5 Comparison of macroscopic index stability in spleen deficiency mice(±s)

表5 脾虛小鼠宏觀指標穩定性比較(±s)Tab.5 Comparison of macroscopic index stability in spleen deficiency mice(±s)
注:與空白對照組比較,*P<0.05,**P<0.01。
自然恢復10 d后游泳時長(min)空白對照組 10 30.6±2.4 35.7±2.4 16.4 17.3 9.2±2.4 11.3±4.3苦寒瀉下組 10 24.6±3.6* 30.6±2.4* 10.3 17.9 4.1±1.3** 7.9±3.4*利血平組 10 22.7±2.2** 29.9±3.2* 5.3 18.7 14.5±3.1** 11.5±4.6飲食失節組 10 25.2±3.0* 29.6±3.5* - - 6.1±2.8* 8.9±3.6*勞倦過度組 10 26.9±2.1* 34.3±2.6 16.2 18.6 - -組別 動物數造模結束后體質量(g)自然恢復10 d后體質量(g)造模結束后進食量(g)自然恢復10 d后進食量(g)游泳至力竭時長(min)
2.3 各組小鼠理化指標比較 與空白對照組相比,各模型組小鼠血清D-木糖水平低于正常組(P<0.05),說明各組造模成功;勞倦過度組胸腺指數下降最顯著(P<0.05),其次是利血平組(P<0.05),苦寒瀉下組變化最小(P<0.05),差異均具有統計學意義;利血平組脾臟指數下降最顯著(P<0.05),苦寒瀉下組次之(P<0.05),飲食失節組有所上升(P<0.01),差異均具有統計學意義;血清淀粉酶活性均有所降低,變化以利血平組最為顯著(P<0.01);利血平組 RBC 下降最為明顯(P<0.01),其次為苦寒瀉下組(P<0.01),勞倦過度組有所上升(P<0.05),差異均具有統計學意義;利血平組 WBC 下降最明顯(P<0.05),其次為苦寒瀉下組(P<0.05),差異均具有統計學意義;利血平組HGB下降最為顯著(P<0.05),其次為苦寒瀉下組(P<0.05),勞倦過度組有所上升(P<0.01),差異均具有統計學意義。綜上,利血平組小鼠理化指標變化明顯,其次為苦寒瀉下組。見表6。
表6 脾虛小鼠理化指標比較(±s)Tab.6 Comparison of physical and chemical indexes of spleen deficiency mice(±s)

表6 脾虛小鼠理化指標比較(±s)Tab.6 Comparison of physical and chemical indexes of spleen deficiency mice(±s)
注:與空白對照組比較,*P<0.05,**P<0.01。
外周血指標RBC(×1012/L) WBC(×109/L) HGB(g/L)空白對照組 10 5.14±0.12 2.98±0.27 4.96±0.19 718.94±15.49 7.37±0.59 6.42±0.93 139.47±13.74苦寒瀉下組 10 2.84±0.22** 2.72±0.34* 4.39±0.57* 633.28±17.58* 6.23±1.08* 5.73±1.29* 128.16±10.42*利血平組 10 2.12±0.26** 2.63±0.47* 4.17±0.62* 603.19±19.73** 5.93±1.16** 5.13±1.67* 120.95±11.73*飲食失節組 10 3.79±0.19* 2.80±0.41 5.87±0.51** 622.17±20.15** 6.43±0.93 6.23±0.85 126.45±14.94勞倦過度組 10 3.93±0.16* 2.54±0.33* 4.82±0.83 667.87±17.94 8.94±0.97* 5.43±1.36 148.74±12.69**組別 動物數 血清D-木糖水平(Inmol/L)胸腺指數(mg/g)脾臟指數(mg/g)血清淀粉酶(U/100 mL)
2.4 各組小鼠mtDNA拷貝數、Pink1、Parkin mRNA表達水平比較 與空白對照組比較,飲食失節組mtDNA 拷貝數下降最為顯著(P<0.01),其次苦寒瀉下組(P<0.05),勞倦過度組下降較少(P<0.05),差異均具有統計學意義;苦寒瀉下組Pink1mRNA轉錄水平降低最為顯著(P<0.01),其次飲食失節組(P<0.05),差異均具有統計學意義;利血平組Parkin mRNA轉錄水平上升(P<0.05),差異具有統計學意義,其他組差異無統計學意義(P>0.05)。綜上,飲食失節與苦寒瀉下組小鼠線粒體功能改變明顯。見表7。
表7 脾虛小鼠mtDNA相對拷貝數比較(±s)Tab.7 Comparative copy number comparison of mtDNA in spleen deficient mice(±s)

表7 脾虛小鼠mtDNA相對拷貝數比較(±s)Tab.7 Comparative copy number comparison of mtDNA in spleen deficient mice(±s)
注:與空白對照組比較,*P<0.05,**P<0.01。
組別 動物數mtDNA相對拷貝數 Pink1 mRNA Parkin mRNA空白對照組 10 1.140±0.120 1.024±0.068 1.049±0.156苦寒瀉下組 10 0.840±0.220* 0.612±0.083**1.028±0.172利血平組 10 1.120±0.260 0.973±0.126 1.319±0.165*飲食失節組 10 0.790±0.190** 0.893±0.097*1.057±0.176勞倦過度組 10 0.930±0.160* 0.997±0.164 1.059±0.247
3 討論
中醫在臨床診斷中常常是司外揣內的,常以乏力懶言,語聲低微,四肢沉重,形體消瘦,食欲不振,便溏或泄瀉等表現作為衡量患者是否是脾虛證的重要參考,并以癥狀的突出與否來判斷脾虛的輕重及亞型,故在中醫的實驗研究中,宏觀指標也是動物模型評價的重要組成部分[6]。4種造模法都能成功復制脾虛癥狀,但是各個模型的癥狀輕重存在差異,利血平模型組癥狀重且覆蓋全面,但自然恢復快,模型穩定性差;苦寒瀉下組癥狀表現方面次之,但模型穩定性好;飲食不節模型組癥狀覆蓋同樣較為全面,癥狀穩定但較為輕淺,可造模至20 d,勞倦過度模型組的脾虛癥狀輕淺且覆蓋不全面。
脾胃為氣血生化之源,脾的運化作用于血液質量息息相關[7],故脾虛證動物模型會出現血液質量改變。近年來對脾虛模型評價的血液指標主要包括:WBC、淋巴細胞、紅細胞比容、RBC平均血紅蛋白量等。脾主運化,脾虛證的主要表現之一為消化系統的功能低下,其中較為公認的是D-木糖代謝水平,該指標可以衡量模型的吸收功能[8]。此外,血清淀粉酶也與消化功能關系密切。“四季脾旺不受邪”,脾氣健運與否很大程度上決定了人體是否健康,脾與人體免疫功能密切相關[9],脾臟指數與胸腺指數的降低不僅直接表明脾家損傷模型小鼠的免疫功能降低,也間接說明了其淋巴細胞與巨噬細胞產生數目的減少。實驗表明,各模型組小鼠血清D-木糖水平和血清淀粉酶活性均下降,說明造模成功,脾虛小鼠存在消化功能低下的表現,以利血平與飲食失節組小鼠消化系統功能障礙突出。利血平組與苦寒瀉下組小鼠外周血的RBC、WBC、HGB顯著下降,說明利血平造模法和苦寒瀉下造模法對小鼠的血液質量影響廣泛,而勞倦過度造模法對小鼠血液質量的影響較小。利血平組和苦寒瀉下組小鼠脾臟指數和胸腺指數均下降非常顯著,說明利血平造模法和苦寒瀉下造模法對小鼠的細胞免疫和體液免疫功能均有顯著影響。飲食失節組小鼠脾臟指數上升,可能是脾家損傷小鼠表現出的病理性的脾腫大。勞倦過度組小鼠則只有胸腺指顯著下降,說明其細胞免疫功能降低。飲食失節造模法和勞倦過度造模法只對動物的部分免疫功能有影響。
脾主運化為生命活動提供能量,中醫脾的狀態影響生命活動狀態。而線粒體為細胞生命活動提供能量,這與脾的功能在某種程度上是相似的。有學者[10]認為脾主運化就是營養物質在線粒體內進行的一系列氧化代謝所代表的“內運化”過程。線粒體功能與mtDNA的數量密切相關,mtDNA下降超過閾值則發生線粒體功能障礙,介導線粒體自噬或誘發細胞凋亡[11]。Pink1、Parkin是介導并啟動線粒體自噬的關鍵蛋白[12]。實驗結果顯示,除利血平組外,其他3種模型小鼠的mtDNA相對拷貝數下降,說明模型小鼠存在線粒體功能異常,以飲食失節組小鼠線粒體損傷程度最重。在線粒體損傷的進程中,mtDNA相對拷貝數會先升高再降低,利血平組小鼠的mtDNA相對拷貝數變化不顯著,可能是由于其線粒體損傷程度較輕,處于mtDNA相對拷貝數變化的中間階段。除勞倦過度組和利血平組外,其他兩種模型小鼠的Pink1 mRNA水平下降,表明脾虛損傷小鼠存在線粒體自噬功能的抑制,損傷的線粒體無法被及時清除,線粒體疾病和細胞凋亡發生的概率增加。與對照組相比,除利血平組外,其他3種模型小鼠的Parkin mRNA水平差異無統計學意義,推測脾虛損傷主要影響Pink1 mRNA水平,因為Pink1位于Parkin的上游,推測隨著脾虛損傷加重,模型小鼠的Parkin mRNA水平也將受到影響。與對照組相比,利血平組Parkin mRNA水平上升,可能是因為利血平組小鼠存在線粒體損傷,但是線粒體自噬功能未受到影響,Parkin mRNA過表達以清除損傷線粒體,維持細胞穩態。
綜上,4種造模方法都可以在不同程度上造成脾虛損傷。脾虛的形成可能是飲食失節、過食寒涼、勞倦過度等多種復合因素導致的胃腸道消化吸收異常,進而影響到人體循環系統、免疫系統,甚至線粒體異常,但是這些聯系的具體機制尚未闡明,有待于進一步的研究。

