極重度脊柱側凸矯形術中喚醒質量的影響因素分析
李強,曾菲,陳濤,雷雪,梁孟秋,梁益建,鄭傳東*
(1.西南交通大學附屬醫院,成都市第三人民醫院麻醉科,四川 成都 610031;2.四川省醫學科學院,四川省人民醫院心臟外科中心,四川 成都 610072;3.西南交通大學附屬醫院,成都市第三人民醫院骨科,四川 成都 610031)
目前,極重度脊柱側凸患者的自然病程結局依然是心肺功能衰竭導致的死亡[1]。挽救極重度脊柱側凸患者生命的唯一方法就是手術治療,以期緩解由于脊柱畸形所導致的心肺功能持續惡化。這類患者的脊柱矯形術風險極大,而術中喚醒則是脊柱側凸矯形術中判斷脊髓功能的良好手段。喚醒過程中患者因疼痛、氣管導管刺激,可導致躁動、嗆咳等并發癥發生[2]。因此,喚醒過程中如何避免這些并發癥,讓患者快速配合完成指令成為術中喚醒試驗的關鍵。目前,可能影響脊柱側凸矯形術中喚醒質量的因素眾多,但這些因素與術中喚醒質量的關系仍不清楚。本研究通過回顧性分析成都市第三人民醫院極重度脊柱側凸患者的臨床資料,探討影響術中喚醒質量的危險因素,為臨床提供參考。
1 資料與方法
1.1 一般資料 收集2013年1月至2018年4月成都市第三人民醫院骨科收治并行脊柱矯形術的先天性極重度脊柱側凸患者的臨床資料,包括術前一般情況、術中麻醉管理及術中喚醒情況。納入標準:(1)先天性脊柱側凸患者;(2)Cobb角≥110°。排除標準:(1)術前患有認知功能障礙者;(2)術前嚴重溝通交流障礙者;(3)術前肝功能異常者;(4)術前合并神經功能障礙者。
共有513例接受脊柱矯形術的患者符合納入標準,其中男196例,女317例;年齡13~34歲,平均(28.5±4.1)歲。患者術前主彎Cobb角平均為(137.5±26.8)°。
1.2 麻醉方法 所有患者入室后常規監測心率(heart rate,HR)、無創血壓(non-invasive blood pressure,NIBP)、血氧飽和度(oxygen saturation,SpO2)及體溫,建立靜脈通路,面罩吸入2 L/min氧氣。入室后靜脈給予鹽酸戊乙奎醚0.01 mg/kg、甲潑尼龍40 mg、羥考酮0.1 mg/kg,同時靜脈泵注右美托咪定負荷劑量0.5~1 μg/kg(10 min),維持劑量0.1~0.2 μg·kg-1·h-1。待動、靜脈穿刺完成后,行口咽部及環甲膜穿刺以1%丁卡因表面麻醉后,經纖支鏡引導下行氣管插管機械通氣,潮氣量(tidal volume,TV)6~8 mL/kg,呼吸末正壓(positive end-expiratory pressure,PEEP)4~6 cm H2O,呼吸頻率(respiratory rate,RR)18~22次/min、新鮮氣流量2 L/min、吸入氧濃度(fraction of inspiration O2,FiO2)50%,維持呼吸末二氧化碳(fractional con-centration of end-tidal carbon dioxide,PETCO2)35~45 mm Hg,同時靜脈給予咪達唑侖0.1 mg/kg、依托咪脂0.3 mg/kg、舒芬太尼1 μg/kg、順式阿曲庫銨0.2 mg/kg。麻醉維持:血漿靶控輸注丙泊酚2~3 μg/mL、瑞芬太尼2~3 ng/mL及維持劑量右美托咪定,維持腦電雙頻指數(bispectralindex,BIS)50~60。根據脈搏指數心輸出量(pulse index continuous cardiac output,PICCO)監測,每搏變異度(stroke volume variation,SVV)>12時進行補液治療,補液種類按晶膠比2︰1進行,膠體液總量不超過33 mL/kg。外周阻力指數(system vascular resistance index,SVRI)<1 700 dyn·s·cm-5m2給予血管收縮藥物,當SVRI>2 400 dyn·s·cm-5m2給予血管擴張藥物。采用保溫毯對患者進行加溫,維持膀胱溫36.0℃~37.0℃。同時監測患者體感誘發電位(somatosensory evoked potential,SEP)及運動誘發電位(motor evoked potential,MEP)。術中采用回收式自體輸血治療。
1.3 術中喚醒方法 當手術主要步驟結束后開始喚醒,此時停止輸注丙泊酚及瑞芬太尼,僅靜脈輸注右美托咪定。待BIS高于75后開始呼喚患者名字,并向患者發出睜眼及活動雙下肢的指令,直至喚醒成功。根據患者術中喚醒情況將患者分為兩組,即喚醒質量優良組和喚醒質量差組。術中喚醒質量評價:根據患者術中喚醒質量分級[3],Ⅰ~Ⅱ級為質量優良,Ⅲ~Ⅳ級為質量差。術中喚醒具體分級,Ⅰ級:患者聽到呼喚蘇醒,安靜并按指令活動四肢;Ⅱ級:患者突然清醒,不自主活動四肢,不危及內固定和氣管導管,可按指令活動四肢;Ⅲ級:患者突然清醒,軀干劇烈運動,需按壓才能不危及內固定和氣管導管;Ⅳ級:在排除脊髓功能受損情況下,60 min內患者對呼喚無反應。
2 結 果
根據喚醒質量,對從麻醉誘導開始到術中喚醒開始時右美托咪定的用量進行比較,喚醒質量優良患者右美托咪定用量為(124.3±21.6)μg,喚醒質量差患者右美托咪定用量為(119.8±17.1)μg。兩組患者右美托咪定用量差異無統計學意義,其他數據比較見表1。
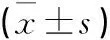
表1 術前喚醒質量優良和差的患者基本資料比較
對可能影響極重度脊柱側凸矯形術術中喚醒質量的相關因素進行單因素分析,包括年齡、性別、身體質量指數(body mass index,BMI)、肺功能、喚醒前血氣分析、體溫、Hb、手術與麻醉時間、患者術中出血與補液量及側凸病因與椎管內畸形。結果顯示,第1秒用力呼氣容積(forced expiratory volume in one second,FEV1)、第1秒用力呼氣量占用力肺活量比值(ratio of forced expiratory volume in one second to forced vital capacity,FEV1/FVC)、喚醒前體溫、喚醒前動脈二氧化碳分壓(arterial CO2partial pressure,PaCO2)、喚醒前血紅蛋白(hemoglobin,Hb)五個因素與術中喚醒質量有關(P<0.05,見表2)。
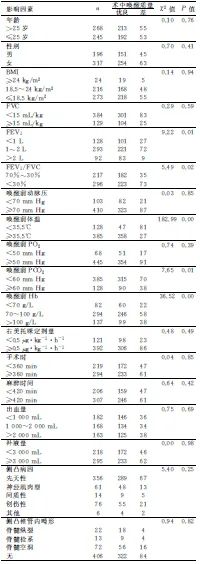
表2 影響術中喚醒質量的單因素分析結果(例)
將單因素分析有統計學意義的5項相關因素進行非條件logistic多因素回歸分析,結果顯示,喚醒前體溫、喚醒前PaCO2、喚醒前Hb是影響術中喚醒質量的獨立危險因素(P<0.05,見表3)。
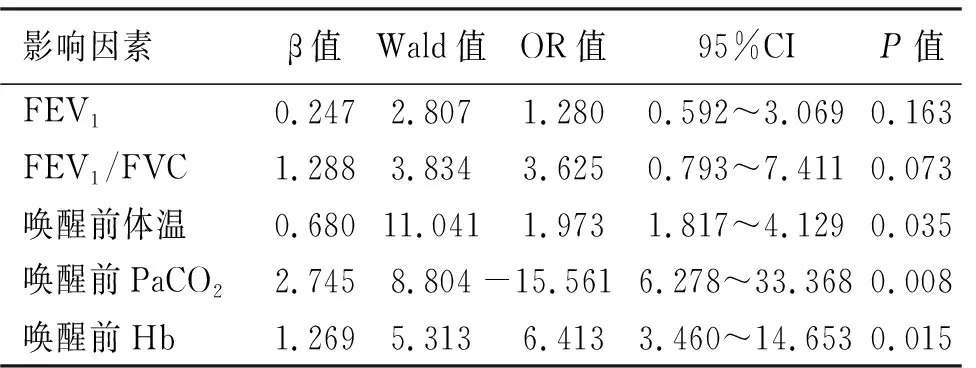
表3 術中喚醒質量多因素分析結果
、 典型病例為一28歲男性患者,因“發現脊柱側彎后凸畸形20余年”入院,完善相關檢查后診斷為:極重度脊柱畸形,側彎約170°,后凸約150°;胸廓畸形,肺功能中度受損。術前身高137 cm,臂長163 cm,體重40 kg。入院后行頭盆環牽引術,并持續調整外固定牽引高度,定期復查X線片觀察脊柱彎度變化,同時加強心肺功能和體能鍛煉,加強補鈣,預防骨質疏松。經歷了“脊柱后路松解+凹側胸廓成形”手術和“脊柱截骨矯形+凸側胸廓成形”手術,取得了良好的治療效果:術后側彎剩余約25°,后凸恢復至生理范圍;身高由術前137 cm增高至160 cm,增加23 cm;體重由術前40 kg增加至53 kg;術后雙肩等高,心肺功能明顯改善,基本恢復常人外觀。手術前后影像學資料見圖1~6。
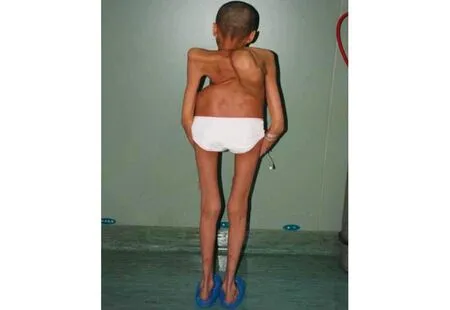
圖1 術前患者脊柱呈“剃刀背”樣外觀
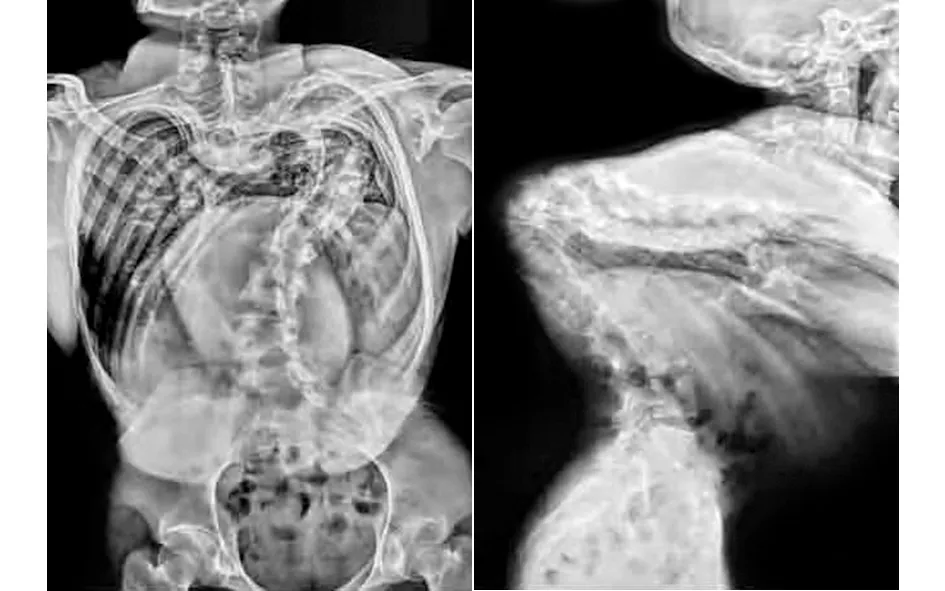
圖2 術前X線片示側凸約170°,后凸約150°
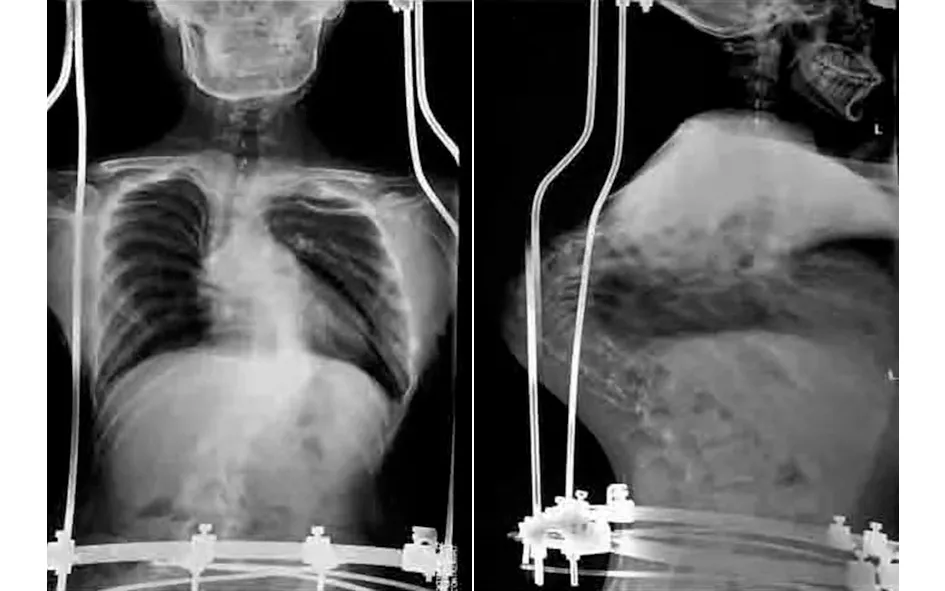
圖3 頭盆環牽引術后X線片示側凸約90°,后凸約110°
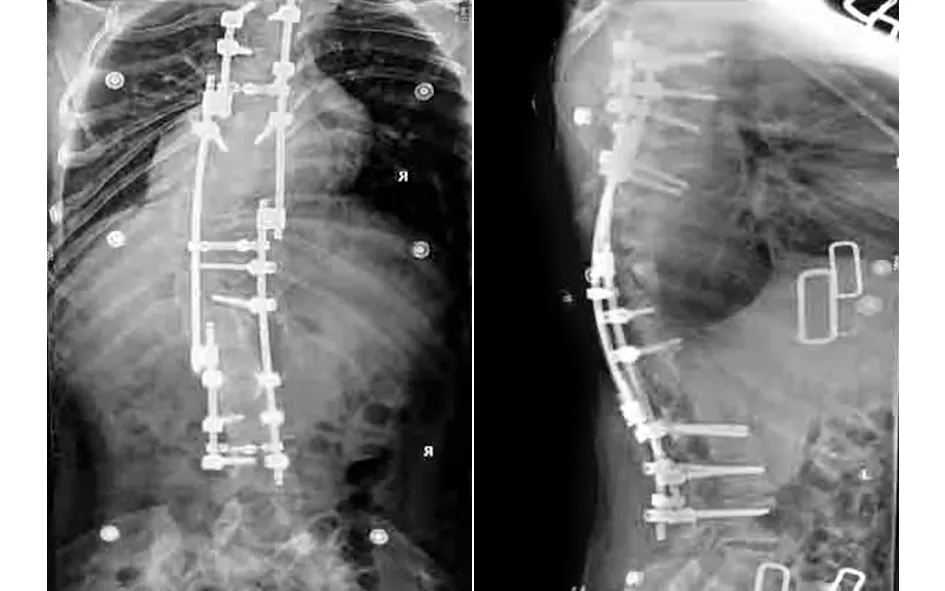
圖4 矯形術后X線片示側凸約25°,后凸基本恢復
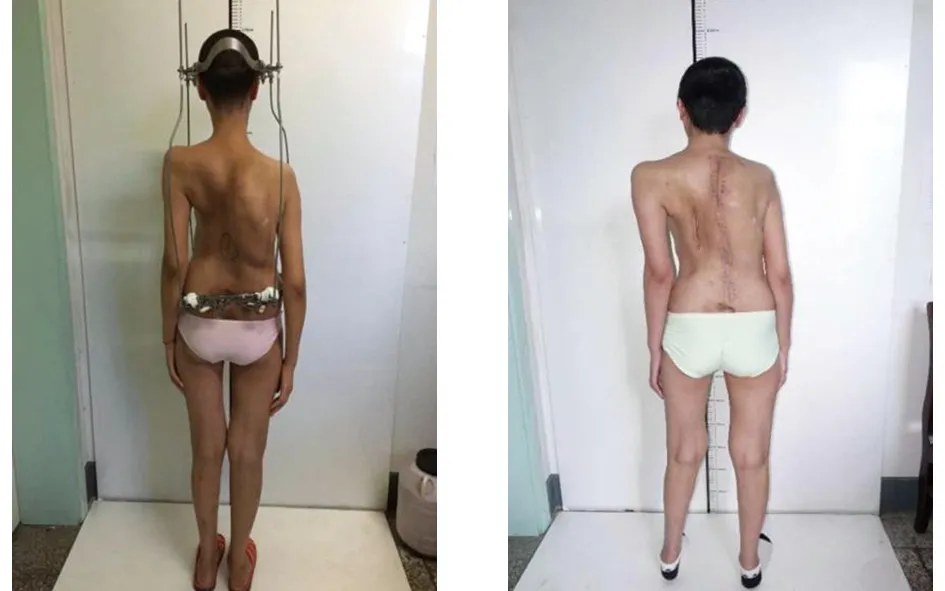
圖5 頭盆環牽引術后脊柱側凸情況已明顯改善 圖6 脊柱側凸矯形術后基本達到“三平一正”
3 討 論
脊柱側凸是一種脊柱在冠狀位、矢狀位和軸位上的序列異常的三維畸形。目前,根據國際脊柱側凸研究學會(scoliosis research society,SRS)規定,應用Cobb法測量站立位脊柱正位X線片上脊柱彎曲的程度,Cobb角大于10°就可診斷為脊柱側凸,Cobb角在110°以上即為極重度脊柱側凸[4]。
根據一項包括北京、天津、廣州等城市的流行病學調查顯示,我國的脊柱側凸發病率為1.5%~2%[5-6],而目前極重度脊柱側凸的發病率還沒有明確的統計資料。脊柱側凸矯形術是治療極重度脊柱側凸的一種方法,其目的是“三平一正一改善”即“肩平、背平、髖平(雙下肢等長)、血氣正常、肺功能明顯改善”,從而達到改善肺功能,恢復脊柱外觀的要求[7]。但該類手術難度極大,不僅僅要求矯正脊柱冠狀位、矢狀位的畸形,還要求矯正脊柱三維畸形[7]。目前,脊髓功能狀態的監測技術層出不窮,特別是SEP和MEP監測在脊柱矯形中運用以來,脊髓功能監測幾乎做到了實時化[8]。但受制于手術室電磁環境、麻醉因素、患者血壓及血二氧化碳水平等多種因素的影響,SEP及MEP經常出現假陽性或假陰性結果[9]。根據Schwartz的研究表明[10],SEP監測的敏感性為43%,特異性為100%;MEP的敏感性為62.5%,特異性為97%。SEP主要反映了脊髓后索內側丘系傳導束的完整性并具有良好的可信度,但卻不能反映皮質脊髓束的傳導功能,僅間接反映了運動傳導的完整性,對運動功能的監測可能出現假陰性結果。同時,SEP監測需要疊加一定時間,可能延遲5min或更久才能監測到急性神經損傷的發生,影響對損傷神經操作的及時判斷。另外,MEP最大的不良反應是高強度電刺激經頭皮輸入,使患者不自主的上下頜劇烈咬合,造成舌或口唇的咬傷,甚至下頜骨骨折。MEP的禁忌證包括顱骨缺損、心臟起搏器、癲癇以及任何植入體內的電裝置。因為對于心臟起搏器、人工耳蝸或其他植入體內的電裝置,在高強度電刺激時可能造成電裝置功能永久受損。同時,MEP還可以誘發癲癇。所以脊柱矯形術術中喚醒仍然是判斷矯形后脊髓功能狀態的金標準[3]。而術中喚醒的質量,直接影響術者對脊髓功能狀態的判斷。
在臨床實踐中我們發現,術中喚醒的成功實施有賴于術前良好的溝通與解釋,以消除患者緊張情緒,避免術中喚醒時,患者突然醒來對患者生理和心理上造成損害。同時,喚醒期間完善的鎮痛措施可以消除手術刺激所導致的喚醒躁動。
logistic多因素回歸分析中,OR值是指比值比,在本研究中OR值是指術中喚醒質量優良與差的概率,是通過術中喚醒質量優良的概率除以質量差的概率得到的,可以用OR值預測影響因素的效應。本研究結果表明,喚醒前體溫<35.5℃的患者術中喚醒質量差的風險是喚醒前體溫≥35.5℃患者的1.973倍,喚醒前PaCO2≥60 mm Hg的患者術中喚醒質量差的風險是喚醒前PaCO2<60 mm Hg患者的15.561倍,喚醒前Hb<70 g/L的患者術中喚醒質量差的風險是喚醒前Hb 70~100 g/L患者的6.413倍。
本研究結果表明,喚醒前患者體溫是影響術中喚醒質量的獨立危險因素。眾所周知,低體溫對麻醉藥物的代謝影響巨大,主要是降低藥物清除率、增加血藥濃度從而延長麻醉藥物的作用時間[11]。目前常用的麻醉藥物主要依靠細胞色素P450(cytochromeP450,CYP450)3A及其他同工酶進行代謝。而低溫直接減慢了酶分子的無規則運動,從而導致了酶分子與藥物結合率的降低。直觀表現為酶活性降低,反應減慢[12]。國外一項研究得出,當人體體溫低于36.5℃時,體溫每降低1℃,CYP450 3A對咪達唑侖的代謝清除率就下降11%[9]。此外,低體溫導致的寒顫嚴重影響患者的術中喚醒質量。一方面,低體溫導致的寒顫反應表現為患者喚醒過程中全身肌肉的不自主運動,而這種肌肉的不自主運動,可能會導致脊柱截骨后骨折斷端的錯位,直接引發脊髓受損[13-14]。另一方面,寒顫導致患者心率增快、血管收縮、二氧化碳產量增加。國外一項研究發現,寒顫引發的體內二氧化碳產量的增加為正常的2~3倍[15]。而血中二氧化碳的蓄積可直接影響術中喚醒質量。
本研究結果表明,喚醒前血氣分析中二氧化碳分壓也是影響術中喚醒質量的獨立危險因素。喚醒前的血氣分析結果表明,有128例喚醒前動脈血二氧化碳≥60 mm Hg,究其原因,還是由于患者極重度脊柱畸形導致的肺發育受限,肺換氣功能障礙,從而導致血中二氧化碳排除困難。血中二氧化碳能使腦脊液中的氫離子濃度增加,影響腦細胞代謝,降低腦細胞的興奮性,抑制皮質活動[16]。輕度的二氧化碳增加,對皮質下層刺激加強,間接引起皮質的過度興奮,引發喚醒時躁動。而隨著血中二氧化碳濃度的繼續升高,大腦皮質下層受抑制,導致中樞神經處于二氧化碳麻醉狀態,最終導致術中喚醒的失敗。
我們的研究發現,喚醒前的低氧血癥并不是影響術中喚醒質量的獨立危險因素,但卻嚴重影響了麻醉安全。我們臨床實踐中,約15%的患者入院時即存在Ⅰ型或Ⅱ型呼吸衰竭,這類患者入院前即依靠無創呼吸機維持基本氧合,長期的低氧或二氧化碳潴留,使患者的肺已經出現器質性病變,同時由于長期壓迫導致肺發育受限。所以術中通過手術主要步驟后,雖然使胸腔容積得以增加、肺壓迫得以解除,但在吸入純氧或者50%左右的氧氣時,依然出現氧分壓小于50 mm Hg的情況。
另外,喚醒前血紅蛋白含量也直接影響著術中喚醒質量。究其原因,主要是由于貧血導致的低血容量,低血壓和低灌注能夠引起術中腦灌注不足的發生[17]。加之貧血患者麻醉藥物代謝能力減弱,喚醒期間麻醉藥物殘留引起腦攝氧率下降,加之手術應激狀態下激素分泌的改變,炎性介質的釋放都可以影響腦血流循環和腦細胞功能引起腦缺氧,從而導致術中喚醒失敗。
雖然在本研究中發現,右美托咪定的使用劑量與術中喚醒質量無關,但很多國內外研究均表明,右美托咪定能夠大幅提高術中喚醒質量,降低喚醒躁動的發生率,同時能夠避免喚醒時患者的血流動力學波動[18-19]。我們在臨床實踐中發現,使用右美托咪定后,患者術中喚醒躁動率明顯下降,而喚醒時間幾乎沒有變化。
綜上所述,適宜的麻醉方法和喚醒期的麻醉管理是提高麻醉效果,減少或預防喚醒并發癥的先決條件。喚醒麻醉的術中管理還需要不斷改進,以保證脊柱矯形術的術中安全。

