一步水熱法制備氮摻雜碳點用于Fe3+檢測及細胞成像
齊海燕,黃德敏,衣同輝,劉立琨,劉春彤
(1.齊齊哈爾大學 化學與化學工程學院,黑龍江 齊齊哈爾 161006;2.齊齊哈爾醫學院 科研處,黑龍江 齊齊哈爾 161000;3.齊齊哈爾醫學院 醫藥科學研究院,黑龍江 齊齊哈爾 161000;4.齊齊哈爾大學黑龍江省工業大麻加工技術創新中心,黑龍江 齊齊哈爾 161006)
鐵(Fe)作為生物體不可缺少的痕量金屬元素之一,在氧攝取、氧代謝和電子轉移等過程中發揮著重要作用,Fe 缺乏或過量均會導致疾病的發生。Fe 缺乏會引起貧血癥,Fe 超標則會引起胰腺、心臟、肺部等功能器官障礙。有研究表明,阿爾茲海默疾病和帕金森癥與Fe 有密切關系[1]。美國環境保護署(UEPA)和世界衛生組織(WHO)規定飲用水中Fe含量不得超過5 μmol/L[2],故準確、定量檢測Fe3+對環境保護和人類健康具有重要意義。
目前,已有多種方法可以實現金屬離子的檢測,如原子吸收光譜法[3]、電化學法[4]、電感耦合等離子體質譜法[5]等。雖然這些方法具有較高的靈敏度,但其操作較復雜、耗時,測試成本高,且選擇性和穩定性差,樣品制備繁雜。熒光傳感分析法是利用被測離子與熒光傳感器接觸后發生熒光增強、猝滅或波長改變進行檢測的一種分析方法,具有操作簡單、分析迅速,穩定性和選擇性較高等優點,并且樣品前處理簡單、測試響應時間短,已受到越來越多的關注。
碳點是一種具有熒光特性的碳基納米顆粒,光學性能優異,穩定性較好,并且具有合成簡便[6]、生物毒性低[7]、生物相容性好[8]、水溶性好[9]、易于表面修飾和復合[10]等優點,被廣泛用于生物體內載藥治療[11-13]、生物成像[14-15]、分析檢測[16-21]、能源轉化[22]等領域。由于碳點表面含有豐富的羧基、羥基、氨基等基團,賦予了其在分析檢測領域的眾多優異性能。碳點可通過靜電作用力、電子或能量轉移及共價鍵等作用,或是表面改性,實現生物分子、離子、微生物、藥物分子等的特異性檢測。多種物質(如金屬離子、陰離子、糖類、黃酮類等)對碳點的熒光強度有明顯的猝滅作用,因此可以碳點作為熒光探針對其進行檢測。現有的熒光碳點雖可靈敏檢測Fe3+,但存在熒光量子產率不高、檢出限不夠低等問題[23],因此制備一種熒光產率高且能靈敏檢測Fe3+的熒光碳點具有重要意義。
氨基酸結構中具有氨基和羧基,作為碳源可在碳點制備過程中實現氮原子摻雜,提升熒光量子產率。氨基酸作為一種生物分子,以其為前驅體所制備的碳點具有更好的生物相容性,可用于細胞標記或細胞成像。本研究以人體必需氨基酸色氨酸和蘇氨酸為碳源,采用一步水熱法合成了氮摻雜碳點(N-CDs),該碳點水溶性好、熒光量子產率高、生物相容性好、毒性低,對Fe3+有較好的選擇性和靈敏度,可用于實際生活飲用水中Fe3+的檢測。同時進行了碳點的細胞毒性和細胞成像研究。
1 實驗部分
1.1 試劑與儀器
色氨酸、蘇氨酸(天津市光復精細化工研究所);硫酸奎寧(北京伊諾科技有限公司);溴化鉀、CuSO4、MnSO4、NiSO4、SrCl2(天津科密歐化學試劑開發中心);鹽酸、HgCl2、CoCl2、SnCl2、Al2(SO4)3、PbSO4、CdSO4、HCl、NaOH、錫(北京化工廠);硫酸(吉林省高端化學工業有限責任公司);FeNH4(SO4)2·12H2O、Na2CO3(西安化學試劑廠);Zn粉(中國醫藥(集團)上海化學試劑公司);KCl、CaCl2、NaNO2、Zn(NO3)2(天津市化學試劑一廠);MgCl2、NaCl、NaF(天津市凱通化學試劑有限公司);H2O2(天津市大茂化學試劑廠);NaClO(天津市天力化學試劑有限公司)。以上試劑均為分析純,實驗用水為超純水。
人正常肝細胞株HL-7702(中國科學院細胞庫);胎牛血清(浙江天杭生物科技股份有限公司);DMEM(Dulbecco’s modified eagle medium)高糖培養基(美國Sigma-Aldrich 公司);胰蛋白酶-EDTA 消化液(北京索萊寶科技有限公司);CCK-8試劑盒和PBS緩沖液(安徽蘭杰柯科技有限公司);細胞培養瓶(美國康寧生命科學有限公司);玻底培養皿(安徽蘭杰柯科技有限公司)。
島津TU-1901 紫外可見光譜儀、GMB-2 凈水器(北京普析通用儀器有限公司);島津RF4301-PC 熒光分光光度計(日本島津責任有限公司);傅里葉變換紅外光譜儀(美國尼高力公司);ESCALAB250Xi 型X 射線光電子能譜儀(XPS)、CO2細胞培養箱(美國Thermo 公司);德國D8-FOCUS型X 射線粉末衍射儀(XRD,德國BRUKER-AXS 公司);JEM-2100F 型透射電子顯微鏡(日本電子株式會社);AMR-100全自動酶標分析儀(杭州奧盛儀器有限公司);Axio Observer熒光倒置顯微鏡(德國ZEISS公司);K78水熱反應釜(上海鞏義市英峪實驗儀器中心);移液槍(德拉貢實驗儀器(美國)有限公司);實驗室pH計PE20(梅特托利多儀器(上海)有限公司);WD-9403E紫外燈(北京市六一儀器廠)。
1.2 碳點的制備
以色氨酸和蘇氨酸為碳源,采用水熱法制備碳點。分別稱取0.511 0 g 色氨酸和0.894 0 g 蘇氨酸(摩爾比1∶3),溶于50 mL pH 2.0 的水溶液中,轉入5 個30 mL 的聚四氟乙烯反應釜中,置于烘箱于180 ℃反應8 h,待其自然冷卻至室溫后得到黃棕色的碳點水溶液。將該碳點溶液經5 000 r/min 離心10 min,除去大顆粒雜質,再通過分子量為500 D的透析袋連續透析65 h,得到粉紅色碳點水溶液,經冷凍干燥后得到淺黃色碳點粉末N-CDs。
1.3 Fe3+離子檢測
以FeNH(4SO4)·212H2O 為離子源,其溶解后電離產生的NH4+能很好地抑制Fe3+的水解。稱取FeNH4(SO4)·212H2O 固體配制成0.01 mol/L 的儲備液,取少量逐級稀釋至所需濃度。依次向2 mL 質量濃度為0.25 μg/mL的碳點溶液中加入3 μL不同濃度的Fe3+,使Fe3+的終濃度分別為0.5、1、5、10、15、20、25、30、35、40、45、50 μmol/L,共同孵育60 s后,以370 nm激發,記錄熒光發射光譜,繪制線性曲線。
1.4 選擇性實驗
以各金屬離子(Fe3+、Cu2+、K+、Mn2+、Mg2+、Sr2+、Na+、Co2+、Cd2+、Ca2+、Hg2+、Pb2+、Ni2+、Zn2+、Al3+和Sn2+)和氧化性、還原性離子(Cl-、NO?2、F-、NO?3、ClO-、CO)的可溶性鹽以及H2O2配制濃度均為0.01 mol/L 的檢測溶液。向2 mL質量濃度為0.25 μg/mL的碳點溶液中加入金屬離子溶液,使其終濃度為0.5 mmol/L,共同孵育60 s后,以370 nm激發,記錄熒光發射光譜。
1.5 生活飲用水中Fe3+的測試
以本地市售瓶裝飲用礦泉水為實際樣品進行檢測,直接使用。將4 mL 礦泉水與10 μL 質量濃度為0.1 mg/mL 的碳點溶液共同孵育60 s,記錄370 nm 激發波長處的熒光強度,將該值帶入“1.3”獲得的線性方程,得到瓶裝飲用水中Fe3+的濃度。
1.6 細胞毒性及細胞成像
HL-7702 細胞毒性實驗:人正常肝細胞株HL-7702 采用含10%胎牛血清的DMEM 高糖培養基于37 ℃,5%CO2培養箱中培養,待細胞生長至對數生長期時用胰蛋白酶-EDTA 消化液消化,用10%胎牛血清的DMEM 高糖培養基吹打成單細胞懸液后,按照0.5×104/孔的密度將細胞接種于96 孔板中,置37 ℃繼續培養。顯微鏡下觀察,待細胞鋪滿后進行實驗。
碳點用DMEM 高糖培養基溶解并無菌過濾后,以DMEM 培養基梯度稀釋為6 個質量濃度(100、200、300、400、500、600 μg/mL);按100 μL/孔加入HL-7702 細胞中,每組設置4 個復孔,對照組加入相同體積DMEM 高糖培養基。置于37 ℃孵育24 h后,按20 μL/孔加入CCK-8檢測試劑,孵育1 h后于450 nm測定吸光度。進行細胞存活率測定:存活率=(實驗組OD值/對照組OD值)×100%[24]。
HL-7702細胞成像實驗:按細胞毒性實驗相同方式培養HL-7702細胞,待細胞生長至對數生長期時按照1×106個/皿接種于玻底培養皿中,待細胞增長至培養皿的80%底面積左右時,按1 mL/孔加入質量濃度為300 μg/mL的碳點溶液。培養24 h后,以磷酸鹽緩沖溶液(PBS)洗滌2次去除殘留碳點,然后在熒光顯微鏡下觀察細胞形態。加入終質量濃度為10、20、40 μg/mL的Fe3+繼續孵育5 min后,觀察Fe3+的猝滅效果。
2 結果與討論
2.1 碳點結構表征
N-CDs 的透射電鏡表征結果顯示,碳點呈近似球形(圖1A),高分辨率透射電鏡圖(圖1B)顯示其晶格間距為0.21 nm,粒徑分布在3~5 nm之間,平均粒徑為4.1 nm(圖1A插圖)。N-CDs的XRD譜如圖1C所示,在23°附近有一個明顯的衍射峰,對應石墨結構碳的(002)晶面,證明所制備的碳點具有與石墨類似的結構[22]。圖1D 為碳點的紅外吸收光譜,由圖可知,3 410 cm-1處為—OH 的伸縮振動;2 930 cm-1和2 890 cm-1處的吸收峰為飽和C—H 鍵的伸縮振動,1 630 cm-1處為N—H 的變形振動,1 513~1 410 cm-1之間的3 個峰為吲哚環的吸收峰,1 335~1 200 cm-1處的弱吸收帶為N—H 彎曲振動與C—N伸縮振動偶合形成的酰胺帶,1 112 cm-1處是C—O的伸縮振動峰。
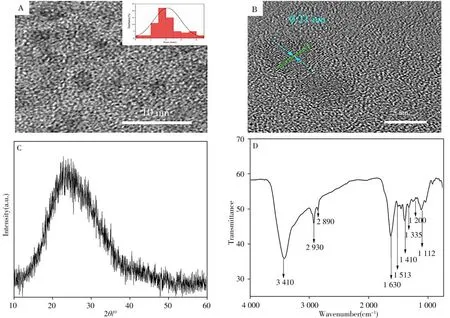
圖1 N-CDs的高分辨率透射電鏡圖(A)、晶格條紋(B)、X射線衍射光譜(C)和FTIR譜圖(D)Fig.1 High-resolution TEM(A),lattice fringes(B),XRD(C)and Fourier transform infrared(FTIR)spectrum(D)of N-CDs
碳點的XPS表征結果見圖2A,全掃描譜中,532.2、399.8、285.0 eV處分別為O1s、N1s和C1s的特征峰,說明該碳點主要由C、N、O 3種元素組成;C、N和O的原子比為70.8%、8.4%和20.8%。對C1s的特征峰進行分解,得到284.5、286.4、288.5 eV 3個峰(圖2B),分別與C—C/C===== C、C—O、C===== O官能團對應。N1s的分解峰在399.8、402.2 eV處(圖2C),表明氮元素主要以C—N鍵和N—H鍵的形式存在。在530.9、532.6 eV處的O1s峰(圖2D)分別歸屬于C===== O和O—C鍵[25-27]。結合紅外吸收光譜,可以證明碳點表面含有—OH、—COOH、—NH2、吲哚等結構,因此制備的碳點易于修飾且具有良好的水溶性。
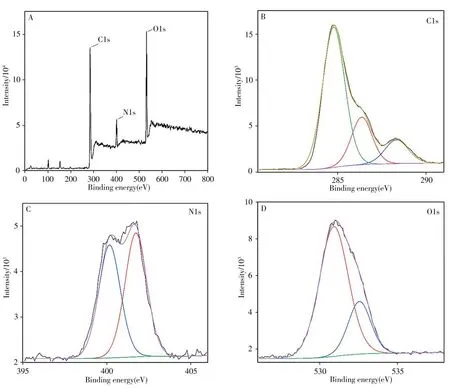
圖2 N-CDs的XPS全譜圖(A)與C1s(B)、N1s(C)、O1s(D)的高分辨率XPS譜圖Fig.2 XPS(A)and C1s(B),N1s(C),O1s(D)high-resolution XPS patterns of N-CDs
2.2 碳點的光學性質
通過測定得到所制備碳點的熒光量子產率為87.09%。N-CDs 在水溶液中的紫外吸收光譜如圖3A所示,在278 nm 處的強吸收峰為B 吸收帶(π→π*),表明碳點具有C===== C 共軛結構;在360 nm 處的弱吸收峰為R 吸收帶(n→π*),說明碳點結構中具有n電子的生色基團(羰基)且存在與其共軛的結構。圖3A 插圖為N-CDs 水溶液的圖片,其在自然光下呈淡粉色,在365 nm 紫外燈照射下則發出藍色熒光。由圖3B 可知,N-CDs 的最佳激發波長為370 nm,發射峰位置為440 nm,后續實驗均在最佳激發波長下進行。圖3C 顯示,激發波長在320~400 nm 內改變時,熒光強度發生變化,但其發射峰位置未發生變化,與文獻[28]的結果對比可知此碳點無激發波長依賴性。
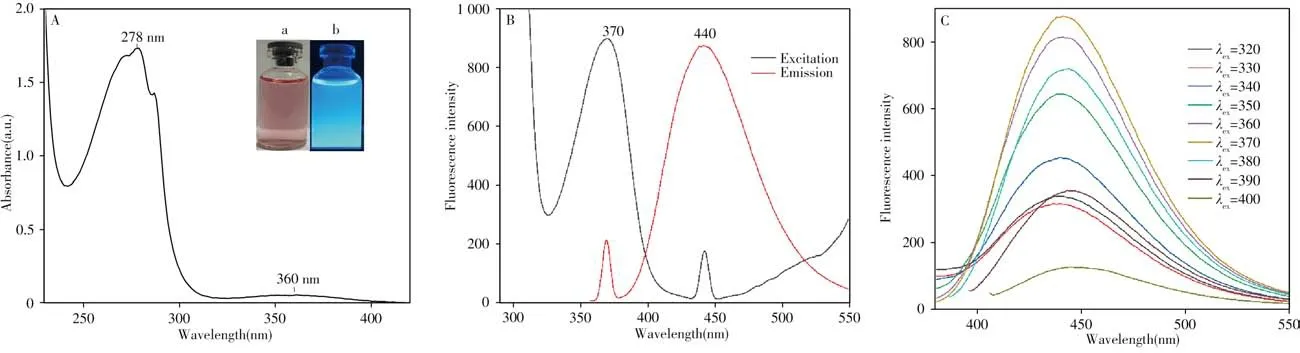
圖3 N-CDs的紫外吸收光譜(A)、熒光光譜(B)和熒光發射光譜(C)Fig.3 UV spectra(A),fluorescence spectra(B)and fluorescence emission spectra(C)of N-CDs
2.2.1 離子強度的影響為了研究離子強度對N-CDs 熒光強度的影響,在3 mL 不同濃度的NaCl(pH 7.0)溶液中加入3 μL 質量濃度為0.25 μg/mL 的碳點溶液,使碳點的終質量濃度為0.083 3 μg/mL,記錄熒光強度。結果發現隨著NaCl濃度的增加,碳點的熒光強度未發生顯著變化,表明制備的碳點具有較好的耐鹽性。進一步考察了碳點的光學穩定性,取2 μL質量濃度為0.25 μg/mL的碳點溶液,加入2 mL(pH 7.0)超純水中,使碳點的終質量濃度為0.125 μg/mL。結果發現,N-CDs 的熒光強度在一周之內基本不變,證明該碳點有較好的光學穩定性。
2.2.2 pH 值的影響將碳點用于實際檢測時,環境中的pH 值將會對碳點產生影響,因此需對實驗環境的pH值進行優化以提高檢測靈敏度。在3 mL pH 值為1.0、2.0、3.0、4.0、5.0、6.0 的一系列鹽酸溶液中,以及pH值為7.0、8.0、9.0、10.0、11.0、12.0、13.0和14.0的氫氧化鈉溶液中,加入3 μL 質量濃度為0.125 μg/mL的碳點溶液,使其終質量濃度為0.041 7 μg/mL,記錄熒光強度,結果如圖4 所示。隨著酸性增強,碳點的熒光強度有所減弱;隨著堿性增強,熒光則顯著猝滅,表明該碳點適用于弱酸和中性條件。
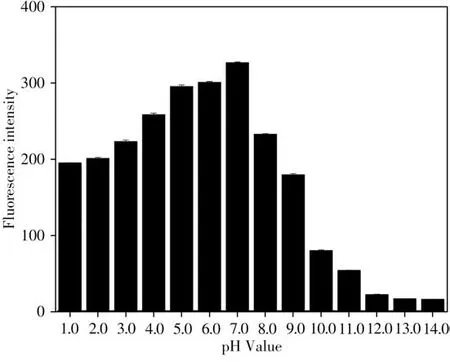
圖4 pH值對N-CDs熒光強度的影響Fig.4 Effect of pH value on fluorescence intensity of N-CDs
2.3 N-CDs檢測Fe3+離子的原理
根據FTIR 數據可知,N-CDs 表面存在羧基、氨基或羥基等有機基團,這些基團增強了N-CDs 對Fe3+的親和性。Fe3+有3 個正電荷,有利于光誘導電子從N-CDs 轉移到Fe3+的d 軌道,與Fe3+選擇性配位形成配位鍵(圖5),形成的配合物可以改變N-CDs的電子結構,影響激發電子的分布,并通過有效的光電子或能量轉移加速激發電子的非輻射重組,進一步導致熒光猝滅[29-31]。
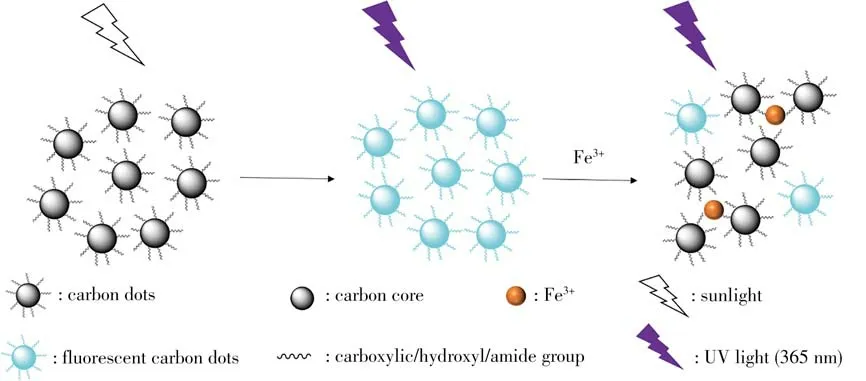
圖5 N-CDs檢測Fe3+離子的猝滅原理圖Fig.5 Schematic of quenching mechanism of N-CDs for Fe3+ion detection
2.4 線性關系及檢出限
考察了N-CDs 對Fe3+的響應情況,結果發現,隨著鐵離子濃度的增加,碳點熒光強度逐漸降低,這是因為Fe3+離子濃度越大,越容易與碳點表面的含氧官能團進行配位,熒光猝滅越明顯。分別以I0和I表示Fe3+加入前后N-CDs的熒光強度,以I0/I對鐵離子濃度作圖,結果顯示,Fe3+濃度在1~20 μmol/L和20~50 μmol/L 范圍內與I0/I具有良好的線性關系,其線性方程分別為I0/I=0.001 09[Fe3+]+1.011 7、I0/I =0.003 81[Fe3+]+0.954 9,相關系數分別為r2=0.999 4、r2=0.997 3。對Fe3+的檢出限(S/N=3)為0.36 μmol/L。與文獻報道的Fe3+的檢測方法相比(表1),本方法具有較低的檢出限。
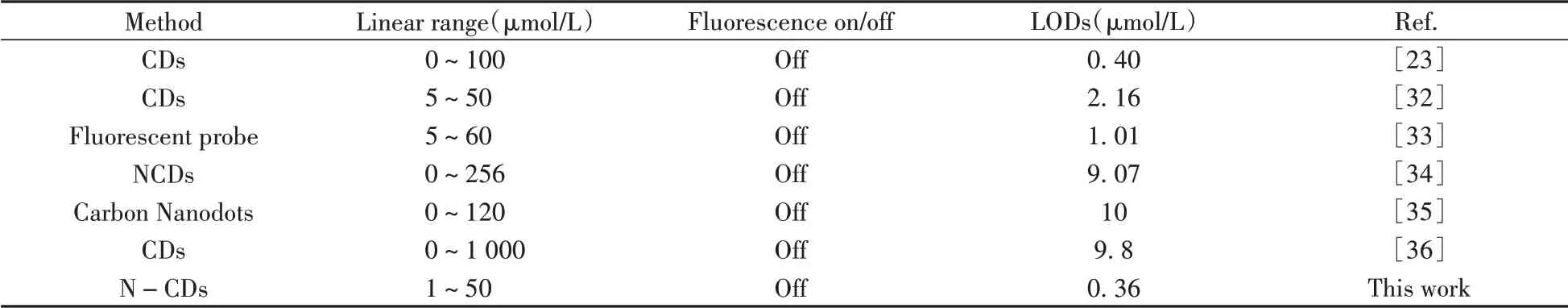
表1 不同熒光檢測法對Fe3+檢測性能的比較Table 1 Comparison of performance of different fluorescence methods for detection of Fe3+
2.5 選擇性
進一步考察了N-CDs 對Fe3+的選擇性,在N-CDs溶液中分別加入相同濃度的金屬離子以及具有氧化性和還原性的物質。結果顯示N-CDs 對Fe3+的響應最為顯著(圖6),證明該碳點對Fe3+具有良好的選擇性,可用于實際樣品中Fe3+的檢測。
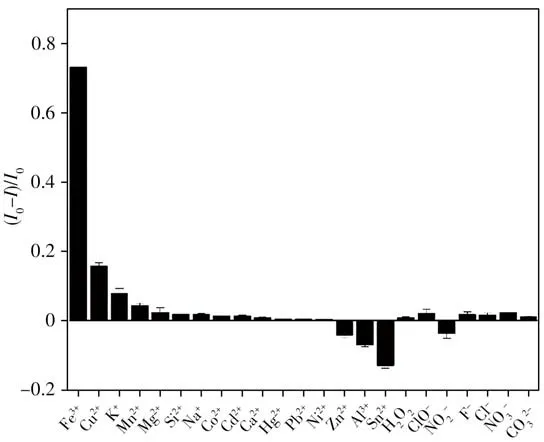
圖6 N-CDs對Fe3+的選擇性Fig.6 Selectivity of N-CDs to Fe3+
2.6 實際樣品測定
為評估該方法的可行性,將N-CDs用于生活飲用水中鐵離子的檢測,水樣為當地超市售賣的某瓶裝飲用礦泉水。檢測發現該碳點對該瓶裝礦泉水無明顯響應,即未檢出Fe3+。利用原子吸收光譜法對同一樣品進行檢測,同樣未檢測到鐵離子。為了進一步驗證本方法的準確性,向待測水樣中加入不同濃度(5、10、15 μmol/L)的鐵離子標準溶液進行加標回收實驗,結果如表2所示。瓶裝礦泉水中Fe3+的回收率為97.3%~107%,相對標準偏差(RSD)不大于2.0%。國標生活飲用水衛生標準(GB 5749-2006)中的鐵含量為0.3 mg/L(即5 μmol/L)[37],高于本方法的檢出限,證明該方法可以用于生活飲用水中鐵離子濃度的檢測。

表2 生活飲用水中Fe3+的加標回收率Table 2 Recoveries of Fe3+spiked in drinking water
2.7 細胞毒性及細胞成像
熒光碳點由于具有優異的光學性能、較低的毒性以及良好的生物相容性,被廣泛應用于熒光探針領域。N-CDs 具有高的熒光量子產率,適合作為熒光探針標記HL-7702 細胞。材料能否作為生物探針的一個重要指標是細胞毒性的高低。采用CCK-8 比色法測試碳點的生物毒性。如圖7A 所示,將HL-7702 細胞分別在不同質量濃度(100、200、300、400、500、600 μg/mL)的碳點中培養24 h,發現即使碳點質量濃度為600 μg/mL,細胞活性仍高達94.46%。表明該碳點具有相當低的細胞毒性,是作為熒光探針標記細胞進行細胞成像實驗的理想材料,且其最佳質量濃度為300 μg/mL(圖7A)。
將碳點與HL-7702 細胞共同孵育后,通過熒光倒置顯微鏡觀察,發現HL-7702 細胞形態無明顯變化(圖7B),說明該碳點對細胞沒有損傷,具有良好的生物相容性;在365 nm條件下觀察,發現細胞膜和細胞質均有強烈熒光(圖7C),表明該碳點很容易進入細胞內部,有望運用于載藥治療領域[38]。該碳點能夠特異性識別Fe3+,在細胞內與Fe3+共同孵育時,隨著Fe3+濃度升高,熒光逐漸猝滅(圖7D-F)。實驗表明該碳點可用于細胞成像,且能實現活細胞內鐵離子的可視化。
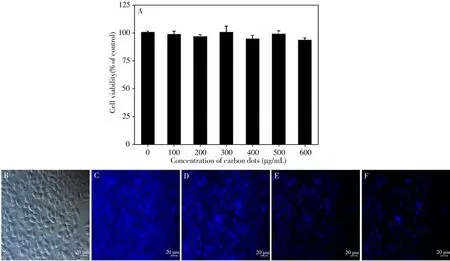
圖7 N-CDs的細胞毒性(A),HL-7702細胞與300 μg/mL碳點孵育后的圖像(B),HL-7702細胞與300 μg/mL碳點孵育后的熒光圖像(C),HL-7702細胞與300 μg/mL碳點以及10 μg/mL(D)、20 μg/mL(E)、40 μg/mL(F)Fe3+共孵育的熒光圖像Fig.7 Cytotoxicity of N-CDs(A),the image of HL-7702 cells incubated with 300 μg/mL carbon dots(B),the fluorescence image of HL-7702 cells incubated with 300 μg/mL carbon dots(C),the fluorescence images of HL-7702 cells incubated with 300 μg/mL carbon dots with 10 μg/mL(D),20 μg/mL(E),40 μg/mL(F)Fe3+
3 結 論
采用生物相容性優異的天然氨基酸分子色氨酸和蘇氨酸作為前驅體,利用一步水熱法制備了具有高熒光量子產率、光穩定性和耐鹽性好的N 摻雜熒光碳點。基于碳點對Fe3+的高選擇性猝滅響應,建立了鐵離子的檢測方法。該方法在1~20 μmol/L 和20~50 μmol/L 范圍內具有良好的線性,檢出限(S/N=3)為0.36 μmol/L。方法準確性高,可用于實際水樣中鐵離子的檢測。該碳點細胞毒性低,已成功用于生物體外細胞成像且實現了細胞內Fe3+的可視化,為生物體內Fe3+可視化定量檢測提供了一種可能的途徑。

