抗黃曲霉毒素B1多價納米抗體融合蛋白的構建及活性分析
帥文苑,何慶華,鐘引鳳,黃云祥,張 航,劉傳勇,張樂平,涂 追*
(1.南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047;2.南昌大學 食品學院,江西 南昌 330047;3.南昌大學 生命科學學院,江西 南昌 330031;4.江西省現代分析科學重點實驗室,江西 南昌 330031)
黃曲霉毒素B1(AFB1)是由黃曲霉和寄生曲霉產生的有毒次級代謝產物[1-2],主要存在于發霉的花生、玉米、大米等農產品中[3-4],AFB1具有致癌性、致突變性、致毒性等,已被世界衛生組織的癌癥機構劃定為Ⅰ類致癌物。目前,檢測農作物中AFB1的方法包括高效液相色譜法(HPLC)[5-6]、免疫傳感器法[7]、免疫層析法(ICA)[8-9]、酶聯免疫吸附法(ELISA)[10-11]等。免疫學檢測方法基于抗體與抗原特異性結合,具有簡便、高特異性、高靈敏度及高通量等優點。現有的AFB1免疫學檢測方法采用的抗體主要有單克隆抗體、單鏈抗體等,然而單克隆抗體的制備較為繁瑣,細胞培養及儲存環境要求嚴格;單鏈抗體表達量低且常以包涵體的形式存在,應用受到一定的限制[12]。納米抗體是通過克隆重鏈抗體的可變區并表達得到由一個重鏈抗體可變區構成的單域抗體(Variable domain of heavy chain of heavy chain antibody,VHH)[13],具有與原重鏈抗體相當的結構穩定性以及抗原結合活性,是目前已知的可結合目標抗原的最小單位,具有水溶性高,溫度及pH耐受性好等優點。納米抗體由于結構簡單,適合于原核(如大腸桿菌)和真核表達系統進行高效表達,易于獲得,已廣泛應用于醫療[14]、診斷[15]、免疫分析[16]等領域。
增加免疫學檢測方法中識別元件對待檢物的親和活性是提高檢測靈敏度的主要途徑之一[17]。已有研究表明,相比于單價納米抗體,多價抗體形式具有更高的表觀親和力,有望建立靈敏度更高的免疫學檢測方法[18-19]。本課題組前期從羊駝免疫庫中篩選獲得了針對黃曲霉毒素B1的納米抗體(命名為G8),并將其應用于黃曲霉毒素的ELISA 檢測以及樣品前處理[20]。本研究以前期獲得的抗AFB1納米抗體G8為研究對象,利用納米抗體分子量小,易于基因操作、原核表達的特點,通過串聯融合表達的方法,構建了單價以及多價納米抗體串聯體,并分別與綠色熒光蛋白(GFP)編碼片段融合,研究了多價化及融合表達對重組蛋白生物活性的影響,為后續建立基于熒光信號的免疫學檢測方法奠定了基礎,同時也可為優化免疫學檢測中納米抗體親和活性提供了借鑒和思路。
1 實驗部分
1.1 儀器與試劑
Varioskan LUX 多功能讀數儀(美國Thermo 公司);ZHWY-2102C 恒溫搖床(中科院武漢科學儀器廠);JY92-ⅡDN 超聲波細胞粉碎機(寧波新藝超聲設備有限公司);LAS 500 凝膠成像儀(BIO-RAD公司);DYY-8C 電泳儀(北京六一儀器廠);Nanodrop 1000 超微量分光光度計(美國Thermo 公司);DHG-9101·DSA 恒溫培養箱(上海三發科學儀器有限公司);T100TMPCR 擴增儀(BIO-RAD 公司);NK-420 電熱恒溫水箱(常州諾基儀器有限公司);YLC-100 干式恒溫器(江蘇金怡儀器科技有限公司);Sorvall Stratos低溫高速離心機(美國Thermo公司)。
含單價以及二價、三價抗AFB1納米抗體的質粒pET30-G8、pET30-DiG8、pET30-TriG8,含綠色熒光蛋白的質粒PMCSG18hRahs-GFP,大腸桿菌DH5α、BL21(DE3)均由本實驗室保存;人工抗原AFB1-BSA 由本實驗室制備[21];氯化鈉(NaCl)、磷酸氫二鈉(Na2HPO4)、氯化鉀(KCl)、磷酸二氫鉀(KH2PO4)均為分析純,購自上海阿拉丁生化科技公司;Lysis 平衡緩沖液(LE Buffer:50 mmol/L Na2HPO4,0.3 mol/L NaCl,pH 8.0);磷酸鹽緩沖溶液(0.01 mmol/L PBS:137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH 7.4);含0.05%吐溫-20 的0.01 mmol/L 磷酸鹽緩沖溶液(PBST);卡那霉素(Kana)、異丙基-β-D硫代吡喃半乳糖苷(IPTG)購自索萊寶公司;限制性內切酶SfiⅠ、NotⅠ、NdeⅠ,T4DNA 連接酶(TakaRa 公司);HRP 標記His 標簽鼠單克隆抗體(Proteintech)、Ni2+-NTA 親和層析(金斯瑞生物科技);DNA 片段純化試劑盒(MiniBEST DNA Fragment Purification Kit Ver.4.0)(貨號9716)、瓊脂糖凝膠回收試劑盒(MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0)(貨號9762)(TakaRa 公司);質粒產物小提試劑盒(DP103-02,天根公司);經PAGE 純化的引物由金斯瑞生物科技公司合成(見表1)。

表1 引物列表Table 1 List of primers
1.2 實驗方法
1.2.1 原核表達載體的構建原核表達載體pET30-G8-GFP、pET30-DiG8-GFP、pET30-TriG8-GFP 的構建方法如圖1 所示。經引物(G8-F0、G8-R0)獲得G8 編碼片段,限制性內切酶NdeⅠ和SfiⅠ將編碼G8的基因克隆至載體pET30以獲得載體pET30-G8。DiG8、TriG8通過含有編碼柔性linker(GGSGG)的引物(G8-F1、G8-R1)及引物G8-F0、G8-R0 進行重疊延伸PCR(overlap PCR)而得,同樣經由限制性內切酶NdeⅠ和SfiⅠ構建得到載體pET30-DiG8、pET30-TriG8。pET30-G8、pET30-DiG8、pET30-TriG8和由引物(F0、R0)擴增得到的GFP編碼片段,用SfiⅠ和NotⅠ分別進行雙酶切,試劑盒回收上述酶切片段。將純化得到的載體與目的片段按1∶3的摩爾比用T4DNA連接酶于16 ℃孵育過夜,連接產物電轉化大腸桿菌DH5α 感受態細胞,涂布于含50 μg/mL 卡那霉素的LB(LBKana)平板,37 ℃培養12 h。采用引物T7 prom和T7 term對單克隆進行菌落PCR驗證,陽性克隆提取質粒后再進行雙酶切驗證,雙酶切與預期相符的克隆送至南京金斯瑞生物科技公司測序。

圖1 抗AFB1納米抗體融合蛋白表達載體構建示意圖Fig.1 Schematic of construction of anti-aflatoxin B1 nanobody fusion protein expression vector
1.2.2 納米抗體的融合表達及純化經測序驗證結果正確的重組表達載體pET30-G8-GFP、pET30-DiG8-GFP、pET30-TriG8-GFP,電轉化大腸桿菌BL21(DE3)感受態細胞,涂布于含50 μg/mL卡那霉素的LB(LB-Kana)平板,37 ℃培養12 h;挑取平板中的單菌落接種于含卡那霉素的5 mL LB 液體培養基中,37 ℃恒溫搖床220 r/min 培養12 h;上述菌液按1%的比例接種于1 L LB-Kana 液體培養基中,37 ℃恒溫搖床220 r/min 培養至OD600值為0.6 ~ 0.8(約2~3 h);上述培養液中加入IPTG 至終濃度為0.5 mmol/L,18 ℃過夜誘導培養。將誘導培養物6 500 r/min離心15 min,棄上清,收集菌體;1/10體積的LE 緩沖液重懸菌體,冰浴中超聲波破碎菌體至澄清,破碎后的菌體于6 500 r/min 條件下離心20 min,分別收集破碎上清和沉淀。采用Ni2+-NTA 親和層析純化融合蛋白,SDS-PAGE 分析蛋白表達及純化情況。
1.2.3 未融合、單價及多價納米抗體的活性分析采用間接ELISA 分析重組蛋白與人工抗原的結合活性。將溶于PBS(pH 7.4)的人工抗原AFB1-BSA 以100 μL/孔加至酶標孔中,4 ℃包被過夜;PBST 洗板3次,加入5%脫脂牛奶,300 μL/孔,37 ℃封閉2 h;PBST 洗板3次,加入100 μL/孔重組蛋白G8(未融合、單價及多價),37 ℃孵育1 h;PBST 洗板3 次,加入100 μL/孔HRP 標記His 標簽鼠單克隆抗體,37 ℃孵育1 h;PBST 洗板3 次,加入100 μL/孔TMB 底物顯色液,37 ℃孵育10 min;加入50 μL/孔2 mol/L H2SO4終止反應,于酶標儀中測定OD450值。間接競爭ELISA 與間接ELISA 步驟基本相同,但在加入重組蛋白G8 時,應同時加入50 μL/孔重組蛋白G8(未融合、單價及多價)及50 μL/孔AFB1標準品(200、100、50、25、12.5、6.25、3.125、1.56、0.78、0.39、0.20、0 ng/mL)進行競爭反應。
1.2.4 重組蛋白的熒光檢測在酶標板中分別加入相同濃度重組蛋白(G8-GFP、DiG8-GFP、TriG8-GFP)200 μL,放入多功能讀數儀中,于熒光光譜模式下先設定激發波長為472 nm,掃描490~650 nm范圍內的發射光譜;再設定發射波長為507 nm,掃描350~490 nm范圍內的激發光譜,繪制激發及發射光譜圖,并分別記錄其最大激發和發射波長,及對應熒光強度。
2 結果與討論
2.1 原核表達載體的構建
采用通用引物分別進行菌落PCR,結果顯示獲得了符合預期大小的基因片段(圖2A)。將菌落PCR陽性的克隆提取質粒,pET30-G8-GFP、pET30-DiG8-GFP和pET30-TriG8-GFP 三種重組質粒經SfiⅠ和NotⅠ雙酶切驗證后均出現兩條帶,酶切后的3種載體片段5 633 bp、6 026 bp、6 419 bp和GFP基因片段745 bp與預期相符(圖2B),經DNA測序證明三種表達載體構建正確。

圖2 菌落PCR驗證及重組質粒的雙酶切驗證Fig.2 Identification of colony PCR and double digestion of recombinant plasmid by agarose gel electrophoresis
2.2 融合蛋白的表達與純化
將三種重組質粒pET30-G8-GFP、pET30-DiG8-GFP、pET30-TriG8-GFP 電轉化大腸桿菌表達菌株BL21(DE3),經終濃度為0.5 mmol/L IPTG于18 ℃條件誘導表達12 h,分別收集誘導前后的菌體。SDS-PAGE顯示,三種蛋白均可在大腸桿菌BL21(DE3)中可溶性表達,且經Ni2+-NTA親和層析純化得到的蛋白G8-GFP、DiG8-GFP、TriG8-GFP 的條帶位置與預期分子量42.87、57.24、70.57 kDa大小保持一致。經試劑盒定量,三種蛋白的表達量分別為6.0、7.5、4.0 mg/L,且本實驗未進行表達條件的優化,通過優化表達條件如誘導溫度、誘導時間、IPTG 濃度等有望進一步提高表達量[20]。三種蛋白在表達過程中,融合蛋白G8-GFP 與DiG8-GFP 可溶性表達較多,易于破碎;而融合蛋白TriG8-GFP 包涵體表達占多數,較難破碎,推測由于該融合蛋白的分子量較大,蛋白在折疊過程中易以聚集形式表達形成包涵體,可溶性表達低,由此可以推測多價納米抗體串聯數目較多時,較難獲得可溶性蛋白。

圖3 三種融合蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of expression and purifi?cation of three fusion proteins
2.3 單價及多價納米抗體的活性分析
采用間接ELISA對三種融合蛋白的結合活性進行分析,結果顯示三種融合蛋白(G8-GFP,DiG8-GFP,TriG8-GFP)均能特異性結合人工抗原AFB1-BSA,說明納米抗體在多價化后仍然保持抗原識別活性(圖4)。經方陣滴定,確定人工抗原AFB1-BSA的工作濃度為2.5 μg/mL,融合蛋白G8、G8-GFP、DiG8-GFP 以及TriG8-GFP 的最佳工作濃度分別為0.5、2.125、3.125、8.90 μg/mL。
以AFB1標準品進行間接競爭ELISA,結果表明,G8、G8-GFP 以及DiG8-GFP 建立間接競爭ELISA 的IC50分別為12.10、14.10、2.19 ng/mL,提示單價融合蛋白IC50與未融合蛋白相似,雙價融合蛋白IC50較未融合蛋白提高了5.5倍(圖5)。三價融合蛋白TriG8-GFP的靈敏度降低,與標準品競爭趨勢不明顯,未能計算得到IC50值(圖5),該結果與本實驗室前期工作相吻合[22],推測可能是該融合方式對蛋白表達與折疊存在一定的影響。He 等[23]通過柔性連接子Linker(G4S)3共15個氨基酸構建多價納米抗體,將其生物素化并固定在鏈霉親和素衍生的細菌磁性納米顆粒上,用于檢測四溴雙酚A,結果顯示多價納米體的結合活性由高到低依次為:三價、二價、一價。本研究構建的多價納米體同樣采用了柔性Linker,然而長度僅為前者的三分之一,提示納米抗體的連接方式對活性有較大的影響。融合GFP蛋白的ELISA 數據偏差較未融合GFP 更大,且背景吸附值較高(圖4、5),ELISA 的條件有待進一步優化以降低背景吸附和提高精密度。TriG8-GFP 由4 個串聯的結構域組成,在表達過程中可能未完全正確折疊,導致非特異性吸附而不能被標準品阻斷。

圖4 間接ELISA分析3種融合蛋白的活性Fig.4 Bioactivity analysis of three fusion proteins by indirect ELISA

圖5 間接競爭ELISA分析G8、G8-GFP、DiG8-GFP及TriG8-GFP的活性Fig.5 Indirect competitive ELISA of bioactivity analysis of G8,G8-GFP,DiG8-GFP and TriG8-GFP
2.4 重組蛋白的熒光檢測
同一濃度(0.70 mg/mL)三種融合蛋白(G8-GFP、DiG8-GFP、TriG8-GFP)的熒光光譜如圖6 所示。三種融合蛋白的最大激發波長均在472 nm左右,最大發射波長均在507 nm左右,與GFP相比最大激發和發射波長未發生改變。融合蛋白G8-GFP 與DiG8-GFP 的熒光強度均在3 000 及以上,與GFP相當且DiG8-GFP 表現出更高的熒光強度,而融合蛋白TriG8-GFP 的熒光強度僅在1 700 左右,相對熒光強度最弱(圖6)。在表達過程中,推測三價串聯的納米抗體的融合蛋白TriG8-GFP的分子量較大,納米抗體與熒光蛋白在表達過程中未能正確折疊,使得其熒光強度降低。由此推測,三價納米抗體串聯與熒光蛋白融合表達可能會影響其熒光活性,從而對基于熒光活性的免疫學檢測存在一定干擾。
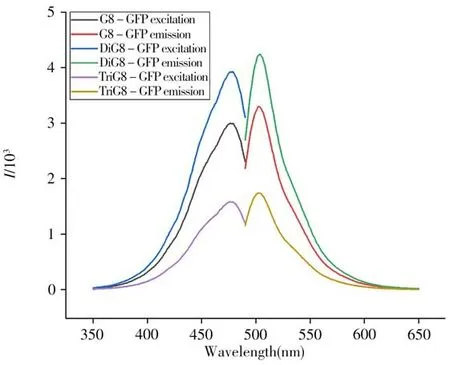
圖6 三種融合蛋白的激發及發射光譜圖Fig.6 Excitation and emission spectra of three fusion proteins
3 結 論
納米抗體因其特殊結構可在大腸桿菌系統中進行高效可溶性表達,且串聯后重組蛋白仍能可溶性表達。本研究以針對AFB1的納米抗體和GFP 建立了研究模型,單價融合蛋白與未融合納米抗體G8 相比結合活性并未顯示較大差異,而雙價納米抗體與重組蛋白G8相比IC50提高了5.5 倍,且融合后GFP 的熒光強度及最大激發和發射波長并未發生改變,同時二價融合蛋白熒光活性表現較高,表明通過串聯方式獲得的針對AFB1二價納米抗體的結合活性和熒光活性均較好。納米抗體多價化的方式主要包括聚集體形式、串聯表達等。本研究采用納米抗體直接串聯多價化方式,獲得的二價納米抗體與熒光蛋白的融合活性較好,為后續建立熒光免疫檢測方法奠定了基礎,具有一定的應用前景。

