高壓電脈沖技術在腫瘤治療領域的研究與應用進展
任馮剛,張雨馳,陳雪,吳榮謙,仵正,呂毅
1. 西安交通大學第一附屬醫(yī)院 a. 精準外科與再生醫(yī)學國家地方聯(lián)合工程研究中心;b. 肝膽外科,陜西 西安 710061;2. 西安交通大學 電氣科學與技術研究院,陜西 西安 710049
引言
惡性腫瘤嚴重威脅人類健康,疾病負擔極其嚴重。多數(shù)惡性腫瘤起病隱匿,早期并無明顯癥狀,導致大量病例在確診時已經處于中晚期,失去了根治性治療機會[1]。當前,以外科手術為主的綜合治療是實體腫瘤的主要治療模式,外科治療與化療、放療、局部治療、靶向治療、免疫治療等共同構成惡性腫瘤的全周期治療體系。盡管當前腫瘤治療水平已較過去取得很大提高,但是現(xiàn)有的腫瘤治療技術在適應證和治療效果上仍然存在一定局限,特別是針對中晚期腫瘤的治療手段和長期療效仍然有限,探索惡性腫瘤新的治療技術具有重要的臨床意義。
近三十年來,隨著生物醫(yī)學工程技術的不斷發(fā)展,涌現(xiàn)出多種基于電磁學、聲學和光學原理,借助外部物理因子能量在原位毀損腫瘤組織以實現(xiàn)腫瘤局部治療的新型醫(yī)療技術。同時,超聲、CT、MRI等醫(yī)學影像技術進一步促進了圖像引導下腫瘤消融技術在臨床的廣泛應用[2]。當前常見的腫瘤消融技術主要基于生物傳熱原理:將物理因子能量轉化成熱能后升高腫瘤組織的溫度,通過引起腫瘤組織發(fā)生不可逆性熱損傷實現(xiàn)消融目的,因此也被稱為熱消融技術,射頻、微波、高能聚焦超聲等是當前應用最為廣泛的熱消融技術。此外,還有通過降低組織溫度來實現(xiàn)消融治療的低溫冷凍消融技術[3]。熱消融技術易受組織熱力學性質、能量吸收效率和熱沉效應等影響,在臨床應用過程中易對熱敏感區(qū)域(如血管、膽道、神經等)產生不可逆性熱損傷,因而在臨床應用過程中存在一定限制[4]。
1 高壓電脈沖技術原理和生物效應特點
基于脈沖電場(Pulsed Electric Field,PEF)生物效應原理的高壓電脈沖技術是一種新型非熱能局部治療手段[5]。高壓電脈沖技術通常采用一定強度和數(shù)量的微秒方波電穿孔脈沖(Electroporation Pulse,EP)作用于腫瘤組織,利用消融電極在目標消融區(qū)內形成具有一定強度和形態(tài)分布的PEF,通過一連串EP不斷作用破壞腫瘤細胞膜和細胞環(huán)境穩(wěn)態(tài),最終導致細胞死亡[6]。由于EP在一個周期內的作用時間極短,電流經過組織所產生的焦耳熱可以很快擴散和吸收,組織最終累積的熱量很少,因此不會對組織產生熱損傷[7]。
研究發(fā)現(xiàn),不同脈寬、不同強度的EP作用引起的生物效應特點存在差異。通常認為,微秒脈寬EP作用可以改變細胞膜跨膜電位差,使細胞膜磷脂雙分子層形成大量微孔,增加細胞膜通透性,破壞細胞結構穩(wěn)定性,也被稱為細胞膜電穿孔效應[5]。若PEF強度較低,細胞膜結構在EP作用結束后可以恢復,細胞活性不受影響,也稱可逆電穿孔技術,當前主要用于電化學治療(Electrochemotherapy,ECT)和經皮遞藥[8]。若PEF強度較高,細胞膜結構在EP作用結束后不能恢復,同時細胞膜通透性增加加速細胞內外物質交換,可以破壞細胞環(huán)境穩(wěn)定性,最終導致細胞死亡,也被稱為不可逆電穿孔(Irreversible Electroporation,IRE)技術[9]。同時,EP會對腫瘤微環(huán)境帶來改變,包括激活腫瘤免疫反應、炎癥反應和引起局部微血管灌注改變等,也在細胞死亡中發(fā)揮作用[6]。納秒脈沖作用引起細胞死亡的機制目前仍存爭議,主流研究認為納秒脈沖可以作用于細胞器的膜結構,引起包括線粒體等細胞器膜結構和功能改變,但仍需進一步研究探索其內在機制[10-11]。
在宏觀層面,高壓電脈沖腫瘤消融技術的特點主要包括:① 電場依賴性:EP作用下腫瘤細胞的結局與EP波形特征、強度和數(shù)量等相關,且存在一定的強度依賴性。低強度EP作用并不會引起細胞死亡,甚至對細胞增殖、遷移和分化具有促進作用[12];一定數(shù)量的高強度EP對于細胞活性具有較為明顯的抑制作用;② 不依賴溫度:EP作用可以在不對組織產生熱損傷的情況下毀損細胞,因而可以較好地保護組織支架結構,對于蛋白等對溫度敏感的活性分子功能影響較小[13];③ 作用范圍可控:電場強度和分布范圍是決定消融結局的主要因素,主要與電極配置、脈沖參數(shù)、組織結構、電導率和介電常數(shù)等有關,可以利用數(shù)值仿真的方法在術前進行計算和估計,并通過調整脈沖參數(shù)和電極配置等方式進行調整和控制[14]。
2 高壓電脈沖技術在生物醫(yī)學領域的應用現(xiàn)狀
基于上述特點,當前高壓電脈沖技術在生命科學和醫(yī)學領域的應用主要包括殺菌消毒、細胞電融合、基因電轉染、ECT、心臟電生理治療和腫瘤組織消融等。其中,高壓電脈沖技術在殺菌消毒領域的應用歷史最為悠久,特別是在食品工業(yè)中利用高壓電脈沖對牛奶、飲料、蔬菜等進行滅菌處理,可以較好地保護食品口感,保存生物酶活性[15]。細胞電融合和電轉染技術在生物醫(yī)學研究領域有較為廣泛的應用,這類技術主要是利用可逆電穿孔原理,通過改變細胞膜通透性促進細胞膜發(fā)生融合,或促進外源性物質進入細胞[16]。美國Harvard Bioscience公司研制的BTX ECM系列電穿孔儀是當前實驗室較為常用的EP發(fā)生設備。常見的高壓電脈沖治療系統(tǒng)如圖1所示。
圖1 常見高壓電脈沖治療系統(tǒng)
ECT是高壓電脈沖技術在腫瘤治療領域最早的嘗試,這項技術主要是基于細胞膜可逆電穿孔原理,通過升高細胞膜通透性促進需要在胞內發(fā)揮作用的細胞毒性藥物(如博來霉素)入胞來殺傷細胞。意大利團隊研發(fā)的Cliniporator系統(tǒng)是較早獲批的ECT治療系統(tǒng),當前主要應用于皮膚原發(fā)或轉移腫瘤治療[8]。ECT需要EP和化療藥物聯(lián)合使用發(fā)揮抗腫瘤效應,利用IRE效應直接實現(xiàn)腫瘤消融的設想最早由美國UC Berkerly大學Rubinsky教授提出,該團隊于2007年成功研制首臺高壓電脈沖消融設備[9],相關技術由AngioDynamics公司技術轉化后于2011年經FDA批準上市,目前已在北美、歐洲和亞洲等多個國家和地區(qū)開展臨床研究,主要應用于中晚期胰腺癌、前列腺癌、肝癌和腎癌[6]。我國重慶大學電氣工程學院孫才新院士團隊也較早開展相關技術研究,在關鍵技術研發(fā)方面取得一定成果[17]。2021年以來,已經先后有兩款國產EP消融設備獲得NMPA批準上市。
3 高壓電脈沖技術在組織消融領域的研究進展
近年來,高壓電脈沖在腫瘤治療領域的臨床研究整體上呈現(xiàn)上升趨勢,國內外研究結果顯示該技術可以使常規(guī)治療無效的中晚期腫瘤患者在一定程度上獲益。在胰腺癌治療方面,NCCN指南已經將IRE列入局部進展期胰腺癌可采用的治療技術清單。在荷蘭阿姆斯特丹腫瘤中心開展的PANFIRE I/II期臨床研究中發(fā)現(xiàn),IRE治療后局部進展期胰腺癌患者的中位無事件生存期8個月,中位局部進展時間2個月,IRE治療后中位生存期11個月[18]。IRE治療后的主要潛在并發(fā)癥包括胰腺炎、膿腫、膽管炎、膽管梗阻、腸系膜上動脈狹窄、胃腸反應等。在隨后進行的PANFIRE-2 II期臨床研究中發(fā)現(xiàn),IRE聯(lián)合化療對于局部進展期胰腺癌患者的中位生存期為17個月,同時發(fā)現(xiàn)IRE治療同時是否進行FOLFIRINOX對生存無影響[19]。最近完成PANFIRE-3 I期臨床研究中將IRE與Nivolumab結合治療局部進展期胰腺癌,同樣獲得了較為理想的治療效果[20]。在原發(fā)性肝癌治療方面,已有研究將IRE用于不可切除的肝細胞癌、肝內膽管細胞癌的局部治療中,也有研究將IRE用于肝癌肝移植術前減瘤等。Sutter等[21]研究發(fā)現(xiàn),消融術后6個月無病生存率為87%,12個月無病生存率為70%,主要并發(fā)癥包括術區(qū)疼痛、氣胸、門脈血栓、肝衰等。該研究證實IRE對于不適用于常規(guī)局部根治性治療方法的原發(fā)性肝癌是安全和有效的。Martin等[22]研究了IRE用于不可切除的肝門部膽管癌,這部分病例由于腫瘤嚴重侵犯周圍門靜脈、肝動脈等結構,失去外科根治性治療機會,同時射頻等熱消融技術應用受限,常規(guī)治療手段有限。經IRE治療后患者中位生存期26個月,無進展生存期18個月。術后主要并發(fā)癥包括膽管梗阻部位消融后狹窄,常規(guī)置入膽道支架解除梗阻。該研究初步證實IRE可以有效控制肝門部膽管癌的進展,在一定程度上延長生存期。針對前列腺癌,來自國內外的研究報道均證實,IRE局部治療前列腺癌時具有對泌尿生殖功能低毒性特點,在治療腫瘤時不會對泌尿和生殖功能產生較大影響,對于前列腺癌治療具有重要意義[17,23]。
高壓電脈沖技術在腫瘤治療領域的研究與應用使其非熱消融的優(yōu)勢得以充分顯現(xiàn)。近年來,將高壓電脈沖技術用于心臟和血管內消融成為熱點應用方向。Reddy等[24]率先開展EP用于心臟腔內消融治療惡性心律失常的研究,證實其用于肺靜脈隔離治療的安全性。此后,該團隊進一步研究證實EP對食管、上腔靜脈等周圍熱敏感結構的安全性[25]。美國FARAPULSE公司(已被Boston Scientific收購)是全球較早開展高壓電脈沖技術在電生理治療領域的臨床轉化應用的公司之一,并將該技術命名為脈沖場消融技術(Pulsed Fields Ablation, PFA),其研制的FARASTAR系統(tǒng)已獲得FDA批準上市[7,26]。除此之外,全球已有10余種來自不同廠家的心臟EP消融系統(tǒng)獲批上市開展臨床研究。高壓電脈沖技術未來發(fā)展趨勢如圖2所示。
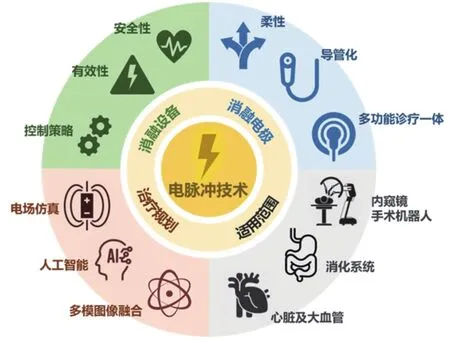
圖2 高壓電脈沖技術未來發(fā)展趨勢
4 高壓電脈沖技術未來發(fā)展趨勢
結合臨床需求和技術發(fā)展趨勢,我們認為高壓電脈沖技術在腫瘤治療領域仍具有進一步應用的潛力,其未來發(fā)展應當聚焦于以下四個方面。
4.1 腫瘤消融設備
在電力電子技術、脈沖功率技術和先進控制技術等發(fā)展下,提升生物醫(yī)用脈沖發(fā)生設備和關鍵核心部件的安全性、穩(wěn)定性,特別是通過優(yōu)化脈沖控制技術和策略,提升脈沖輸出的質量水平,通過心電同步等手段減少對機體電生理活動和骨骼肌的不良影響,消除醫(yī)生和患者“因電生畏”的心理,對于該技術的進一步臨床推廣和應用具有重要意義[24]。此外,當前成熟的消融設備主要基于微秒脈沖原理,納秒脈沖所需的閾值電場強度要遠高于微秒脈沖,對于消融設備輸出脈沖的電壓幅值要求較高,增加了設備的技術難度和安全性要求,特別是滿足醫(yī)用設備在電磁兼容、電氣安全等方面的要求,還需要開展進一步的理論研究和技術攻關。
4.2 消融電極
人體組織富有彈性,楊氏模量遠低于金屬,消融電極由傳統(tǒng)的剛性器件向柔性器件轉變是未來的發(fā)展方向。特別是將針刺式電極向導管化電極轉變,由微創(chuàng)向無創(chuàng)轉變,電極本身由單一功能向復合功能轉變,進一步提升消融電極的功能性,實現(xiàn)診療一體,準確判斷消融程度和范圍,減少因使用電極對人體帶來的額外損傷,是充分發(fā)揮消融技術優(yōu)勢的關鍵[27-28]。
4.3 治療規(guī)劃
基于高壓電脈沖技術電場依賴的特點,可以將其與智慧醫(yī)療技術、人工智能、多模圖像融合導航等技術相結合,進一步提升治療的精準性、安全性和有效性。通過降低脈沖參數(shù)設置和治療范圍規(guī)劃的難度,使臨床醫(yī)生和輔助人員更容易學習和接受這項技術。此外,當前高壓電脈沖用于細胞膜電穿孔或組織消融所需要的數(shù)學和物理模型研究還存在一些局限,特別是不同類型組織、不同類型細胞在EP作用下發(fā)生電損傷的規(guī)律和機制仍不完全明確,在缺少實驗數(shù)據(jù)的基礎上數(shù)值仿真模擬與真實數(shù)據(jù)會存在較大差異,這方面需要多學科交叉研究進一步解決[14,29-30]。
4.4 適用范圍
由當前主要應用的實體腫塊型腫瘤向腔道內腫瘤轉變,特別是IRE非熱消融的優(yōu)勢對于管腔內腫瘤更具應用價值。通過高壓電脈沖消融技術與新型醫(yī)療技術的發(fā)展相結合,包括內鏡技術、經自然腔道手術技術、介入技術、新型手術機器人技術等,可以進一步發(fā)揮其技術優(yōu)勢[31]。國內外若干研究機構已經在這些方向開展了初步探索,愛爾蘭Cork大學Forde等[32]提出了適用于內鏡下ECT治療結直腸癌的消融電極方案。美國紀念斯隆凱瑟琳癌癥中心Srimathveeravalli教授團隊提出針對支氣管腫瘤的網籃狀電極方案,以及適用于十二指腸鏡下導管化膽道消融電極方案[33-34]。西安交通大學外科夢工場呂毅教授團隊率先提出適用于消化道黏膜消融的內窺鏡下磁錨定導管電極方案[35-36]。但是,上述研究目前仍較多處于實驗室研究階段,尚未有較成熟的內鏡下消融電極導管進入臨床研究。此外,美國Gala Therapeutic公司設計了適用于支氣管鏡下的網狀電極,將高壓電脈沖技術用于慢性阻塞性肺部疾病治療,且療效顯著。
5 總結與展望
新型高端數(shù)字診療裝備是推動健康中國戰(zhàn)略的重要引擎,是我國“十四五”規(guī)劃的重點發(fā)展方向。集中優(yōu)勢資源進一步推動“醫(yī)產學研用”創(chuàng)新鏈和產業(yè)鏈深度融合,充分發(fā)揮新型舉國體制優(yōu)勢,加強技術源頭創(chuàng)新,集中解決設備關鍵核心技術問題,實現(xiàn)“卡脖子”技術重大突破,推動國產高端醫(yī)療器械發(fā)展與應用,對于國家安全和國民經濟建設具有重要的戰(zhàn)略意義。“十四五”規(guī)劃綱要中明確指出,要集中優(yōu)勢攻關醫(yī)藥和醫(yī)療設備領域關鍵核心技術。我國在高壓電脈沖技術領域和核心關鍵技術方面已有較多積累,將該技術由國防軍事和工業(yè)生產領域向醫(yī)療裝備領域轉化,同時結合前沿醫(yī)學技術和治療手段,充分提升國產高端診療裝備的數(shù)字化、智能化和集成化水平,可以進一步完善國家醫(yī)療裝備工業(yè)體系,為健康中國戰(zhàn)略提供更為有力的科技支撐。

