一種減少胸部腫瘤放療圖像引導配準誤差的方法
楊定強,戴紅婭,周一兵
陸軍軍醫大學第二附屬醫院 腫瘤科,重慶 400037
引言
隨著放療技術發展,現代放療技術已進入高精度放療時代,采用圖像引導放射治療(Image Guided Radiotherapy,IGRT)技術可以提高治療的位置精度,減少對周圍正常組織照射量。放療IGRT設備眾多如錐形束CT(Cone Beam CT,CBCT)、電子射野影像系統(Electronic Field Imaging System,EPID)、泰影像驗證系統(Image Verification System,IVS)等。采用IGRT技術治療時圖像的驗證配準方式是影響位置精度的主要因素[1]。IVS為二維驗證設備,與三維驗證設備比較存在圖像采集配準復雜、分辨率較低、組織器官重疊嚴重等局限性[2],使得技師在圖像配準時難度增大。在頭頸部腫瘤放療中二維驗證設備只能保證在平移方向位置的準確性[3],上述原因導致技師在行二維圖像驗證時配準偏差較大,使得技師在放射治療中醫生和技師進行圖像匹配時出現匹配結果不一致的情況。本研究運用氣管隆嵴結合主動脈弓為匹配特征點配準,找到技師自主配準更精確的配準方法,對比分析胸部腫瘤在圖像引導的匹配結果數據進行分析,此方法能夠提高技師自主擺位精度,現報道如下。
1 材料和方法
1.1 一般資料
選取2019年10月至12月在我院行胸部調強放療患者30例123次位置驗證,其中男性19例,女性11例,體重50~70 mg,年齡25~70歲,中位年齡45歲,卡氏評分均≥70分,所有患者均能平靜呼吸。中心型肺癌13例;周圍型肺癌5例;食道癌3例;胸椎骨轉移8例;胸腺瘤1例。主要設備為Elekta直線加速器,oncntra計劃系統、飛利浦CT模擬機、雷泰影像驗證系統IVS。
1.2 患者體位固定及CT掃描
患者平躺于模擬機平板床的體位固定板上,熱塑模固定。通過激光三點以等中心放療技術確定marker和左右兩側的十字交叉線[4]。在患者身上和熱塑膜上均做好擺位標記,以確保治療前復位和治療中的擺位的準確性。CT掃描范圍:上界為第4頸椎椎體上緣,下界至肋膈角下緣約3 cm,掃描層厚為5 mm,層間距為5 mm。CT掃描圖像經網絡傳入oncntra計劃系統。
1.3 結構勾畫
胸部腫瘤靶區的勾畫受到較多因素的影響,如影像學特點、窗寬窗位的選擇、醫師的經驗、醫師的臨時狀態等[5]。為了避免勾畫腫瘤靶區體積變化過大的影響,30例患者均由三名醫生討論后勾畫,靶區勾畫范圍需得到三位醫生共同認可。靶區勾畫定義參照ICRU50和23號報告,勾畫大體腫瘤靶區(Gross Tumor Volume,GTV)、臨床靶區(Clinical Target Volume,CTV),同時勾畫正常組織器官,GTV為CT圖像下可見病灶,據對腫瘤生物學的了解及臨床經驗,在GTV外周加一定邊界以包括亞臨床浸潤病灶構成CTV[6],PCTV外放根據病灶位置不同而有所變化,食道癌在CTV基礎上左右外擴5 mm,上下外擴10 mm,胸腺瘤和胸椎轉移患者在CTV基礎上均勻外擴5 mm,肺癌患者運用4D-CT掃描方式在ITV基礎上均勻外擴5 mm,勾畫敏感器官和需保護重要組織。
1.4 TPS計劃及圖像后處理
將CT掃描所做的三個“十”字標記線在模體內相交點位置作為坐標“0”位點,TPS根據靶區形態自動選擇治療等中心。根據放療原則盡可能減少正常組織器官劑量的同時使靶區得到更高劑量照射進行IMRT計劃設計。計劃確認后在TPS上設置大機架為0、90°、270°小機頭均為0的三個射野,三個射野x、y、z坐標和計劃坐標保持一致。分別生成0、90°、270°的二維驗證圖像,并傳入IVS位置驗證系統。患者經CT模擬機復位并在熱塑模上標記出治療等中心。
1.5 驗證CT圖像獲取
所有患者均在ELEKTA直線加速器上治療,射線能量為6 MV,驗證系統為雷泰影像驗證系統IVS。每位患者以CT復位數據作為擺位依據,運用激光燈擺放體位。如圖1所示,根據患者病灶位置確定拍攝0、90°或0、270°兩張二維驗證圖像,通常病灶位于患者正中矢狀面之左時選擇0、90°拍攝兩張二維驗證圖像,反言之則拍攝0、270°兩張二維驗證圖像。2個角度加速器分別出束1 MU,總計出束2 MU,射野大小均為27 cm×27 cm。IVS系統載入參考圖像與獲取的二維驗證圖像進行配準。
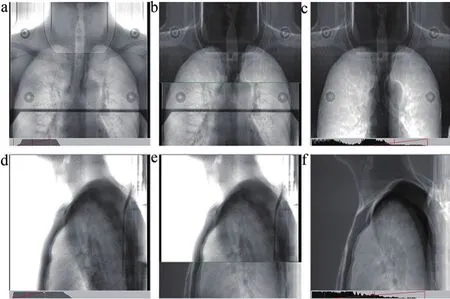
圖1 IVS位置驗證圖
1.6 圖像匹配與數據獲取
30例患者共計123組IVS圖像,在圖像匹配中為避免不同人員匹配時存在的誤差,醫生在對每組IVS圖像進行配準時均由3名醫生共同討論后得出匹配誤差,同樣技師對IVS圖像配準時也由3名技師共同討論后得出匹配誤差。每組IVS圖像均用3種方式行圖像手動匹配。A組:在無醫生參與下行圖像匹配,技師對胸部病灶進行圖像匹配時采用獨立自主的配準方式進行圖像匹配。B組:由醫生自行做圖像匹配,醫生對胸部病灶進行圖像匹配時采用獨立自主的配準方式進行圖像匹配。C組:技師采取氣管隆嵴結合主動脈弓作為匹配特征點對胸部病灶進行圖像匹配。分別獲取背腹位(Dorsoventral,VRT)、頭腳位(Head Pin,LNG)和左右位(Lateral,LAT),以B組醫生匹配結果作為標準,兩兩對比分析AB、BC之間的匹配誤差。
1.7 統計學分析
應用IBM SPSS 19.0軟件,模體位置驗證三個方向的誤差值運用散點圖對數據進行處理。所有患者使用A、B、C三種方法獲得的三個方向的擺位誤差數據進行簡單分析,用均值±標準差(±s)表示,運用配對樣本t檢驗對數據進行處理,檢驗水準P<0.05為差異有顯著性。
2 結果
每組統計例數為123例,如表1所示,A組技師自主配準在LAT、VRT、LNG方向匹配誤差分別為(0.05±0.25)cm、(0.04±0.26)cm、(0.09±0.62)cm。B組醫師自主配準在LAT、VRT、LNG方向最大匹配誤差分別為(0.04±0.30)cm、(0.05±0.34)cm、(0.01±0.67)cm。C組技師運用特征點匹配在LAT、VRT、LNG方向匹配誤差分別為(0.04±0.27)cm、(0.05±0.28)cm、(0.03±0.63)cm。A組技師匹配誤差與B組醫生匹配誤差比較,在LAT、VRT方向誤差比較,差異無統計學意義(P>0.05);在LNG方向匹配誤差,差異有統計學意義(P<0.05);C組技師運用特征點匹配誤差與B組醫生匹配誤差比較,在LAT、VRT、LNG方向匹配誤差差異均無統計學意義(P>0.05)。
表1 三個方向擺位誤差數據(cm,±s)

表1 三個方向擺位誤差數據(cm,±s)
注:a表示A組與B組比較;b表示B組與C組比較。
?
3 討論
IGRT技術的應用能夠及時矯正擺位誤差,從而提高放療精確度[7]。IGRT準確性是以加速器機械參數準確為前提,因此加速器校準成為IGRT準確性的關鍵。根據TG142報告要求首先校準加速器治療治療等中心、輻射野與燈光野一致性、大機架旋轉精度、激光燈等。
精確放療是當今放療的常規選擇,而照射靶區位置的準確性是放射治療中重要和基本的一個環節,位置驗證的目的就是評估和調整治療時的體位,達到定位和計劃時的體位,保證所確定的靶區和重要器官以及照射的空間位置與計劃的相符,使靶區得到準確的照射[8-9]。前人研究結果認為當擺位誤差大于l cm,會導致周邊靶區丟失大于6 mm[10-11]。胸部患者在放療過程中,擺位位置誤差、肺部呼吸運動、器官自身運動、機械參數誤差、人為因素均可導致計劃精確的降低,使得靶區漏照或敏感器官超量的風險增加[12]。放療技術進步很快,當前已進入精確定位、精確計劃、精確治療的“三精”時代[13],IMRT技術已成為當今放療主要趨勢,由于IMRT計劃和靶區高度適形卻劑量跌落較大,故對患者治療精度要求更高。臨床上常用CTV外擴PCTV方式來解決系統誤差和隨機誤差,從而達到治療靶區不漏照目的。IVS獲取的位移值精度,是否在我科PCTV外放誤差范圍內,校準位移精度也是一項重要任務。
醫師從每位患者的接診、定位、靶區勾畫、計劃審核、治療都全程參與,對病人一般情況、病理特性、病灶和周圍組織器官的位置關系了然于心,因此醫師的圖像匹配結果可作為匹配準確性的標準值。而技師對特定患者解剖學結構、病灶和周圍組織器官關系等因素與醫生考慮的角度之間存在差異,圖像配準結果會受到圖像體素尺寸大小等因素的影響,且配準是否準確靠技師來判斷,這就將技師的認真程度和經驗也納入影響定位精度的范疇,增加了隨機誤差[14-15],綜上原因均能左右圖像匹配結果。有研究表明在自由呼吸狀態下隆突的平均移動在左右方向為(1.5±0.7)mm,在頭腳方向為(5.3±1.6)mm,在腹背方向(2.3±1.4)mm[16],左右方向位移誤差較小,頭腳方向位移誤差較大,不能單一作為匹配標志。研究表明胸椎位置固定,與主動脈弓比較在頭腳、腹背方向移動度較小,無統計學差異,主動脈弓在頭腳、腹背方向可做為匹配標志[17-19]。上述文獻表明胸部腫瘤配準時單一選擇氣管隆嵴或者主動脈弓均無法提高配準精度。從本文研究結果證明運用氣管隆嵴結合主動脈弓為匹配特征點配準,在LAT、VRT方向,醫師、技師獨立自主配準、特征點配準匹配結果無統計學差異。在LNG方向醫師與技師獨立自主配準結果有明顯統計學差異,技師在LNG方向存在較大配準誤差。醫師獨立自主配準與技師運用氣管隆嵴輔助主動脈弓為匹配特征點配準結果,在LNG方向無明顯統計學差異。氣管隆嵴結合主動脈弓為匹配特征點能夠運用臨床匹配三個方向的位移誤差,能夠提高技師在圖像配準時的精度。
EPID是附加于直線加速器的影像設備,可以進行二維圖像位置驗證,有操作方便、成本較低和實時進行拍片的優點,是多數進行三維精確放療單位使用的位置驗證設備和監測治療實施過程中質量控制的手段[20]。雷泰影像驗證系統IVS是安裝在醫科達加速器的EPID探測板處,替換原有的EPID探測板,因此IVS圖像是MV級二維圖像,具有EPID行二維圖像位置驗證功能。相對于EPID驗證系統IVS經數據算法處理在成像質量、分辨率、照射劑量、軟組織分辨率等方面均有所提高,但和XVI(KV-CBCT)比較亦有所欠缺,尤其是胸椎、胸椎間隙、肋骨等部位,由于MV-X線康普頓效應及組織重疊等原因,邊界模糊,用于圖像配準較為牽強。而隆突、主動脈因相鄰組織器官密度反差較大,圖像較清晰,容易判斷結構邊界,是可作為IGRT配準標志的影像學依據。二維驗證時由于MV-X線使其軟組織顯影質量較差,組織結構重疊嚴重等使其配準難度增加,在由于技師對特定患者解剖學結構、病灶和周圍組織器官關系等因素與醫生考慮的角度之間存在差異,技師如何選擇配準方式成為難點。筆者運用氣管隆嵴結合主動脈弓為匹配特征點配準,和醫師配準結果無明顯差異,能夠提高技師在圖像配準時的精度,且配準速度快、成本較低適用于臨床應用。IVS驗證系統是通過加速器MV級X射線獲取二維驗證圖像,加速器出束量的多少是影響圖像質量關鍵因素,對于體重50~70 mg患者出束1 MU圖形質量較好,當體重超過或少于該體重范圍時圖形質量就有所降低,患者體重大于70 mg時出束1.5 MU圖形質量較好,而我科醫科達加速器初始最小出束量為1 MU,出束1.5 MU需調整加速器參數,導致圖像驗證和治療之間需修改加速器參數,反而增加了治療時間,加速器參數反復調整也容易造成醫療事故。目前我科將IVS驗證系統用于50~70 mg胸部腫瘤患者,在此體重范圍外患者主要還以CBCT為主的驗證方式。如何運用IVS驗證系統在不增加出束量的同時提高圖形質量,在日后工作中需進一步研究,以提高IVS在胸部腫瘤中的應用范圍。

