牛蛙源弗氏檸檬酸桿菌的分離鑒定和藥敏分析
黃志藝,謝麗琴,許嘉龍,劉琦濤,楊培奎
(韓山師范學院 生命科學與食品工程學院,廣東 潮州 521041)
牛蛙(Rana catesbeiana)原產于北美洲和墨西哥等地,其肉質鮮美,營養價值較高,且其皮、油和腺體等可作為工業、養殖業和醫藥業的原料[1-2].自上世紀60年代引入我國以來,經過多年的推廣已成為我國主要水產養殖產業之一,其年產量已超過15 萬噸[3].然而,近年來由于牛蛙養殖密度增大、水質惡化,病害也日益突出.目前已報道的病害主要有寄生蟲病、病毒性疾病以及由變形菌(Proteus vulgaris)、鏈球菌(Streptococcus)、達卡氣單胞菌(Aeromonas dhakensis)、金黃桿菌(Chryseobacterium sp.)等引起的細菌性疾病[4-8].其中,細菌性疾病由于致病菌種類多、致病的病因復雜、發病和致死率高等原因經常給牛蛙養殖業造成重大的經濟損失,因此一直以來都是牛蛙養殖中病害防控的重點[9].
在養殖過程中,水體環境的污染、富營養化等導致水體中致病菌大量繁殖,嚴重危害水生動物的生存,致使病害頻發.因此,養殖環境中致病微生物的防治對于健康養殖、病害防控具有重要意義.為此,本研究運用傳統的細菌分離培養方法,從牛蛙養殖場的廢水中分離細菌,結合理化特性以及16SrRNA 擴增和系統發育進化分析,鑒定病原.同時,對分離細菌的耐藥性以及致病力進行分析,以期為牛蛙養殖過程中環境致病菌的科學防治提供理論依據.
1 材料和方法
1.1 實驗材料
牛蛙池塘廢水采自廣東省汕頭市澄海區鹽鴻鎮牛蛙養殖場;成體幼蛙購自同一地區的種苗繁育基地,開展實驗前在實驗室暫養5-7 天.陳皮、麻黃、虎杖、廣藿香、苦參根、野菊花、蛇床子、丁香、黃柏、艾葉、黃芩、烏梅、五味子等中藥材均購自廣東省潮州市湘橋區大森林藥房.
1.2 主要試劑和儀器
腸桿菌科細菌生化鑒定管、藥敏紙片,杭州微生物試劑有限公司;2×Taq PCR StarMix、瓊脂糖,北京康潤誠業生物科技有限公司;細菌通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGGCTACCTTGTTACGACTT-3’),由華大基因科技有限公司合成.SHP-150 型生化培養箱,上海精宏實驗設備有限公司;博日LifeECO 基因擴增儀,杭州博日科技有限公司;Gel DOCTM XR+凝膠成像系統、PowerPac basic 電泳儀,美國Bio-Rad 公司;DYCP-31E 型水平電泳槽,北京六一儀器廠.
1.3 培養基
LB 培養基:蛋白胨1%,酵母膏1%,氯化鈉0.5%,pH 值7.2. LB 固體培養基是在LB 液體培養基的基礎上加入1.5%~2.0%的瓊脂,121 ℃20 min[10].
1.4 中草藥水提取液的制備
分別取陳皮、麻黃、虎杖、廣藿香、苦參根、野菊花、蛇床子、丁香、黃柏、艾葉、黃芩、烏梅、五味子等十三種中藥30 g,加入500 mL 蒸餾水置于超聲波提取器處理提取30 min,隨后將各中草藥水提取液再加熱煮沸1 h,以無菌紗布趁熱過濾煎液,并將濾液加熱濃縮到50 mL.取1 mL濃縮液測定干物質質量,其余保存于-80 ℃備用.
1.5 病原菌的分離純化及菌懸液制備
將采集的水樣,在無菌條件下利用0.7%無菌生理鹽水進行一系列稀釋后,取100 μL 稀釋液均勻涂布于LB瓊脂平板,28 ℃,培養24 h.挑選形態特征相似的優勢菌落,通過2-3代的劃線分離純化,獲得一株優勢的純培養菌株W6,4 ℃保存待用.將W6菌接種至LB液體培養基,28 ℃,150 rpm/min,培養24 h,隨后離心收集菌體并用0.7%的無菌生理鹽水重懸菌體制成菌懸液.
1.6 病原菌的形態觀察和生理生化鑒定
觀察純化后菌株W6 的單菌落形態特征,挑取單菌落進行革蘭氏染色,顯微鏡觀察其形態特征.將W6 接種于牛肉膏蛋白胨液體培養基中,28 ℃,150 rpm/min,培養24 h,隨后收集菌體并用0.7%的無菌生理鹽水制成菌懸液后接種于生化反應管中,28 ℃培養24 h 后觀察結果,生理生化鑒定采用杭州微生物試劑有限公司的腸桿菌科細菌生化鑒定試劑盒,并按照相應的操作進行.
1.7 病原菌16SrRNA基因擴增及其序列分析
利 用 細 菌 通 用 引 物27F (5' -AGAGTTTGATCCTGGCTCAG-3' ) 和1492R (5' -TACGGTTACCTTGTTACGACTT-3' )對菌株S15 基因組DNA 進行16SrRNA 基因序列的擴增.16SrRNA 基因PCR 反應體系(10 μL):2×Taq MasterMix(Dye)5 μL,上、下游引物(10 μmol/L)各1 μL,模板1 μL,ddH2O 2 μL;PCR 反應條件:96 ℃3 min;96 ℃30s ,55 ℃1 min,72 ℃2 min,30 個循環;72 ℃延伸10min.隨后,取2 μL的PCR產物利用1%瓊脂糖凝膠電泳檢測,將單一且符合目的大小的PCR產物送廣州華大基因科技有限公司完成測序.
將所獲得的16SrRNA 基因序列上傳至NCBI 數據庫,并利行BLAST 進行序列相似性比對,選取與所測序列同源性高的已知菌株的16SrRNA 基因序列.采用MEGA7.0 軟件,Neighbor-Joining 法進行聚類分析和構建系統進化樹[5].
1.8 抗生素敏感性試驗
參照KB紙片擴散法[11],即以涂布法接種0.1 mL1.0×107CFU/mL 的菌懸液于LB培養基平板上,然后將藥敏紙片(杭州微生物試劑有限公司)貼于培養基上,28 ℃培養24 h 后,測定其抑菌圈直徑(mm),每種藥物平行重復三次,確定分離菌株對抗生素的敏感性.
1.9 中草藥水提取液對W6菌株抑菌活性分析
參照課題組此前的方法[12],在LB 培養基平板上涂布接種0.1 mL1.0×10?CFU/mL 的菌懸液.隨后,放置直徑為6 mm 的滅菌濾紙,并用20 μL 的中草藥水提取液浸潤.將培養皿置于28 ℃培養24 h,隨后測定抑菌圈直徑.以頭孢霉素(20 μL,0.1 mg/mL)為陽性對照,以蒸餾水20 μL為陰性對照,所有的分析進行三次重復.
用二倍稀釋法測定中槽藥水提取物對W6 菌株的MIC 和MBC.首先,在96 孔板中按照每孔100 μL的量加入LB液體培養基.隨后,在每一排的第一孔中加入100 μL中草藥水提取液(100 μg/mL),充分混勻后取100 μL 至第二孔,并依次稀釋至第11 孔,第12 列孔作為空白對照.每個孔接種加入1 μL 稀釋至1.0×103CFU/ml 的菌液,28 ℃培養24 h,觀察并記錄MIC、MBC,平行重復3 次,每組數值取平均值.
1.10 細菌致病性試驗
為了檢測分離菌株W6 的致病性,以牛蛙為實驗動物進行細菌致病性實驗.將W6 接種于牛肉膏蛋白胨液體培養基,28 ℃培養24 h后收集菌體,用0.7%的無菌生理鹽水制成濃度為1×109cell/mL的菌懸液.采用腹腔注射的方法進行感染實驗,其中實驗組每只牛蛙注射100 μL 菌懸液,對照組注射同等劑量的無菌生理鹽水.注射之后的牛蛙放入塑料桶中暫養,隨后每隔24 h 觀察并記錄一次牛蛙的死亡情況,實驗為期168 h.
2 結果
2.1 病原菌的形態特征
菌株W6在LB培養基上形成的菌落呈圓形、中間隆起、邊緣整齊、表面光滑.革蘭氏染色的結果表明,該菌株為革蘭氏陰性菌株,鏡檢觀察其為兩端鈍圓的短桿菌(圖1).
圖1 革蘭氏染色后病原菌的形態特征
2.2 病原菌的生理生化特性
菌株W6 生理生化特性見表1.參考《伯杰氏系統細菌學手冊》,菌株W6的生理生化特性與弗氏檸檬酸桿菌的基本一致.對菌株W6 在甲基紅、硫化氫、動力瓊脂、山梨醇、木糖、葡萄糖等的檢測結果均為陽性;在靛基質、側金盞花醇、尿素、鳥氨酸脫羧酶、賴氨酸脫羧酶、苯丙氨酸脫氫酶等的檢測結果均為陰性,上述生理生化特性鑒定結果與弗氏檸檬酸桿菌參考菌株的生理生化特性一致.

表1 W6革蘭氏陰性桿菌生理生化鑒定結果
2.3 16SrRNA基因序列分析
分離菌株W6 的16SrRNA 基因PCR 擴增后,分別獲得大小為1 401 bp 的片段,
與預期結果一致.將測序結果在NCBI 上采用BLAST 進行同源性比對分析,結果顯示分離菌株W6 的16SrRNA弗氏檸檬酸桿菌同源性均為99% 以上.采用MEGA7.0軟件,通過Neighbor-Joining方法構建系統發育樹(圖2),結果顯示該菌株與弗氏檸檬酸桿菌同一進化分支.根據細菌形態觀察、生理生化鑒定結果及16SrRNA基因基因序列分析,可確定分離菌株W6 為弗氏檸檬酸桿菌.
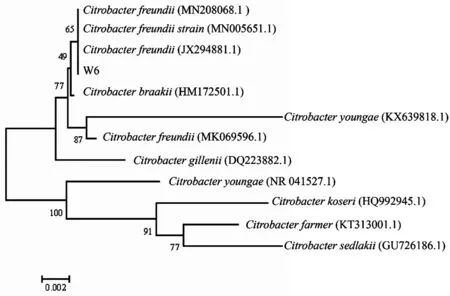
圖2 W6菌株16SrRNA基因序列與部分相關菌株的系統發育樹
2.4 病原菌的耐藥性
采用藥敏紙片法測試分離菌株W6對30種抗菌藥物的敏感性,結果如表2所示.分離菌株W6 僅對呋喃唑酮和頭孢他定2 種抗生素高度敏感;對丁胺卡那、頭孢哌酮、哌拉西林、多粘霉素B 等4 種藥物中度敏感;對麥迪霉素、青霉素、諾氟沙星、苯唑西林、氧氟沙星、氨芐西林、環丙沙星、慶大霉素、羧芐西林、萬古霉素、卡那霉素、新霉素、頭孢氨芐、復方新諾明、四環素、頭孢唑啉、多西環素、頭孢拉定、氯霉素、米諾環素、頭孢呋辛、克林霉素、紅霉素、頭孢曲松等24種抗生素不敏感.
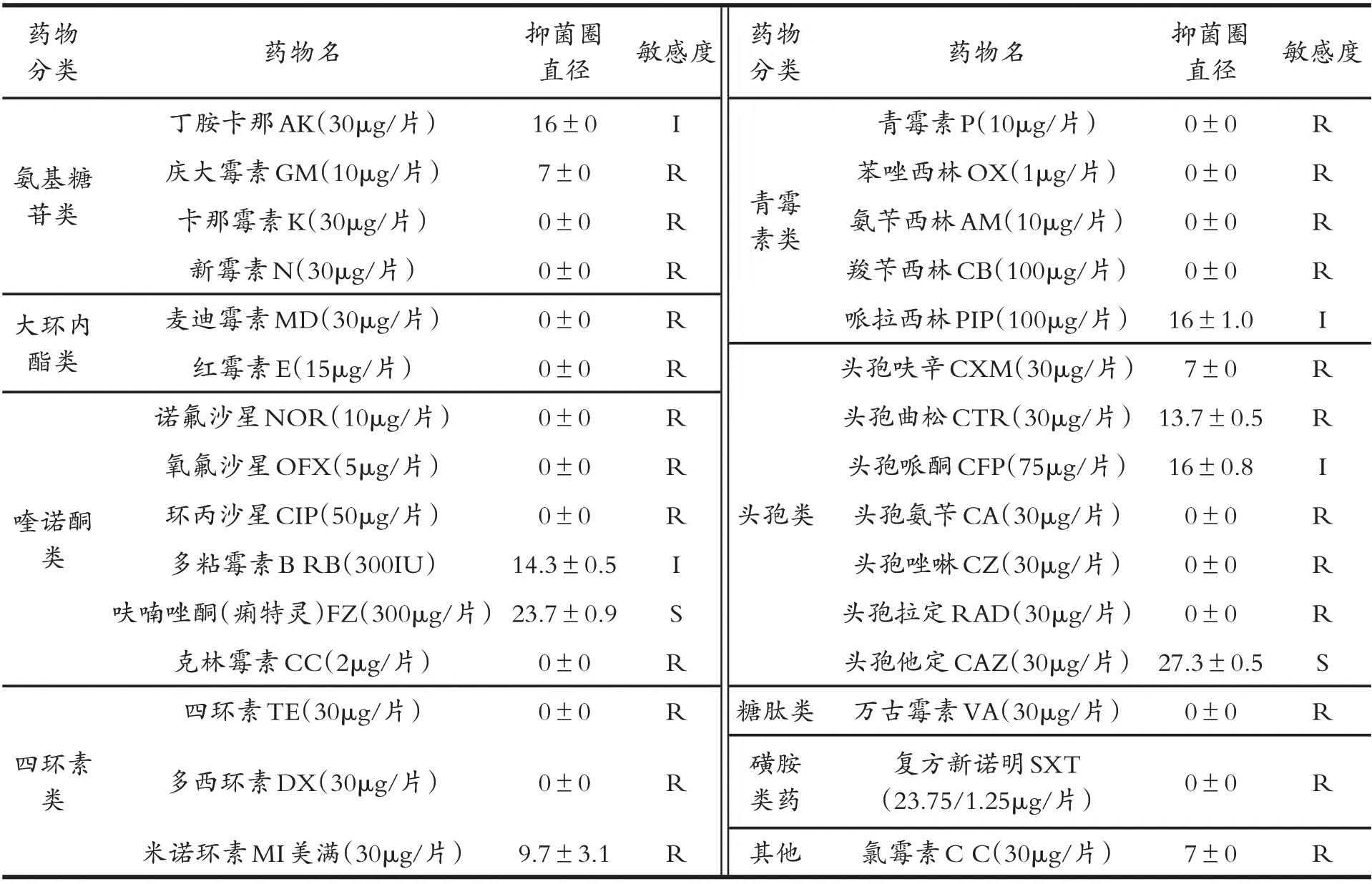
表2 抗生素敏感實驗結果(單位:mm)
2.5 中草藥對病原菌的抑菌作用
由表3可知,五味子、烏梅、黃芩、艾葉等4種草藥水提取液對分離菌株W6 具有一定抑菌作用.進一步分析上述中草藥水提取液對分離菌株W6 的最小抑菌濃度(MIC)和最小殺菌濃度(MBC).具體結果如表4 所述,黃芩水提取液、烏梅水提取液、五味子水提取液、艾葉水提取液對分離菌株W6 的MIC 分 別 是23.0 mg/mL、1.6 mg/mL、2.4 mg/mL 和6.3 mg/mL;MBC 分別是46.0 mg/mL、3.1 mg/mL、4.9 mg/mL和12.5 mg/mL.
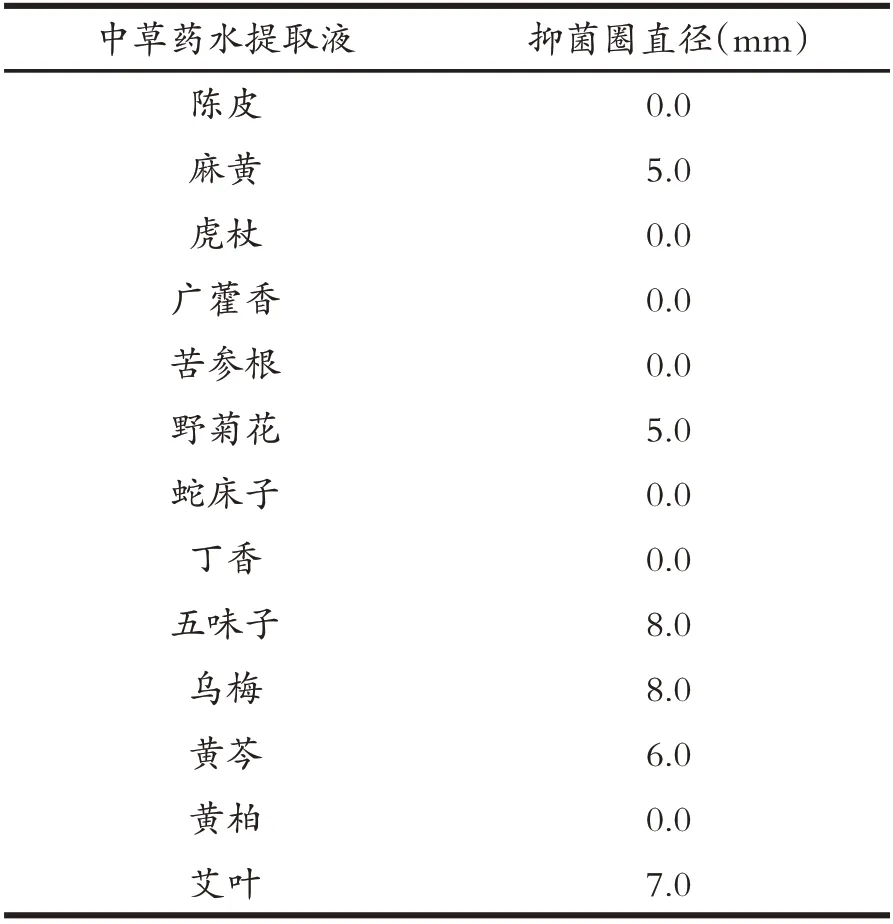
表3 中草藥水提取液對菌株W6的抑菌活性
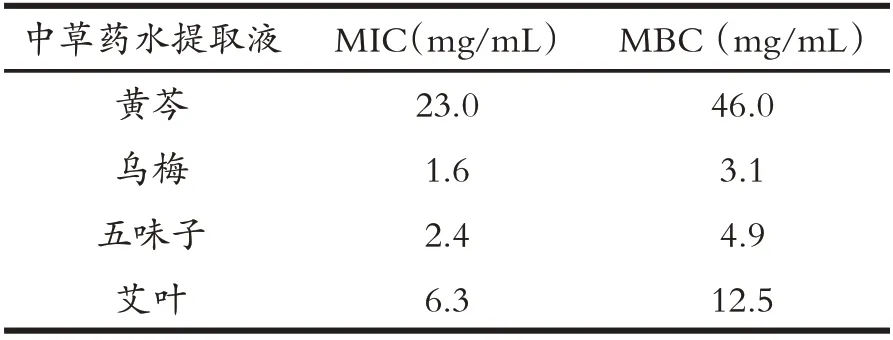
表4 中草藥水提取液對菌株W6的MIC和MBC
2.6 致病性試驗
對牛蛙進行人工感染實驗,結果如圖3 所示.試驗組的牛蛙在24 h 內即出現死亡,并在48 h 內累積死亡率即超過50%,在72 h 內累積死亡率達到60%.而對照組僅在48 h時出現1個個體死亡的情況.這表明該分離菌株具有較強致病性.
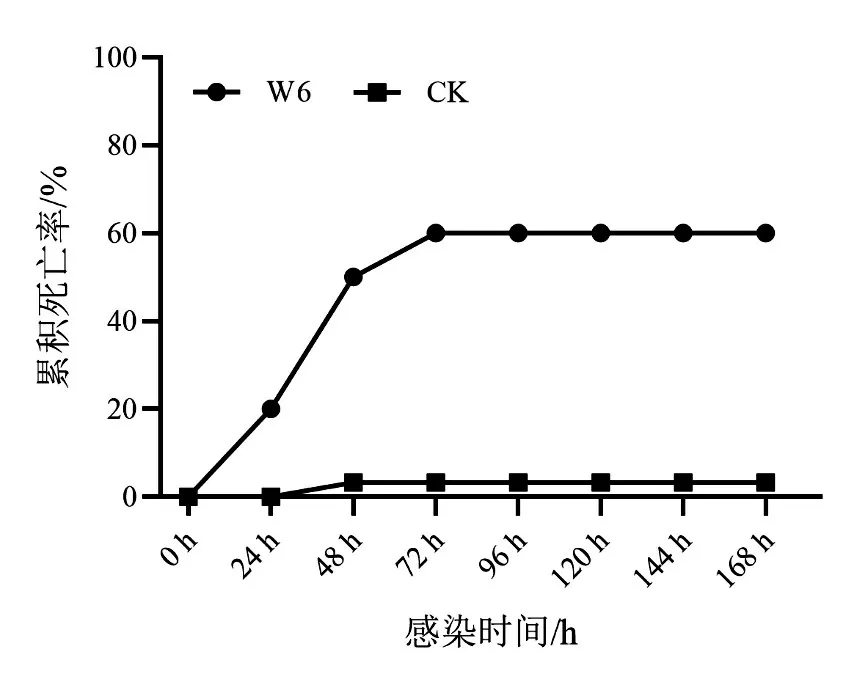
圖3 牛蛙注射W6菌株的累積死亡率
3 討論
3.1 弗氏檸檬酸桿菌的鑒定
弗氏檸檬酸桿菌是一種革蘭氏陰性短桿菌屬腸桿菌科、枸櫞酸桿菌屬[13-14].一般而言,不同菌株來源的弗氏檸檬酸桿菌,其理化特性可能存在差異.劉張淮等[15]分離的克氏原螯蝦源弗氏檸檬酸桿菌與陳綺梨等[16]分離的加州鱸源弗氏檸檬酸桿菌,蘇英等[17]分離的大鯢源致病性弗氏檸檬酸桿菌以及本研究發現的分離菌株W6 其利用尿素的特性存在差異.有研究指出,同種不同來源菌株的生理生化特性差異可能與不同菌株的來源地區、氣候、實驗室培養條件等差異有關[18].因此,細菌的鑒定通常需要在生理生化分析的基礎上,進一步結合分子鑒定加以確認[19].
3.2 弗氏檸檬酸桿菌的致病性
弗氏檸檬酸桿菌作為一種水產動物常見病原菌以及人魚共患的致病菌廣泛存在于自然水體中[20-21].感染水產動物之后,可引起脾臟和肝臟壞死腫大,消化道出現炎癥,體表出血或腐爛,肌肉水腫等癥狀[15].此前有研究表明弗氏檸檬酸桿菌是牛蛙“紅腿癥”的致病菌之一[22-24].同時大量的研究證實,弗氏檸檬酸桿菌可引起克氏原螯蝦[25]、羅非魚[26]、花鰻鱺[27]、團頭魴[28]、大鯢[29]等水產經濟動物的病害并造成較大的經濟損失.不同來源的弗氏檸檬酸桿菌的致病性通常存在差異.陳綺梨等[16]對鱸源的弗氏檸檬酸桿菌進行人工回歸感染實驗發現,經1×108CFU/mL 菌懸液浸泡感染,在浸泡16 h 后出現死亡,連續觀察7 d 發現其累積死亡率達60%.蘇英等[17]對大鯢源弗氏檸檬酸桿菌進行人工感染回歸實驗發現,對大鯢的半致死濃度(LD50)為3.16×106CFU/mL.本實驗的分離菌株在腹腔注射0.1 mL 1×108CFU/mL,在48 h其累積死亡率可達60%,這表明該分離菌株具有較強的致病性和毒力.
3.3 弗氏檸檬酸桿菌的耐藥性
弗氏檸檬酸桿菌對抗生素的耐藥性因菌株不同、宿主差異以及環境等因素存在差異.本研究的分離菌株對大環內酯類、青霉素類和四環素類抗生素已經產生明顯耐藥性,這與蘇英等[17]、盧君輝等[30]、白杰等[31]的報道類似.而本研究的分離菌株W6 對諾氟沙星、氧氟沙星、環丙沙星等喹諾酮類抗生素表現為耐藥性,這與陳綺梨等[16]的報道存在差異,但與張冬星等[28]的研究類似,這可能與菌株來源地的養殖環境、用藥情況以及宿主的差異有關[32].因此,對于養殖過程中出現的細菌性病害應快速進行病原分離鑒定和敏感藥物篩選,從而為病害科學防治提供依據[16].
中草藥來源廣泛、價格低廉、毒性低、不易產生耐藥性,在當前限制使用抗生素的形勢下,使用中草藥提取物替代傳統抗生素已逐漸成為解決病原菌耐藥性的有效方式之一[12].本研究發現五味子、烏梅、黃芩、艾葉等中草藥水提取液對分離菌株W6具有一定的抑菌效果.在本課題組前期的研究中,五味子對嗜水氣單胞菌、副溶血弧菌和溶藻弧菌都具有較強的抑菌作用[12].葉偉東等發現烏梅水提取液對加州鱸源的嗜水氣單胞菌具有良好的抑菌效果[33].這可能與五味子含有鞣質,烏梅含有有機酸等抗菌物質有關[34-35].雖然體外抑菌實驗表面五味子、烏梅、黃芩和艾葉對弗氏檸檬酸桿菌具有一定的防治效果,但抗菌機制還需進一步研究.

