卡瑞利珠單抗聯合化療一線治療晚期肺鱗癌的臨床療效分析
郝娜 李楠 郭溫馨 劉艷粉 王麗萍
肺癌是全球癌癥相關死亡的首要原因[1],肺鱗癌是肺癌中常見的病理類型,晚期肺鱗癌因其表皮生長因子受體(epidermal growth factor receptor, EGFR)基因突變和間變性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)融合基因重排率低,其治療局限于放化療,預后較差[2-3]。卡瑞利珠單抗是一種人源化IgG4 kappa單克隆抗體[4],與PD-1受體結合后阻斷PD-1/PD-L1信號通路的傳導,解除免疫抑制從而發揮抗腫瘤作用[5],目前已在經典霍奇金淋巴瘤、肝癌、食管癌等癌種中顯示良好的抗腫瘤療效[4, 6-7]。Camel研究中卡瑞利珠單抗聯合化療一線治療非鱗非小細胞肺癌,mPFS長達11.3個月[8]。因此本研究的主要目的是評估卡瑞利珠單抗聯合化療一線治療晚期肺鱗癌的安全性和有效性。
資料與方法
一、一般資料
本研究經鄭州大學第一附屬醫院倫理委員會的批準,回顧性分析了2018年4月至2020年10月鄭州大學第一附屬醫院收治的初診為臨床分期ⅢB~Ⅳ期驅動基因陰性的78名肺鱗癌患者的臨床資料。將卡瑞利珠單抗聯合化療組歸為觀察組,單純化療組歸為對照組。整理并記錄兩組基線資料,包括年齡、性別、ECOG評分、吸煙史、臨床分期、肝轉移、腦轉移,差異均無統計學意義(P>0.05)(見表1)。

表1 兩組基線資料比較[n(%)]
二、納入與排除標準
納入標準:(1)病理類型為鱗狀細胞肺癌;(2)根據IASLC第八版臨床分期為ⅢB~Ⅳ期;(3)基因檢測提示驅動基因陰性;(4)年齡≥18歲;(5)ECOG評分為0~1分;(6)至少存在1個可測量病灶(RECIST 1.1標準);(7)無活動性腦轉移 ;(8)既往未接受過抗腫瘤治療。
排除標準:(1)有神經系統癥狀的腦轉移;(2)有需要使用糖皮質激素的非感染性肺炎病史;(3)驅動基因表達陽性;(4)自身免疫性疾病活動期患者;(5)病例資料不完整。
三、治療方法
1 對照組
白蛋白結合型紫杉醇 260mg·m-2第1天,卡鉑AUC=6mg·mL-1·min-1第1天,靜脈滴注。每21天為1個周期,規律化療4~6個周期。若化療期間評估疾病進展,則進入二線治療,若化療4~6周期后疾病評估為CR、PR或SD,則每8周復查CT、彩超等影像學檢查評估療效。
2 觀察組
卡瑞利珠單抗200mg靜脈滴注第1天,化療藥物應用方案同對照組,每21天為1個周期。治療期間初次評估疾病進展但臨床狀態穩定的患者繼續原方案治療2周期后重新評估;治療期間初次評估疾病進展但臨床狀態不穩定的患者,停止抗腫瘤治療,給予對癥支持治療,待臨床狀態穩定后,進入二線治療。若化療4~6周期后疾病評估為CR、PR或SD,則卡瑞利珠單抗規律維持治療,直至影像學評估疾病進展或者出現不可耐受的毒性反應,最多療程不超過35個周期。
四、療效評價
每2周期行影像學檢查(CT、彩超、骨掃描、頭顱MRI、或PET-CT等)評估療效,評估療效標準:根據RECIST 1.1標準,可分為完全緩解(CR)、部分緩解(PR)、疾病進展(PD)及疾病穩定(SD),ORR=CR+PR/總例數×100%,DCR=CR+PR+SD/總例數×100%。對于觀察組,治療期間,根據RECIST 1.1標準初次評估為PD且臨床狀態穩定的患者,原方案治療2周期后根據iRECIST標準再次評估。
五、觀察指標
主要觀察指標:(1)PFS;(2)ORR,DCR;(3)觀察兩組皮疹、消化道反應、骨髓抑制情況等不良反應的差異。末次隨訪時間為2021年3月20日。
六、統計學方法
結 果
一、兩組療效比較
1 治療兩周期后評估療效
ORR觀察組高于對照組(56.4% VS 41.0%,P>0.05)。DCR對照組高于觀察組(84.6% VS 92.3%,P>0.05),但差異均無統計學意義(見表2)。
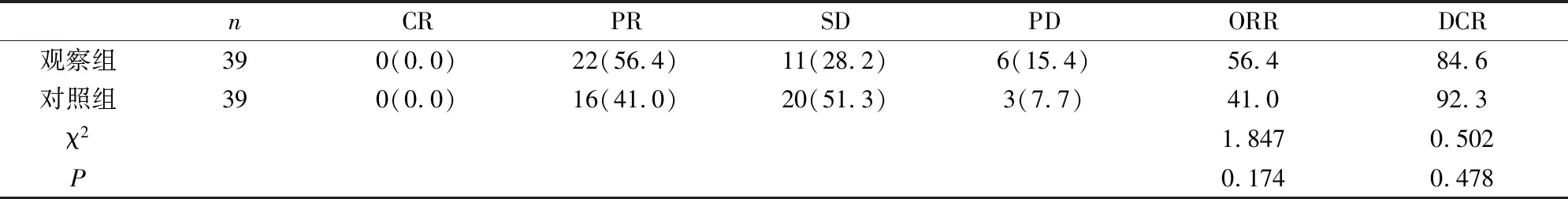
表2 兩組患者治療兩周期后的療效比較[n(%)]
2 兩組PFS的比較
觀察組mPFS與對照組相比,mPFS延長了2.7個月(8.00個月,95%CI:6.988~9.012 VS 5.30個月,95%CI:4.188~6.412),差異具有統計學意義(χ2=10.782,P<0.05)(見圖1)。

圖1 兩組無進展生存期的比較
二、兩組不良事件的比較
觀察組最常見的不良反應是RCHs(32/39,82.1%)、骨髓抑制(24/39,61.5%)及消化道反應(18/39,46.2%);對照組最常見的不良反應是骨髓抑制(23/39,59.0%),消化道反應(16/39,41.0%)及肝功能損傷(12/39,30.8%)。與對照組相比,RCHs是卡瑞利珠單抗特異的不良反應,差異有顯著統計學意義(P<0.001)(見表3)。兩組3~5級不良事件發生率差異無統計學意義(均P>0.05),無治療相關致死事件發生(見表4)。
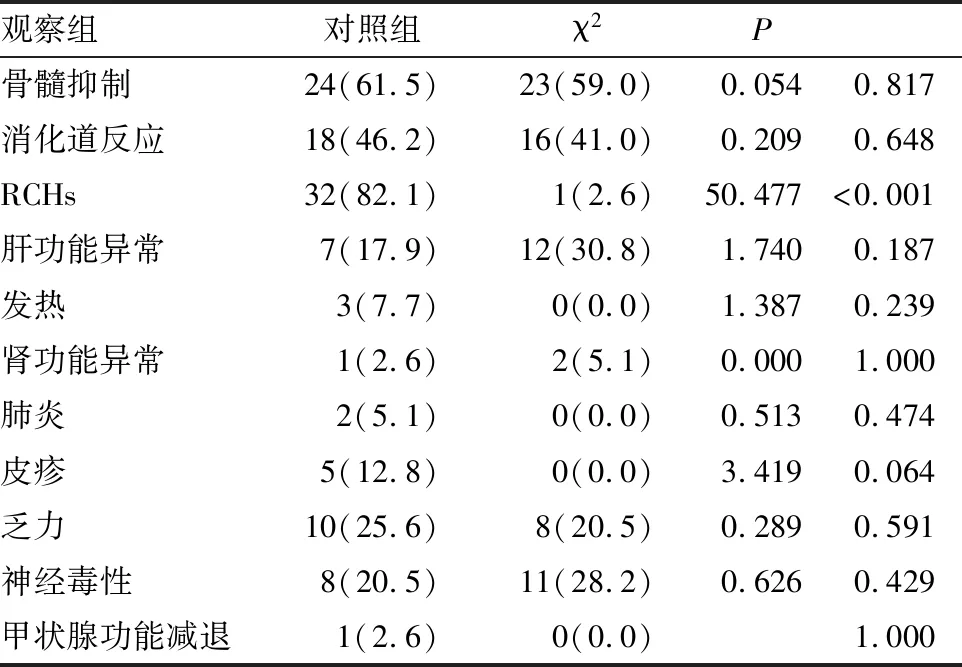
表3 兩組任何級別的不良事件的比較[n(%)]

表4 兩組3~5級不良事件的比較[n(%)]
討 論
雖然既往研究表明NSCLC患者可以從PD-1/PD-L1抑制劑單藥中獲益,但僅限于少數人群,因此如何讓更多的患者獲益是亟待解決的問題。
白蛋白結合型紫杉醇屬于紫杉烷類細胞毒藥物,在有絲分裂中與游離微管蛋白結合,增加微管穩定性,阻止 DNA 分離,從而阻止細胞分裂,最終導致細胞死亡[9]。近來研究發現,紫杉烷類化療藥物可以通過提高腫瘤微環境中高遷移率族蛋白B1(HMGB1) 和 趨化因子CXCL11 的水平從而募集更多的CD8+T細胞到腫瘤微環境中[10],減少Treg細胞并抑制Treg細胞的功能,減少MDSCs的數量并促進MDSCs向M1樣巨噬細胞分化[11]等途徑發揮免疫調節的作用,這些都有利于提高免疫治療的抗腫瘤免疫反應。本研究結果表明,與單純化療相比,卡瑞利珠單抗聯合白蛋白結合型紫杉醇及卡鉑一線治療驅動基因陰性的肺鱗癌明顯延長了患者的無進展生存期。
Keynote-407研究探討了帕博利珠單抗聯合紫杉醇/白蛋白結合型紫杉醇及卡鉑一線治療轉移性肺鱗癌的療效及安全性,與單純化療相比,帕博利珠單抗組明顯延長了患者的PFS(mPFS,8.0 個月VS 5.1 個月 ;HR,0.57 [95% CI:0.47~0.69]),與本研究結果一致,另外Keynote-407研究最終報告已公布,與單純化療相比,帕博利珠單抗組OS延長了5.5個月(mOS,17.1 個月 VS 11.6 個月; HR,0.71 [95% CI:0.58~0.88]),不僅如此,還發現與帕博利珠單抗單藥二線治療肺鱗癌相比,帕博利珠單抗聯合化療一線治療肺鱗癌臨床獲益更多[12]。雖然由于本研究隨訪時間短,樣本量有限,尚無法對比,但是本研究及Keynote-407都表明對于晚期肺鱗癌,PD-1抑制劑聯合化療優于單純化療。周彩存等[8]開展的Camel研究進一步證實了免疫與化療具有相輔相成的作用,研究結果表明,與培美曲塞聯合鉑類一線治療驅動基因陰性的非鱗NSCLC相比,卡瑞利珠單抗聯合化療組mPFS延長至11.3個月,取得了可喜的臨床療效。這可能與種族有關,因為Camel研究納入的是中國人群,也可能與免疫檢查點抑制劑本身有關。卡瑞利珠單抗與PD-1分子有獨特的結合表位,與其他PD-1抑制劑相比,其半數抑制濃度及半數效應濃度更低,在體內PD-1受體占有率更高[13],這些都使得卡瑞利珠單抗的抑瘤作用更強。但是關于已上市的帕博利珠單抗、納武單抗、信迪利單抗、卡瑞利珠單抗等免疫檢查點抑制劑療效對比尚無頭對頭的研究。
另外我們發現本研究中觀察組PD患者6例,其中4例存在肝轉移,可能肝轉移與免疫治療預后差存在一定的關系。目前關于肝轉移的NSCLC患者是否會從免疫聯合化療中獲益存在爭議。Impower150研究提示對于存在肝轉移的非鱗NSCLC患者,與貝伐珠單抗聯合化療相比,阿特珠單抗聯合化療未顯示出生存益處,但是在貝伐珠單抗聯合化療的基礎上聯合阿特珠單抗表現出了明顯的生存益處[14],這提示免疫聯合抗血管生成藥物對于肺癌肝轉移患者可能是一個新的選擇。有研究表明抗血管生成藥物具有免疫調節的作用,增加免疫治療的療效[15]。但是由于中央型肺鱗癌居多,抗血管生成藥物風險較大,對于如何讓中央型肺鱗癌肝轉移患者獲益是未來需要解決的問題。
安全性方面,觀察組出現了RCHs這一常見的不良反應,一般發生在治療的第一個周期內,發生率大約82.1%,都是G1~G2,未發現G4~G5級,一般停藥后可自行消退,局部破潰等癥狀經云南白藥粉末止血治療后可緩解,這與周彩存等[8]開展的camel研究結果一致。RCHs是卡瑞利珠單抗獨特的不良反應,研究表明其與生存獲益相關[16]。關于RCHs發生機制,Finlay等[17]研究表明RCHs是高度特異性的脫靶結合事件,卡瑞利珠單抗可介導與VEGFR2、卷曲類受體5和UL16結合蛋白2的高選擇性、低親和力的異常結合,從而通過血管內皮細胞活化來推動血管瘤的發展。李等[18]的研究證實了Finlay的觀點,發現阿帕替尼聯合卡瑞利珠單抗可降低RCHs的發生率并誘導其快速消退。
本研究有以下幾點局限性:1)本研究中IIIB/C期的肺鱗癌患者,未行同步或序貫放化療,考慮到患者年齡偏大,肺功能基礎差,同步放化療聯合免疫治療可能會增加毒性反應,并且根據照射野范圍大小不同,放療后極大概率會出現不同程度的放射性肺炎,目前放療引起的放射性肺炎沒有很好的治療預防手段,因此結合患者病情及患者和家屬意愿未行同步或序貫放化療及PD-L1抑制劑治療,而是采用卡瑞利珠單抗聯合一線化療替代同步放化療的手段,盡可能達到甚至超過同步放化療為IIIB/C期患者帶來的臨床獲益,改善患者的生存質量,相關研究目前也在探索中;2)由于本研究樣本量較少,隨訪時間較短,未能對免疫治療影響因素、RCHs與療效的關系及總生存期進行分析,尚需要擴大樣本量,延長隨訪時間進一步驗證臨床療效。
綜上所述,卡瑞利珠單抗聯合化療一線治療驅動基因陰性的晚期肺鱗癌可顯著延長患者的PFS,且安全性良好。

