扶正補(bǔ)血食療方含藥血清干預(yù)Notch通路調(diào)控骨髓造血干細(xì)胞化療后損傷的機(jī)制研究
汪旭,郝曉蓓,楊敏,潘婭嵐,王慶,徐桂華
(南京中醫(yī)藥大學(xué),江蘇 南京 210023)
惡性腫瘤是全世界面臨的重大健康問(wèn)題,其發(fā)病率和病死率正在迅速上升[1]。目前化療仍為惡性腫瘤臨床治療的主要措施,但約有80%的患者在此過(guò)程中會(huì)出現(xiàn)骨髓抑制[2],表現(xiàn)為貧血、出血、免疫力降低等不良反應(yīng),影響化療的療效甚至導(dǎo)致患者死亡[3]。化療誘導(dǎo)造血干細(xì)胞(hematopoietic stem cells,HSCs)的衰老,造成其自我更新能力受損,這是骨髓抑制發(fā)生最為關(guān)鍵的機(jī)制[4]。造血微環(huán)境(即造血龕)主要包括基質(zhì)細(xì)胞、細(xì)胞因子、細(xì)胞外基質(zhì)等,參與支持和調(diào)控造血干細(xì)胞的自我更新、靜息、凋亡等功能[5]。間充質(zhì)干細(xì)胞(mesenchymal stem cells,MSCs)可分泌不同細(xì)胞因子和傳遞信號(hào)分子,具有免疫調(diào)節(jié)和支持造血的功能,是造血微環(huán)境中的重要成員之一[6-7]。臨床發(fā)現(xiàn)通過(guò)MSCs 和HSCs 共移植能夠促進(jìn)造血微環(huán)境恢復(fù)[8]。同時(shí),MSCs 與HSCs 體外共培養(yǎng),對(duì)HSCs 體外增殖具有明顯的積極作用[9]。研究發(fā)現(xiàn)Notch 信號(hào)通路可調(diào)控HSCs的自我更新能力,其受體和配體高表達(dá)于造血微環(huán)境和HSCs 中,同時(shí)Notch 通路在調(diào)節(jié)細(xì)胞增殖、分化過(guò)程中具有極為重要的作用[10]。
近年來(lái)基于多組分和多靶點(diǎn)的中醫(yī)藥治療骨髓抑制已引起廣泛關(guān)注,與口服升白藥等現(xiàn)代醫(yī)學(xué)治療藥物相比,毒副作用小,可明顯改善患者的骨髓抑制癥狀,提升其生活質(zhì)量。中醫(yī)食療是中醫(yī)藥學(xué)的重要組成部分,以食助藥力、藥助食威。研究表明中醫(yī)食療應(yīng)用于化療后骨髓抑制,是“藥、食、養(yǎng)”結(jié)合,臨床療效確切,同時(shí)具有簡(jiǎn)單方便、適口性好的優(yōu)勢(shì)[11]。課題組在總結(jié)前期由黃芪、當(dāng)歸、豬蹄為主要成分的歸芪豬蹄食療方改善化療后骨髓抑制臨床療效和對(duì)造血微環(huán)境保護(hù)作用的基礎(chǔ)上[12-14],基于“精氣血”互生理論進(jìn)行了處方優(yōu)化,加入黃精組成扶正補(bǔ)血食療方,提出扶正補(bǔ)血食療方可能對(duì)化療后HSCs發(fā)揮保護(hù)作用,因此本研究擬通過(guò)5-FU 損傷小鼠骨髓間充質(zhì)干細(xì)胞(bone marrow-mesenchymal stem cells,BMSCs)和HSCs 體外共培養(yǎng)模型,觀察扶正補(bǔ)血食療方含藥血清對(duì)模擬“造血龕”中HSCs 增殖、凋亡以及Notch 信號(hào)通路基因表達(dá)的影響,初步探討扶正補(bǔ)血食療方調(diào)控骨髓造血功能的分子機(jī)制。
1 材料
1.1 實(shí)驗(yàn)動(dòng)物
SPF 級(jí)SD 大鼠20 只,雄性,3~4 周齡,體質(zhì)量(180 ± 20)g,購(gòu)買于杭州醫(yī)學(xué)院,合格證號(hào):SCXK(浙)2019-0002。SPF 級(jí)C57BL/6 小鼠,4~6 周齡,雄性,體質(zhì)量18~20 g;購(gòu)于南京青紫蘭科技有限公司,合格證號(hào):SCXK(蘇)2016-0010。于南京中醫(yī)藥大學(xué)實(shí)驗(yàn)動(dòng)物中心進(jìn)行飼養(yǎng),自由飲食、飲水,室溫(22 ±2)℃,濕度40%~60%,并已經(jīng)獲得南京中醫(yī)藥大學(xué)倫理委員會(huì)批準(zhǔn)(批準(zhǔn)號(hào):201910A018)。
1.2 實(shí)驗(yàn)用試劑
DMEM-F12 培養(yǎng)基(美國(guó),HyClone);胎牛血清(美國(guó),Gibco);青霉素-鏈霉素(美國(guó),Gibco);0.25%胰蛋白酶(上海,碧云天生物技術(shù)有限公司);CD29-FITC,CD44-FITC,CD117-APC(美國(guó),eBioscience);5-Fluorouracil(德國(guó),Sigma);Cell Counting Kit-8(日本,同仁);細(xì)胞周期檢測(cè)試劑盒(江蘇凱基生物技術(shù)股份有限公司);細(xì)胞凋亡檢測(cè)試劑盒(南京福麥斯生物技術(shù)有限公司);Ficoll 分離液(天津,TBD);CD117 MicroBeads,mouse(德國(guó),Miltenyi Biotec);mouse SCF,mouse IL-3(上海,novoprotein);TRIzol 試劑(美國(guó),ABI);逆轉(zhuǎn)錄試劑盒,qPCR 試劑盒(湖南艾科瑞生物工程有限公司)。
1.3 實(shí)驗(yàn)用儀器
CO2培養(yǎng)箱(日本,Panasonic);垂直超凈工作臺(tái)(蘇州安泰空氣技術(shù)有限公司);Gallios 型流式細(xì)胞儀(美國(guó),Beckman);MACS 免疫磁珠分選系統(tǒng)(德國(guó),Miltenyi Biotec);Synergy H1MD 型多功能酶標(biāo)儀(美國(guó),Bio-Tek);DMi8型倒置熒光顯微鏡(德國(guó),Leica);5810R 型高速冷凍離心機(jī)(德國(guó),Eppendprf);Step One Plus 實(shí)時(shí)熒光定量PCR儀(美國(guó),ABI)。
2 方法
2.1 扶正補(bǔ)血食療方含藥血清制備
扶正補(bǔ)血食療方中當(dāng)歸:黃芪:黃精:豬蹄質(zhì)量比例為1∶5∶2∶60。取豬蹄1 200 g洗凈切塊,放入砂鍋并加水煮沸,去除浮沫洗凈后再加入1 800 mL 清水,煮沸后改用文火熬制2.5 h。取當(dāng)歸20 g、黃芪100 g、黃精40 g 加水浸泡0.5 h 后加入豬蹄湯內(nèi),先大火煮沸10 min,后改文火煎50 min,過(guò)濾殘?jiān)⒅? ℃過(guò)夜。第2天去除上層油脂,放入37 ℃水浴,旋蒸濃縮至生藥濃度為0.504 g/mL,分裝后置于4 ℃保存?zhèn)溆谩O嚓P(guān)藥材購(gòu)于江蘇省中醫(yī)院,經(jīng)南京中醫(yī)藥大學(xué)中藥鑒定教研室鑒定質(zhì)量合格,豬蹄購(gòu)于南京市內(nèi)超市,具有食品合格證書(shū)。
20 只SD 大鼠隨機(jī)分為灌胃組和空白組,適應(yīng)性喂養(yǎng)1 周后,按照1 mL/100 g 劑量灌胃,灌胃組灌服扶正補(bǔ)血食療方,空白組灌服等體積生理鹽水,并于每天上午9 時(shí)灌胃1 次,連續(xù)7日。于末次灌胃1 h 后腹主動(dòng)脈取血,室溫靜置2 h,3 000 r/min 離心20 min,取上清并于56 ℃水浴30 min,過(guò)濾除菌后,分裝凍存于-80 ℃保存?zhèn)溆谩?/p>
2.2 小鼠骨髓間充質(zhì)干細(xì)胞體外培養(yǎng)、傳代及鑒定
取4~6 周齡雄性C57BL/6 小鼠,脫頸處死,放入75%乙醇中浸泡3~5 min,無(wú)菌條件下分離雙側(cè)脛骨和股骨,剪去兩側(cè)骨端,用培養(yǎng)基反復(fù)沖洗骨髓腔至骨髓腔變白,吹打均勻后接種于60 mm無(wú)菌培養(yǎng)皿中,置于37 ℃、5%CO2飽和濕度的培養(yǎng)箱中培養(yǎng)。48 h 后全量換液,隨后每2~3 d 換液1 次,細(xì)胞長(zhǎng)至70%~80%融合時(shí),按1∶2 消化傳代,傳至第3 代后備用。收集第3 代的小鼠骨髓間充質(zhì)干細(xì)胞,調(diào)整細(xì)胞數(shù)為1 × 106個(gè)/管,分別加入抗小鼠CD29-FITC,CD44-FITC,CD117-APC,4 ℃避光孵育30 min 后,PBS 洗2次,流式細(xì)胞儀檢測(cè)。
2.3 小鼠骨髓CD117+造血干細(xì)胞免疫磁珠分選及鑒定
同“2.2”項(xiàng)下方法獲得骨髓細(xì)胞后,過(guò)200 目濾網(wǎng),450 ×g離心10 min,棄上清。用1 mL 無(wú)菌PBS 重懸,加入2 mL 小鼠Ficoll 分離液中,400 ×g離心30 min。收集第二層環(huán)狀乳白色細(xì)胞層并加入PBS 重懸,400 ×g離心10 min。運(yùn)用MACS 免疫磁珠分選系統(tǒng)分選CD117+細(xì)胞。調(diào)整細(xì)胞數(shù)為1×105每管,加入抗小鼠CD117-APC,4 ℃避光孵育30 min 后,PBS 洗2 次,流式細(xì)胞儀檢測(cè)。剩余HSCs 用DMEM-F12 培養(yǎng)基(含10% FBS、25 ng/mL SCF、25 ng/mL IL-3、1%青霉素-鏈霉素)重懸,調(diào)整細(xì)胞密度為1 × 106個(gè)/mL接種于培養(yǎng)瓶中,置于培養(yǎng)箱內(nèi)培養(yǎng)。
2.4 共培養(yǎng)細(xì)胞分組
選擇對(duì)數(shù)生長(zhǎng)期的小鼠BMSCs,按1.5×106個(gè)/孔種植于6孔板,待細(xì)胞貼壁之后,換無(wú)血清DMEM/F12培養(yǎng)基使細(xì)胞生長(zhǎng)同步化12 h,干預(yù)24 h后將“2.3”項(xiàng)下方法分離提取的CD117+細(xì)胞按5 × 105個(gè)/mL 與下面3 組BMSCs進(jìn)行共培養(yǎng)。隨機(jī)分為以下3組:空白組,BMSCs+10% 空白血清;5-FU 組,BMSCs+10% 空白血清+50μg/mL 5-FU;扶正補(bǔ)血食療方含藥血清組,BMSCs+10%扶正補(bǔ)血食療方含藥血清+50μg/mL 5-FU。共培養(yǎng)48 h以后收集CD117+細(xì)胞做后續(xù)相關(guān)檢測(cè)。
2.5 CCK-8法檢測(cè)小鼠骨髓造血干細(xì)胞增殖
按“2.5”項(xiàng)下方法進(jìn)行細(xì)胞分組,將小鼠BMSCs和HSCs種植于24孔板中,每組設(shè)3個(gè)復(fù)孔,其中BMSCs為5 × 104個(gè)/孔、HSCs 為1 × 104個(gè)/孔。收集各組懸浮的CD117+細(xì)胞,每孔樣本單獨(dú)離心,加入無(wú)血清DMEM/F12培養(yǎng)基重懸混勻后添加至96孔板中,并加入CCK-8試劑10μL/孔,于37 ℃CO2敷箱中孵育5 h,使用酶標(biāo)儀在450 nm處的吸光度值,實(shí)驗(yàn)重復(fù)3次取平均值。
存活率(IR)=[(實(shí)驗(yàn)組OD 值均數(shù)-空白組OD 值均數(shù))/(對(duì)照組OD值均數(shù)-空白組OD值均數(shù))]×100%
2.6 流式細(xì)胞術(shù)分析小鼠骨髓造血干細(xì)胞的細(xì)胞周期
收集各組懸浮的CD117+細(xì)胞,PBS 洗滌2 次,離心去上清,加入500μL 70%冷乙醇4 ℃固定2 h。染色前用PBS,1 000 rpm 離心3 min 洗去固定液,加入500μL PI/RNase A 工作液(RNase A∶PI比例為1∶9),室溫避光孵育30 min,上流式細(xì)胞儀分析CD117+細(xì)胞的細(xì)胞周期。
2.7 流式細(xì)胞術(shù)分析小鼠骨髓造血干細(xì)胞的細(xì)胞凋亡
收集各組懸浮的CD117+細(xì)胞,用預(yù)冷的PBS 洗細(xì)胞2 次,用100μL 緩沖液重懸細(xì)胞,加入5μL Annexin V/Alexa Fluor 647 和10μL 20μg/mL 的碘化丙錠溶液,混勻后于室溫避光孵育15 min,在管中加400 μL PBS混勻后上機(jī),流式細(xì)胞儀分析。
2.8 qRT-PCR 檢測(cè)小鼠骨髓造血干細(xì)胞中Notch 信號(hào)通路相關(guān)的基因表達(dá)
收集各組懸浮的CD117+細(xì)胞,PBS 洗滌2 次,采用TRIzol法提取CD117+細(xì)胞的總RNA,檢測(cè)RNA 濃度和純度并逆轉(zhuǎn)錄成cDNA,以GAPDH 作為內(nèi)參,做qRTPCR 檢測(cè)骨髓造血干細(xì)胞中Notch 信號(hào)通路相關(guān)的基因表達(dá),所用引物序列見(jiàn)表1,采用2-△△T法計(jì)算均值作為相對(duì)表達(dá)量。

表1 引物序列
2.9 統(tǒng)計(jì)學(xué)分析
采用SPSS 25.0軟件進(jìn)行對(duì)數(shù)據(jù)分析,結(jié)果用±s表示,滿足正態(tài)性和方差齊性的計(jì)量資料采用單因素方差分析;方差不齊者采用Dunett′s T3檢驗(yàn),不符合正態(tài)性者采用Kruskal-Wallis H 非參數(shù)檢驗(yàn)。以P<0.05為差異具有統(tǒng)計(jì)學(xué)意義。
3 結(jié)果
3.1 小鼠骨髓間充質(zhì)干細(xì)胞的分離、培養(yǎng)及鑒定
原代培養(yǎng)48 h 后絕大部分細(xì)胞已經(jīng)貼壁,并呈現(xiàn)多角形、梭形、圓形等不均一的細(xì)胞形態(tài)等(見(jiàn)圖1A)。培養(yǎng)6~8 d后,細(xì)胞大部分呈扁平形或紡錘形,細(xì)胞融合達(dá)50%~60%(見(jiàn)圖1B)。傳至第3 代后細(xì)胞主要呈長(zhǎng)梭形排列,細(xì)胞基本在24 h內(nèi)貼壁,不規(guī)則雜細(xì)胞較少,間充質(zhì)干細(xì)胞逐漸純化(見(jiàn)圖1C)。流式細(xì)胞術(shù)檢測(cè)小鼠BMSCs 中97.5%呈CD29 陽(yáng)性,98.8%呈CD44陽(yáng)性,僅0.17%呈C-kit陽(yáng)性(見(jiàn)圖2A~C)。
3.2 小鼠CD117+細(xì)胞的形態(tài)及鑒定
倒置顯微鏡觀察分選出的小鼠骨髓造血干細(xì)胞體積偏小,細(xì)胞形態(tài)為圓形(見(jiàn)圖1D),行臺(tái)盼藍(lán)染色后99%細(xì)胞拒染。流式細(xì)胞術(shù)檢測(cè)小鼠HSCs 中90.3%呈CD117 陽(yáng)性(見(jiàn)圖2D)。
3.3 共培養(yǎng)各組細(xì)胞形態(tài)
共培養(yǎng)空白組可見(jiàn)底層小鼠BMSCs 細(xì)胞呈梭形生長(zhǎng),排列緊密,融合度高;小鼠CD117+細(xì)胞為圓形細(xì)胞,成團(tuán)或單獨(dú)懸浮生長(zhǎng)于底層細(xì)胞表面,少數(shù)散落在底層小鼠BMSCs 間隙中(見(jiàn)圖3A)。共培養(yǎng)5-FU 組可見(jiàn)底層小鼠BMSCs 細(xì)胞形狀不規(guī)則,小鼠CD117+細(xì)胞呈圓形懸浮生長(zhǎng)于底層細(xì)胞表面,數(shù)量均顯著減少(見(jiàn)圖3B)。共培養(yǎng)扶正補(bǔ)血食療方含藥血清組底層小鼠BMSCs 和小鼠CD117+細(xì)胞形態(tài)和生長(zhǎng)狀態(tài)基本同共培養(yǎng)5-FU 組,但細(xì)胞數(shù)量明顯增加(見(jiàn)圖3C)。
3.4 CCK-8法檢測(cè)小鼠骨髓造血干細(xì)胞增殖
與空白組相比,5-FU 組小鼠CD117+細(xì)胞活性顯著降低(P<0.05);與5-FU 組相比,扶正補(bǔ)血食療方含藥血清干預(yù)后明顯促進(jìn)小鼠CD117+細(xì)胞增殖(P<0.05)。見(jiàn)表2。
表2 扶正補(bǔ)血食療方含藥血清對(duì)HSCs細(xì)胞增殖的影響(±s,n=3)

表2 扶正補(bǔ)血食療方含藥血清對(duì)HSCs細(xì)胞增殖的影響(±s,n=3)
注:與空白組比較,1)P <0.05;與5-FU組比較,2)P <0.05。
組別空白組5-FU組扶正補(bǔ)血食療方注A450nm 3.30±0.44 1.15±0.061)1.81±0.192)存活率(%)-0.32±0.031)0.54±0.022)
3.5 流式細(xì)胞術(shù)分析小鼠骨髓造血干細(xì)胞細(xì)胞凋亡和細(xì)胞周期
與空白組相比,應(yīng)用5-FU 刺激后小鼠CD117+細(xì)胞總凋亡率顯著增加(P<0.05);而小鼠CD117+細(xì)胞經(jīng)扶正補(bǔ)血食療方含藥血清處理后,含藥血清組的細(xì)胞總凋亡率下降(P<0.05)。與空白組相比,5-FU 組小鼠CD117+細(xì)胞的G0/G1 期細(xì)胞占比明顯增加(P<0.05);與5-FU 組比較,扶正補(bǔ)血食療方含藥血清組的G0/G1 期細(xì)胞占比減少(P<0.05),這表明共培養(yǎng)條件下5-FU 組的小鼠CD117+細(xì)胞出現(xiàn)G1 期阻滯,而扶正補(bǔ)血食療方含藥血清干預(yù)抑制了小鼠CD117+細(xì)胞的休眠狀態(tài),細(xì)胞周期更加活躍。見(jiàn)表3。
表3 扶正補(bǔ)血食療方含藥血清對(duì)HSCs細(xì)胞凋亡和細(xì)胞周期阻滯的影響(±s,n=3)
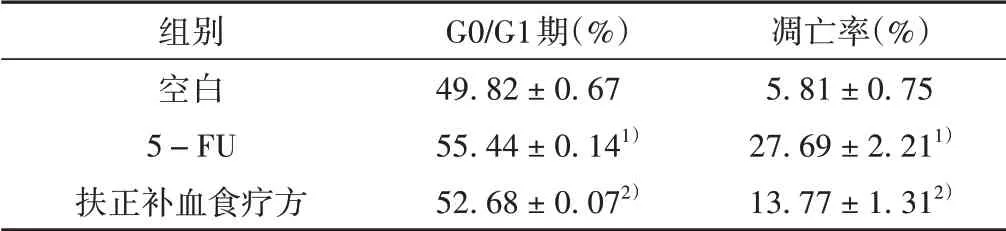
表3 扶正補(bǔ)血食療方含藥血清對(duì)HSCs細(xì)胞凋亡和細(xì)胞周期阻滯的影響(±s,n=3)
注:與空白組比較,1)P <0.05;與5-FU組比較,2)P <0.05。
組別空白5-FU扶正補(bǔ)血食療方G0/G1期(%)49.82±0.67 55.44±0.141)52.68±0.072)凋亡率(%)5.81±0.75 27.69±2.211)13.77±1.312)
3.6 qRT-PCR 檢測(cè)小鼠骨髓造血干細(xì)胞中Notch 信號(hào)通路相關(guān)的基因表達(dá)結(jié)果
與空白組相比,5-FU 組小鼠CD117+細(xì)胞Jagged1、Notch1、Notch2 基因表達(dá)降低(P<0.05),經(jīng)扶正補(bǔ)血食療方含藥血清干預(yù),含藥血清組細(xì)胞Jagged1、Notch1、Notch2 基因表達(dá)均增加(P<0.05)。見(jiàn)表4。
表4 扶正補(bǔ)血食療方含藥血清對(duì)HSCs中Notch mRNA表達(dá)水平的影響(±s,n=3)

表4 扶正補(bǔ)血食療方含藥血清對(duì)HSCs中Notch mRNA表達(dá)水平的影響(±s,n=3)
注:與空白組比較,1)P <0.05;與5-FU組比較,2)P <0.05。
組別空白組5-FU組扶正補(bǔ)血食療方組Jagged1/GAPDH 1.03±0.27 0.17±0.101)1.69±0.542)Notch1/GAPDH 1.01±0.19 0.14±0.041)0.67±0.212)Notch2/GAPDH 1.00±0.12 0.64±0.261)1.37±0.062)
4 討論
骨髓抑制是接受化療的惡性腫瘤患者常見(jiàn)的劑量限制副作用,目前促進(jìn)造血功能恢復(fù)的可用方法仍然有限。造血是通過(guò)HSCs協(xié)調(diào)的自我更新、增殖和分化而發(fā)生的一個(gè)連續(xù)的血細(xì)胞產(chǎn)生過(guò)程。因此當(dāng)高劑量化療損害HSCs的再生和分化潛能時(shí),就會(huì)發(fā)生以全血細(xì)胞減少為主的造血功能不足,甚至演變成危及生命的并發(fā)癥。骨髓造血微環(huán)境由多種細(xì)胞和因子共同構(gòu)成構(gòu)成,主要為HSCs提供存活所需要的養(yǎng)分和傳導(dǎo)信號(hào),達(dá)到調(diào)控HSCs 的功能的作用。MSCs 是骨髓造血生態(tài)位的重要組成部分,在造血譜系細(xì)胞的發(fā)育、維持和增殖中發(fā)揮作用[15]。研究發(fā)現(xiàn)MSCs和HSCs共培養(yǎng)構(gòu)成的造血“龕”,提供了類似骨髓的微環(huán)境,有利于促進(jìn)HSCs的維持和增殖。同時(shí)MSCs能夠分泌多種與造血相關(guān)的細(xì)胞因子,如IL-6、LIF、SCF 等,直接促進(jìn)HSC 增殖[16]。王曉玲等[17]通過(guò)模擬輻射旁效應(yīng)HSCs與BMSCs 的共培養(yǎng)模型,發(fā)現(xiàn)“芪歸藥對(duì)”載藥血清可能通過(guò)抑制NF-κB 通路,降低HSCs 凋亡率并促進(jìn)其增殖,抵抗了HSCs輻射損傷。當(dāng)MSCs與HSCs直接接觸時(shí),MSCs 分泌多種黏附因子,HSCs 上也表達(dá)相應(yīng)的配體[18],與其他共培養(yǎng)方式相比,二者直接接觸支持HSCs 增殖的效果更明顯[19]。因此本研究選擇將BMSCs 和HSCs 共培養(yǎng),建立化療后骨髓抑制的造血“龕”模型,探究扶正補(bǔ)血食療方是否可以通過(guò)保護(hù)造血“龕”功能,達(dá)到保護(hù)造血“龕”中造血干細(xì)胞的目的。
Notch 信號(hào)通路具有高保守性并廣泛存在于脊椎和非脊椎動(dòng)物中。Notch是一種跨膜受體,由配體-受體相互作用激活,被裂解釋放其胞內(nèi)結(jié)構(gòu)域,直接影響靶基因的轉(zhuǎn)錄。此過(guò)程通過(guò)介導(dǎo)細(xì)胞間信號(hào)傳導(dǎo),在造血系統(tǒng)中發(fā)揮著調(diào)節(jié)造血的關(guān)鍵作用[20]。Rafii 課題組發(fā)現(xiàn),輻照后重度骨髓抑制小鼠的Notch 信號(hào)激活,有利于抵抗HSCs 損傷和維持HSCs 自我更新[21]。在HSCs中Notch信號(hào)通路高度活化,成骨細(xì)胞中Notch配體Jagged1 表達(dá),并激活HSCs 上Notch 受體Notch1 的表達(dá),HSCs 數(shù)量顯著增加[22]。VARNUM-FINNEY 等認(rèn)為通過(guò)Jagged1-Notch2信號(hào)調(diào)控5-FU 化療后骨髓抑制小鼠短期和長(zhǎng)期造血重建,且抑制了髓系分化[23]。研究證明MSCs上激活的Jagged1表達(dá)增強(qiáng)了Notch2信號(hào),抑制p63 并促進(jìn)抗凋亡蛋白Bcl-2 的表達(dá),減少HSCs 凋亡并改善造血恢復(fù)[24]。同時(shí),Notch 信號(hào)通路下游主要靶分子也在HSCs 高表達(dá)[25]。提示Notch 信號(hào)途徑可能在HSCs 維持和再生過(guò)程中發(fā)揮著重要調(diào)控作用。
中醫(yī)古籍中并沒(méi)有骨髓抑制的記載,可將其歸屬于“血虛”“虛勞”范疇[26]。大多數(shù)學(xué)者認(rèn)為骨髓抑制的病因?yàn)椤捌⒛I兩虛”“氣血不足”,因此中醫(yī)主張健脾補(bǔ)腎、補(bǔ)血益氣[27-28]。中醫(yī)食療方主要起到健脾養(yǎng)胃的功效,可有效改善臨床患者化療期間如乏力、疼痛、失眠和食欲低下等的不良反應(yīng)[29]。本研究中扶正補(bǔ)血食療方由當(dāng)歸、黃芪、黃精及豬蹄組成,方中重用黃芪,黃芪為補(bǔ)中益氣之要藥,補(bǔ)氣而行血;當(dāng)歸補(bǔ)血活血,以使陽(yáng)生陰長(zhǎng),氣旺血生;黃精補(bǔ)氣養(yǎng)陰、益腎填精,平補(bǔ)肺、脾、腎三經(jīng);豬蹄甘、咸、平,養(yǎng)腎填精。精氣血互生,共奏固本培元之功,契合中醫(yī)對(duì)惡性腫瘤化療后骨髓抑制的治療理念。課題組通過(guò)高效液相色譜實(shí)驗(yàn)檢測(cè)扶正補(bǔ)血食療方發(fā)現(xiàn),本食療方含有多種活性成分,如黃芪甲苷、當(dāng)歸多糖、黃精皂苷、阿魏酸等,現(xiàn)代藥理研究證明其具有提高免疫力、抗腫瘤、抗氧化和保護(hù)臟器的功效[30-31],同時(shí)也可直接或間接促進(jìn)HSCs 增殖,改善造血干細(xì)胞衰老[32-33]。豬蹄中豐富的膠原蛋白及被消化分解后產(chǎn)生的小分子肽,也具有補(bǔ)血、抗氧化及抗癌的積極作用[34]。
研究結(jié)果顯示,扶正補(bǔ)血食療方含藥血清可以顯著提高5-FU損傷的小鼠HSCs細(xì)胞活力,同時(shí)使停滯在靜止期的HSCs 減少,細(xì)胞總凋亡率下降,說(shuō)明扶正補(bǔ)血食療方可以通過(guò)促進(jìn)小鼠HSCs G0/G1 期細(xì)胞向S 期轉(zhuǎn)變,促進(jìn)HSCs 增殖。扶正補(bǔ)血食療方可能通過(guò)增強(qiáng)BMSCs 和HSCs 之間的黏附作用,使更多的HSCs進(jìn)入增殖期,為減少周期依賴性化療藥物5-FU 摻入到增殖的HSCs 的RNA 中,抑制其DNA 合成或干擾分化而發(fā)揮輔助作用,減少HSCs 受損。與對(duì)照組相比,5-FU 組小鼠CD117+細(xì)胞Jagged1、Notch1、Notch2 基因表達(dá)降低;與5-FU組相比,扶正補(bǔ)血食療方含藥血清組細(xì)胞Jagged1、Notch1、Notch2 基因表達(dá)均增加,結(jié)果說(shuō)明,扶正補(bǔ)血食療方能在一定程度上促進(jìn)HSCs增殖,其機(jī)制可能與激活Notch 信號(hào)通路,上調(diào)Jagged1、Notch1、Notch2 的表達(dá)有關(guān)。基于組成本食療方的中藥和食物的成分多樣,本研究選用含藥血清進(jìn)行體外實(shí)驗(yàn),更符合食療方在體內(nèi)被消化、吸收、代謝和入血的過(guò)程,并得到最終的有效物質(zhì)成分[35]。本研究表明拮抗HSCs化療后損傷的物質(zhì)基礎(chǔ),可能與其富含的多種抗炎抗氧化、補(bǔ)血、抗癌的活性成分有關(guān),同時(shí)Notch信號(hào)通路參與調(diào)控,通過(guò)上調(diào)Notch 通路關(guān)鍵因子Jagged1、Notch1、Notch2表達(dá)水平,調(diào)節(jié)造血“龕”功能,進(jìn)而促進(jìn)HSCs增殖,降低凋亡率,緩解HSCs化療損傷程度。綜上所述,本研究初步闡釋了扶正補(bǔ)血食療方拮抗化療毒副作用的機(jī)制,為中醫(yī)食療應(yīng)用于臨床防治骨髓抑制提供了實(shí)驗(yàn)依據(jù)。但目前仍存在一定局限性,課題組計(jì)劃對(duì)食療方中主要有效成分進(jìn)行全面分析和提純,更加明確其作用機(jī)制。同時(shí),對(duì)于Notch 信號(hào)通路蛋白表達(dá)情況,上、下游靶點(diǎn)以及具體調(diào)控機(jī)制,仍需進(jìn)一步深入研究。
- 中醫(yī)藥信息的其它文章
- 早發(fā)性卵巢功能不全的顆粒細(xì)胞凋亡機(jī)制及中醫(yī)藥干預(yù)研究進(jìn)展
- 中藥組分抗類風(fēng)濕作用機(jī)制研究新進(jìn)展
- 當(dāng)歸多糖的化學(xué)結(jié)構(gòu)、藥理作用及構(gòu)效關(guān)系研究進(jìn)展
- 電針肘部經(jīng)筋結(jié)點(diǎn)對(duì)中風(fēng)后痙攣期肘關(guān)節(jié)活動(dòng)度的影響
- 養(yǎng)心方對(duì)缺血性腦卒中后睡眠障礙患者睡眠質(zhì)量及血清5-HT、BDNF水平的影響
- 熱敏灸聯(lián)合溫陽(yáng)散寒、逐瘀通絡(luò)湯治療膝關(guān)節(jié)骨性關(guān)節(jié)炎(陽(yáng)虛寒凝證)的臨床研究

