基于單細胞超高通量篩選的α-1,2-巖藻糖基轉移酶定向進化
張雪 譚玉萌 蔣海霞 楊廣宇
(上海交通大學生命科學技術學院 微生物代謝國家重點實驗室,上海 200240)
巖藻糖基修飾的糖復合物廣泛參與細胞粘附,炎癥反應,免疫應答和受精等多種生理活動[1]。多種巖藻糖基化寡糖參與癌癥中的信號傳導、腫瘤的發生和轉移等過程[2-3],具有開發成為癌癥治療性疫苗的潛力,如Globo H-KLH疫苗已應用于轉移性乳腺癌的二期臨床[4-5],Lewis Y抗原的結合疫苗已被證明對癌細胞具有細胞毒性,可以誘導免疫反應[6]。2′-巖藻糖基乳糖是母乳中的一類特殊益生元,占人乳寡糖成分的30%左右[7],具有促進嬰兒的大腦發育、免疫調節、炎癥抑制及抗病原微生物感染等作用[8-12]。2′-巖藻糖基乳糖已被美國食品藥品管理局(FDA)批準為安全通用食品(GRAS),并被歐洲食品安全局(EFSA)批準為新型食品(NF)[13],可以作為嬰兒配方奶粉中添加的食品成分、膳食補充劑和醫藥成分。2016年開始,雅培和雀巢分別將含有2′-巖藻糖基乳糖成分的人乳寡糖成分引入銷售的嬰兒配方奶粉中。
α-1,2-巖藻糖基轉移酶是催化合成2′-巖藻糖基乳糖的關鍵生物催化劑[14]。2006 年,Drouillard等[15]首次在大腸桿菌中表達了來源于幽門螺桿菌Helicobacter pylori NCTC11639 的 α-1,2-巖藻糖基轉移酶FutC;2015年Chin等[16]利用FutC在大腸桿菌中對2′-巖藻糖基乳糖進行了從頭合成;2017年南開大學的 Huang 等[17]對 11 種不同來源的 α-1,2-巖藻糖基轉移酶基因進行了比較,結果表明FutC對2′-巖藻糖基乳糖的合成產量是最高的。然而,野生型的FutC的催化活力仍較低,限制了其在工業生產中的應用。
定向進化是一項蛋白質工程技術,通過突變及高通量篩選的循環,能夠有效提升酶的功能[18-19]。然而,由于糖基轉移酶催化的糖苷鍵形成并不直接產生熒光或吸光度的明顯變化,難以進行高通量篩選,因此對于此類酶的進化是一個具有挑戰性的難題。2006年Aharoni 等[20]提出一種針對糖基轉移酶的FACS胞內熒光捕獲策略,通過位于細胞膜上的乳糖透過酶(lactose permease,LacY)對酶催化熒光底物和產物之間的細胞膜通透性差異,實現了糖基轉移酶的高效篩選(圖1為應用于FutC的FACS胞內熒光捕獲策略)。本實驗室在此基礎上引入了雙熒光底物系統,有效避免了由于篩選底物導致的假陽性突變[21]。我們在前期工作中利用這一方法,獲得了催化活性顯著提升的糖基轉移酶突變體[21-22]。在本研究中,拓展了上述篩選方法在α-1,2-巖藻糖基轉移酶中的應用,利用能與α-1,2-巖藻糖基轉移酶FutC反應的熒光受體底物,建立了針對FutC的FACS超高通量篩選方法,并利用定向進化成功得到了活性提高的突變體。

圖1 熒光底物結構和FACS篩選策略示意圖Fig. 1 Fluorescent substrate structure and the schematic diagram of FACS screening strategy
1 材料與方法
1.1 材料
1.1.1 菌種與質粒 E. coli JM107 Nan-LacZ-用于巖藻糖基轉移酶的超高通量篩選,該菌株敲除了nanA和lacZ兩個基因;E. coli 10G用于突變文庫的構建,由本實驗室保存。E. coli BL21(DE3)用于蛋白的表達純化,購于北京全式金生物有限公司。質粒pUC18和pUCKC18-FKP由本實驗室保存,pUC18-FutC由韓國首爾國立大學ByungGee Kim課題組贈送,質粒pET24a購自武漢淼靈生物科技有限公司。
1.1.2 主要試劑及培養基 PrimeSTAR Max Premix DNA聚合酶購于日本TaKaRa公司;DreamTaq DNA聚合酶,堿性磷酸酶及限制性內切酶購于賽默飛公司;T4 DNA連接酶購于NEB公司;Phanta Max Mix DNA 聚合酶購于南京諾唯贊生物科技股份有限公司。乳糖及巖藻糖購于Sigma公司;GDP-巖藻糖及熒光乳糖由本實驗室保存;1×PBS粉末購于生工生物工程(上海)股份有限公司;乙腈等液相用品購自上海安譜實驗科技股份有限公司。
LB培養基:10 g/L NaCl,10 g/L胰蛋白胨,5 g/L酵母浸粉。M9培養基:1×M9鹽溶液,2 mmol/L MgSO4,4 mmol/L葡萄糖,0.1 mmol/L CaCl2。SOC培養基:0.5 g/L NaCl,20 g/L胰蛋白胨,5 g/L酵母浸粉,2.5 mmol/L KCl,10 mmol/L MgCl2,20 mmol/L 葡萄糖。2YT培養基:4 g/L NaCl,16 g/L胰蛋白胨,10 g/L酵母浸粉。
1.2 方法
1.2.1 FACS篩選方法的建立 構建篩選專用的大腸桿菌菌株,將重組質粒pUCKC18-FKP電擊轉化E.coli JM107 Nan-LacZ-感受態細胞,涂布氯霉素抗性LB平板。次日從平板上挑取單克隆送測序,測序正確的菌株為JM107 Nan-LacZ--pUCKC18-FKP。將JM107 Nan-LacZ--pUCKC18-FKP制備為電轉化感受態,分別將質粒pUC18和pUC18-FutC電轉化至JM107 Nan-LacZ--pUCKC18-FKP中,為篩選的陰性對照菌株和陽性菌株。
為了測試FutC對于兩種熒光底物是否有催化活性,將FutC純酶加入如下反應體系進行反應:反應體系為20 μL,其中含有終濃度為5 mmol/L的GDP-巖 藻 糖,0.5 mmol/L的lactose-bodipy/lactosecoumarin,25 mmol/L(pH 5.6)的 HEPES,100 μg/mL的FutC純酶。37℃反應3 h后,按照乙酸乙酯∶甲醇∶水=7∶2∶1的比例配制展層劑,TLC檢測熒光產物的生成。
將陰性對照菌株與陽性菌株在氨芐青霉素/氯霉素雙抗性平板上劃線活化,挑取單克隆于含有100 μg/mL氨芐青霉素和25 μg/mL氯霉素的5 mL LB液體培養基的試管中,37℃ 220 r/min生長過夜,次日按照4%的比例轉接至5 mL的M9液體培養基試管中,37℃ 220 r/min培養至OD600(UV2 550測定)為0.8-1.0,加入終濃度為0.8 mmol/L的IPTG,20℃220 r/min誘導18 h,取2.4 mL菌液,4 000 r/min離心3 min,棄上清,將菌體加入如下反應體系:反應體系為50 μL,其中含有終濃度為5 mmol/L的巖藻糖,0.5 mmol/L的lactose-bodipy/lactose-coumarin,25 mmol/L的5×M9緩沖液。37℃ 220 r/min反應1 h,將未反應的熒光底物清洗至胞外。清洗流程如下:將反應體系4 000 r/min離心3 min,棄上清,加入1 mL LB培養基輕輕重懸EP管底部的菌體,4 000 r/min離心3 min,重復上步操作,將LB培養基重懸的細菌置于37℃ 220 r/min搖床清洗10 min,4 000 r/min離心3 min,棄上清,用1 mL預冷的PBS重懸菌體,重復該操作一次,最后將收集的菌體重懸于50 μL預冷的PBS溶液中,放置于冰上保存。全程操作在無菌超凈臺中進行。在紫外燈下和流式細胞儀上分別對陽性細胞和陰性細胞進行分析。
FutC的模式分選:將1×PBS粉末溶解于1 L超純水中,用0.22 μm濾膜進行抽濾,121℃高壓滅菌20 min,制備為分選用鞘液。根據流式細胞儀分析陰性和陽性的散點圖確定雙陽性最強、且不落入陰性細菌的P2門,將陽性細菌和陰性細菌分別按照1∶1、1∶10、1∶100、1∶1 000的數目比例混合,各自分選5 000個細菌,將其收集于400 μL 37℃預熱的SOC培養基中,于37℃ 220 r/min搖床復蘇2.5 h,涂布于抗性平板,次日從分選平板上隨機挑取30個細菌進行菌落PCR驗證并測序。
1.2.2 FutC隨機突變庫的構建 以帶有野生型futC基因的pUC18-FutC質粒作為模板,通過易錯PCR構建FutC隨機突變庫。引物設計見表1。
表1 隨機突變庫構建引物設計Table 1 Primers for random mutation library construction
PCR 體系如下:20 ng的 pUC18-FutC,0、0.4、0.6、1 μL MnCl2(10 mmol/L),2 μL Primers(20 μmol/L),10 μL dNTP(2.5 mmol/L),2 μL dCTP(10 mmol/L),2 μL dTTP(10 mmol/L),1 μL DreamTaq DNA polymerase,10 μL 10×DreamTaq buffer,用 ddH2O 補足至100 μL。PCR擴增條件為:預變性 95℃ 3 min;變性 95℃ 30 s;退火58℃ 30 s;延伸 72℃ 90 s;30個循環,之后延伸72℃ 10 min。PCR反應結束后,進行PCR產物純化。將PCR產物和載體pUC18分別用Sac I和Hind III在37℃雙酶切2 h。其中載體雙酶切后用FastAP在37℃去磷酸化2 h。將PCR產物和載體pUC18分別純化后按照如下體系16℃連接過夜:200 ng pUC18線性載體,1 200 ng插入片段FutC,2 μL 10 ×T4 DNA ligase buffer,1 μL T4 DNA ligase,ddH2O 補足至 20 μL。
將連接產物進行純化,取1 μL連接產物電擊轉化E.coli 10G感受態細胞,37℃ 220 r/min復蘇45 min后,用LB培養基將10 μL復蘇菌液稀釋1 000倍,取200 μL涂布LB抗性平板,37℃倒置培養過夜。剩余復蘇菌液接于5 mL 含有100 μg/mL氨芐青霉素的LB液體培養基中,37℃ 220 r/min生長12 h,提取質粒為突變文庫并保存。第2天通過平板計數計算庫容量。隨機從平板上挑取20個轉化子,送測序,計算突變率。將最終獲得的4個不同突變率的突變庫按照1∶1∶1∶1的摩爾比混合,計算得到最終庫容量和突變率。
1.2.3 突變文庫的FACS篩選 取1 μL構建的隨機突變文庫質粒,電轉化JM107-pUCKC18-FKP感受態細胞,復蘇菌液接于5 mL 含有100 μg/mL氨芐青霉素和25 μg/mL氯霉素的LB液體培養基中,37℃220 r/min生長12 h,按照4%的比例轉接至5 mL M9液體培養基中,37℃ 220 r/min培養至OD600為0.8-1.0,加入終濃度為0.8 mmol/L 的IPTG,20℃220 r/min誘導18 h。取2.4 mL菌體與熒光底物反應,反應體系及清洗流程同1.2.1。FACS篩選條件如下:1×PBS作為鞘液,使用85 μm的噴嘴,分選速度為4 000-5 000 evt/s;第一輪和第二輪分選突變體收集于400 μL SOC培養基,復蘇2.5 h后于4 mL LB液體培養基中培養過夜,提取質粒,電轉化進入下一輪分選;第三輪分選得到的5 000個細菌復蘇后涂布抗性平板,隨機挑取平板上100個突變體進入復篩。將突變體在4 mL LB液體培養基的試管中誘導表達,離心收集菌體,用200 μL 25 mmol/L(pH 5.6)的HEPES重懸,通過反復凍融后離心取上清為粗酶液,粗酶液與5 mmol/L GDP-巖藻糖和0.5 mmol/L lactose-bodipy反應20 min后,用TLC初步鑒定反應產物。對粗酶活力提高的突變體進行測序。
1.2.4 FutC野生型和突變體的表達純化及活力測定 以pET24a-FutC作為模板,用全質粒PCR構建獲得的突變體,PCR產物轉化入E.coli BL21(DE3),挑取測序驗證正確的轉化子接入5 mL LB液體培養基,37℃ 220 r/min 過夜培養12 h,以1%的接種量將菌液轉接到100 μg/mL卡那霉素的250 mL 2YT培養基的搖瓶中,37℃ 220 r/min 培養至 OD600為0.8時,加入終濃度為 0.8 mmol/L的IPTG,20℃誘導22 h,5 000 r/min收集菌體,使用高壓均質儀破碎后,進行蛋白純化,流程如下:
將破碎后的菌體4℃ 12 000 r/min離心20 min,取上清4℃ 12 000 r/min離心40 min,取上清為粗酶液。取出50 mL鎳柱,將柱子中的硫酸鎳溶液流干,用20 mL蒸餾水清洗2遍,20 mL Binding Buffer清洗兩遍;將粗酶液過柱2遍;10 mL Binding Buffer清洗雜蛋白;10 mL Wash Buffer清洗雜蛋白;5 mL Elution Buffer(含80 mmol/L咪唑)過柱子1遍;5 mL Elution Buffer(含250 mmol/L咪唑)過柱子1遍,收集流出液即為純化的蛋白。利用SDS-PAGE檢驗蛋白純度。
活性測定:將純化獲得的野生型及突變體FutC純酶進行反應,反應體系為20 μL,其中含有終濃度為5 mmol/L的GDP-巖藻糖,0.5 mmol/L的lactosebodipy,25 mmol/L(pH 5.6)的 HEPES,0.04 mg/mL的FutC純酶。37℃ 反應20 min,煮沸6 min終止反應,在反應體系中加入100 μL超純水,12 000 r/min高速離心40 min,取80 μL上清進行HPLC分析。HPLC檢測條件:色譜柱為TSK-gel Amide-80(4.6 mm×250 mm,5 μm)型正相親水色譜柱;熒光檢測器(FLD):Ex= 488 nm,Em= 525 nm;流動相A:超純水,流動相C:純乙腈;等度洗脫條件:0-15 min 80%C;流速1 mL/min;進樣量10 μL。比活力公式:R=(A+15.84)/5 665.12。R:比活力 U/mg;A:產物HPLC峰面積。
2 結果
2.1 FutC的胞內熒光富集
通過在乳糖分子上偶聯兩個結構和熒光顏色不同的熒光基團,針對FutC設計了lactose-bodipy和lactose-coumarin兩種熒光底物(圖1-A)。為了驗證FutC確實可以催化這兩種熒光底物的轉化,將其分別與FutC純酶反應,TLC結果如圖2-A所示,FutC可以催化這兩種熒光底物,生成帶有熒光基團的巖藻糖基化乳糖。
E.coli JM107 Nan-LacZ-被用于作為篩選的宿主菌株(圖1-B),該菌株的細胞膜上帶有乳糖透過酶LacY,可以催化熒光乳糖轉運到胞內,此外該菌株還敲除了β半乳糖苷酶基因LacZ,避免了乳糖在胞內的降解。另外引入了表達GDP巖藻糖合酶的質粒pUCKC18-FKP,為FutC提供糖核苷酸供體底物。使用了N端融合了3個天冬氨酸標簽(D3)的futC基因,以增加FutC蛋白的可溶性表達。
對于表達了FutC和不表達FutC(pUC18空載體對照)的大腸桿菌細胞進行胞內熒光捕獲實驗,在紫外燈上進行分析的結果(圖2-B)和流式細胞儀上對兩種細胞的分析結果顯示(圖3),表達FutC的細胞相比于沒有表達FutC的細胞具有明顯增強的熒光信號,說明我們成功實現了兩種熒光產物在胞內的熒光富集。
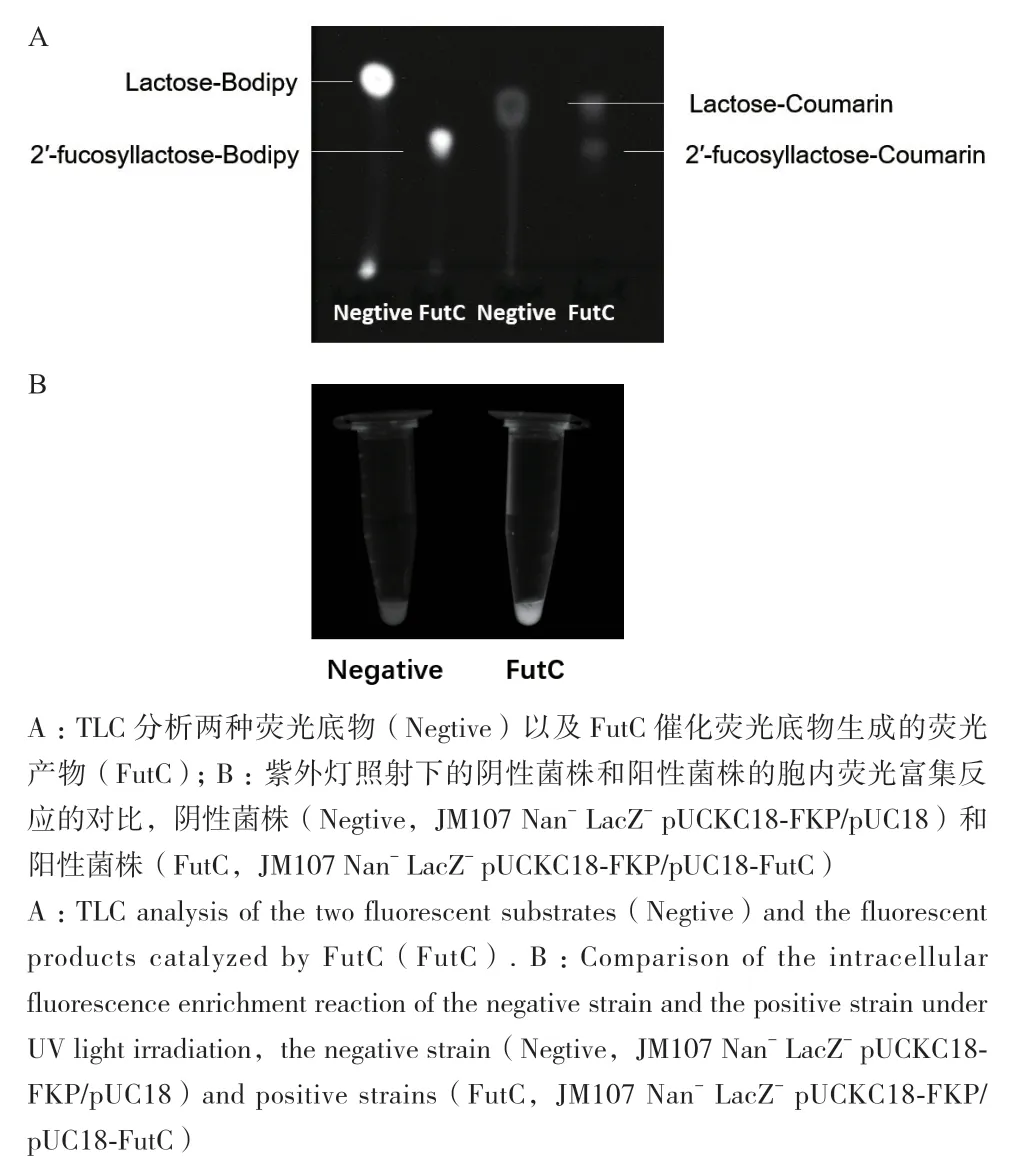
圖2 TLC分析FutC的熒光產物和紫外燈照射分析陰性菌株和陽性菌株的胞內熒光富集反應Fig. 2 TLC analysis of fluorescent products and intracellular fluorescence enrichment reaction analysis of negative and positive strains under UV light irradiation
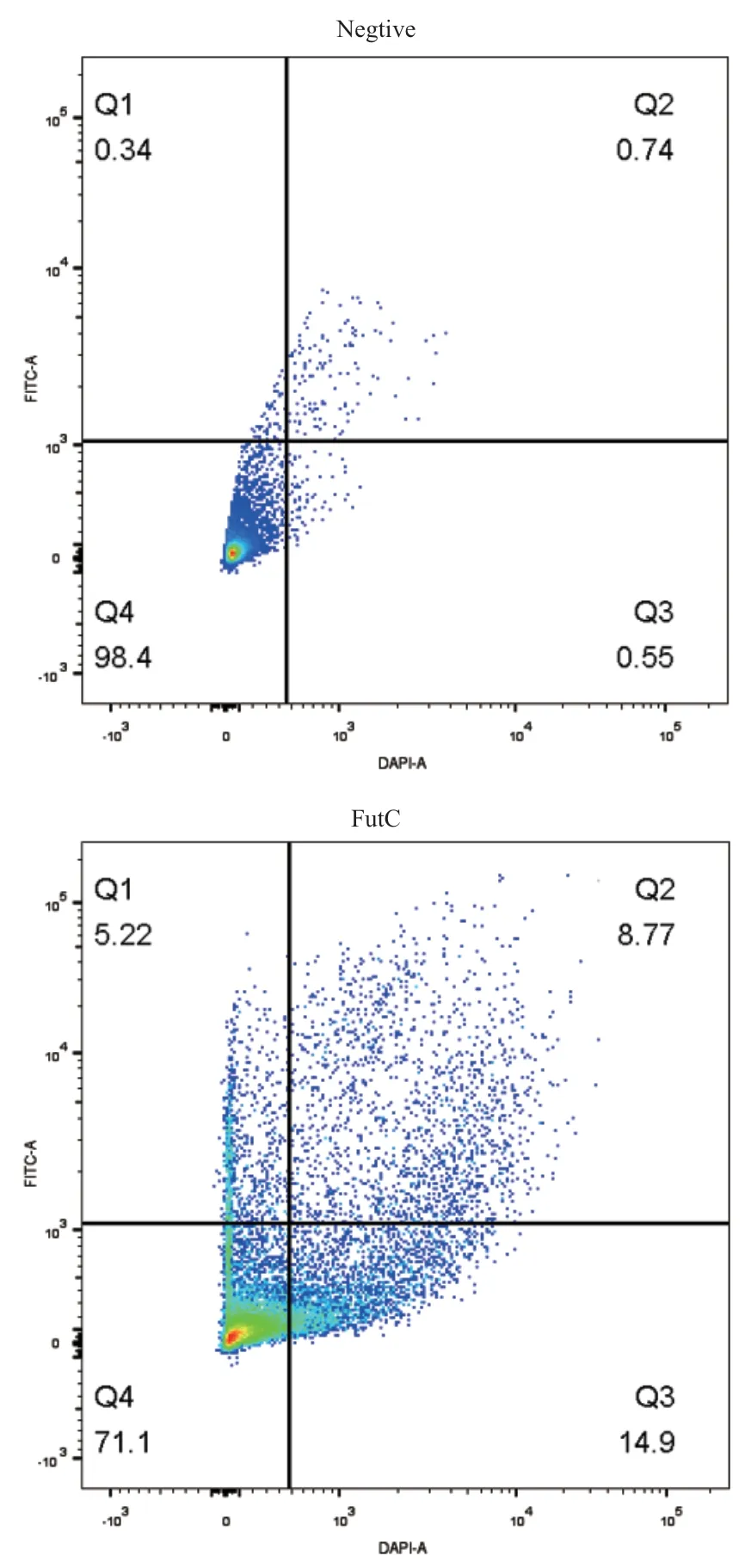
圖3 陰性菌株和陽性菌株的FACS分析Fig. 3 FACS analysis of negative and positive strains
2.2 FutC的單細胞超高通量篩選方法
FutC胞內熒光富集的現象說明大腸桿菌細胞內累積熒光產物的量與其表達α-1,2-巖藻糖基轉移酶的活力形成偶聯,因此可以通過流式細胞儀檢測熒光信號高低,從而區分具有不同催化活力的酶,這是進行FACS篩選的基礎。在定向進化的過程中,具體的篩選流程可以分為5個步驟:步驟1,利用易錯PCR等方法建立FutC的突變庫;步驟2,將突變庫的質粒轉化進入含有GDP-fucose合成酶(FKP)的E.coli細胞,培養并誘導FutC蛋白表達;步驟3,收集培養的細菌和熒光底物反應液進行孵育反應;步驟4,將未反應的熒光底物從胞內清洗出來,只保留巖藻糖基化熒光產物在胞內;步驟5,上機進行FACS分選。
對單細胞超高通量篩選方法的關鍵技術參數進行了優化。在分選收集培養基和復蘇時間方面,營養成分豐富的SOC培養基的復蘇效果好于LB培養基(圖4-A),2.5 h為最佳復蘇時間(圖4-B),這樣的優化使分選后細菌的復蘇率從10%提高至30%以上。此外,還發現對于PBS分選鞘液進行0.22 μm濾膜過濾可以顯著提升分選準確率,而且以商業化CST雙色小球作為分選質量的質控對于提升分選準確率非常重要,當CST小球的分選準確率達到99%以上時,分選效果最佳。經過這樣的優化,細菌在雙陽性目標門P2內對于陽性細菌的分選準確率可以從45.3%提升至73.4%,代表假陽性的Q3區域從占28.9%降低至7.8%(圖4-C,D)。
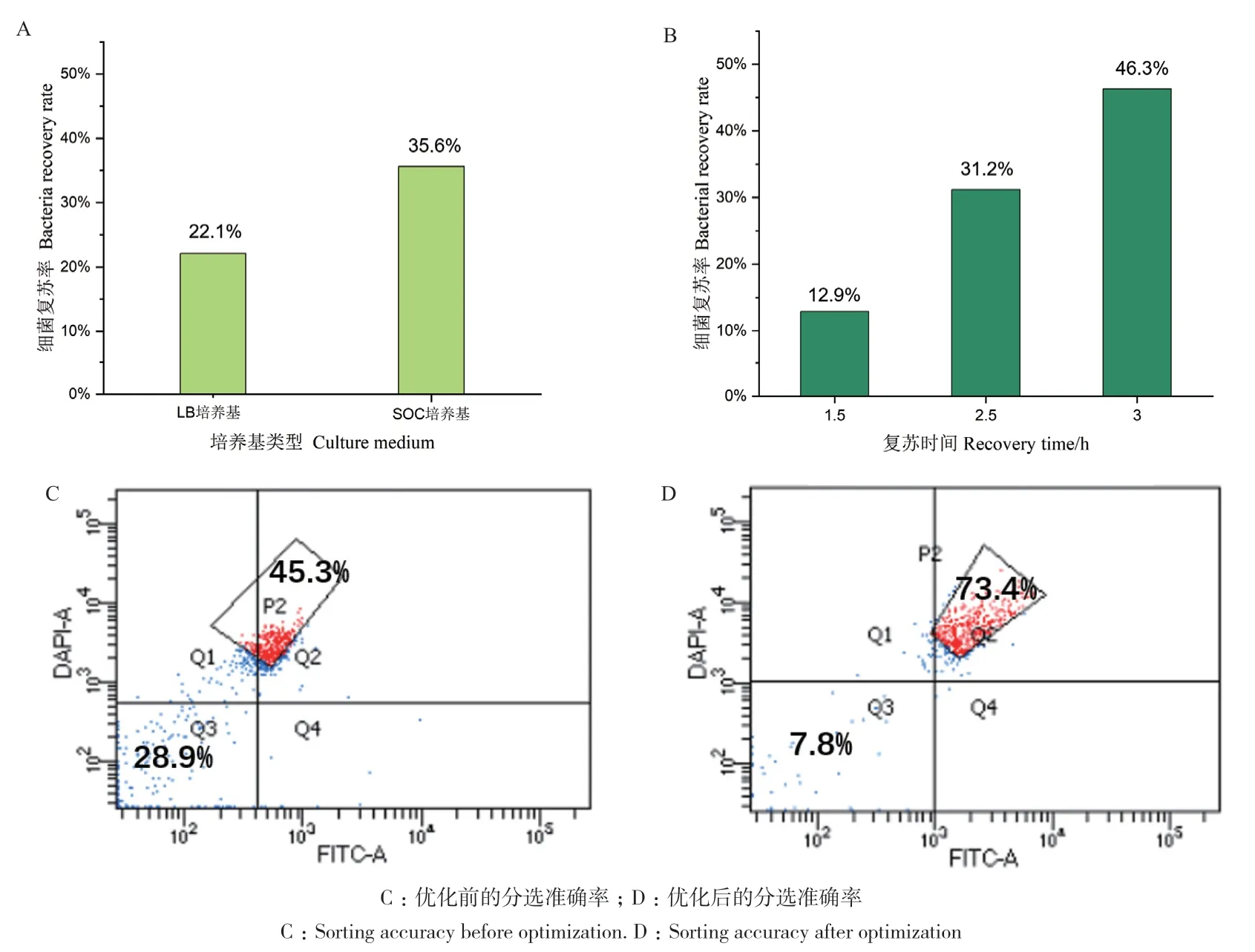
圖4 細菌復蘇率和分選準確率的優化Fig. 4 Optimization of bacterial recovery rate and sorting accuracy
模式分選是驗證FACS是否能有效地將具有FutC活性的細胞從無活性的細胞中分選出來的直接方法。通過對比分選前后帶有FutC細胞的比例變化,來評估篩選體系對陽性群體的富集效率,可以有效的驗證篩選方法的有效性。首先對無活力的陰性細菌樣品和具有FutC催化活力的陽性細菌樣品進行反應、沖洗與重懸。之后將陽性與陰性樣品分別按照1∶1、1∶10、1∶100、1∶1 000的比例混合,作為進行模式分選的樣品。通過FACS記錄的散點圖,在雙熒光強度最強的1%的細胞群體中分選出5 000個細菌進行復蘇培養并鑒定futC基因是否存在。結果表明,我們建立的篩選方法僅通過一輪篩選即可以將陽性細菌從大量陰性細菌中富集出來。在分選前陽性細胞的比例為50%,10%,1%和0.1%時,富集倍數分別為2、10、90及733倍,有力的證明了此篩選方法的有效性(表2)。
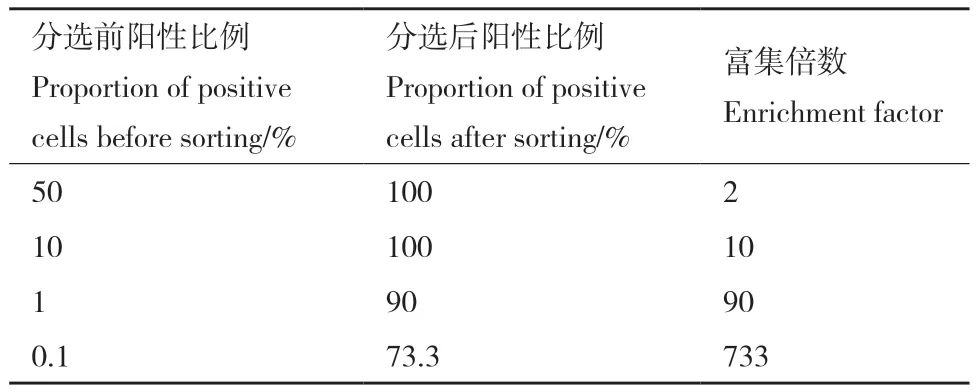
表2 FutC的模式分選Table 2 Model screening of FutC
2.3 FutC的定向進化
在初步建立并優化了FutC超高通量篩選方法之后,我們對FutC進行了定向進化實驗。首先,我們通過易錯PCR建立了FutC的隨機突變庫(圖5),平均突變為2.5個突變/基因,庫容量為5.4×105。對突變庫進行了3輪FACS篩選,均篩選雙陽性最強的1%-1.5%的群體,隨后在篩選得到的富集文庫中隨機挑取100個突變體進行復篩。
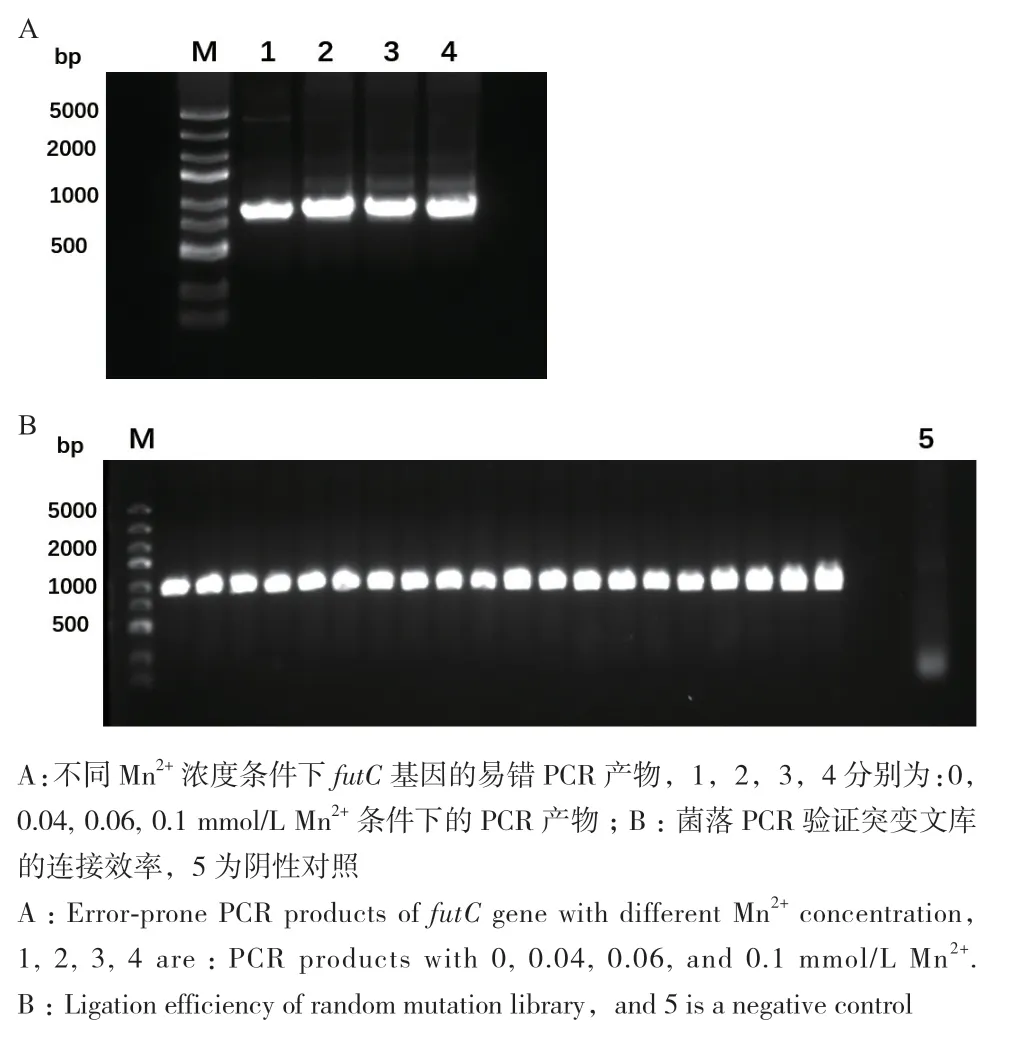
圖5 FutC隨機突變文庫構建Fig. 5 Construction of the FutC random mutation library
篩選前后的突變庫的FACS分析結果如圖6,篩選前文庫絕大部分為聚集在Q4區域的失活或低活力突變體,在經過兩輪篩選之后,經過富集的文庫在雙陽性區域Q2增加了6.5倍,說明篩選后的菌體對兩種熒光底物的活力均明顯提高。文庫篩選結果證明FutC的超高通量篩選方法可以從絕大部分為失活突變體的文庫中富集出具有較高催化活力的突變群體。富集后文庫的復篩最終得到了粗酶液相比于野生型活力有一定提升的3個突變體(圖7),測序得到對應突變分別為K282E、K102E、R105C。
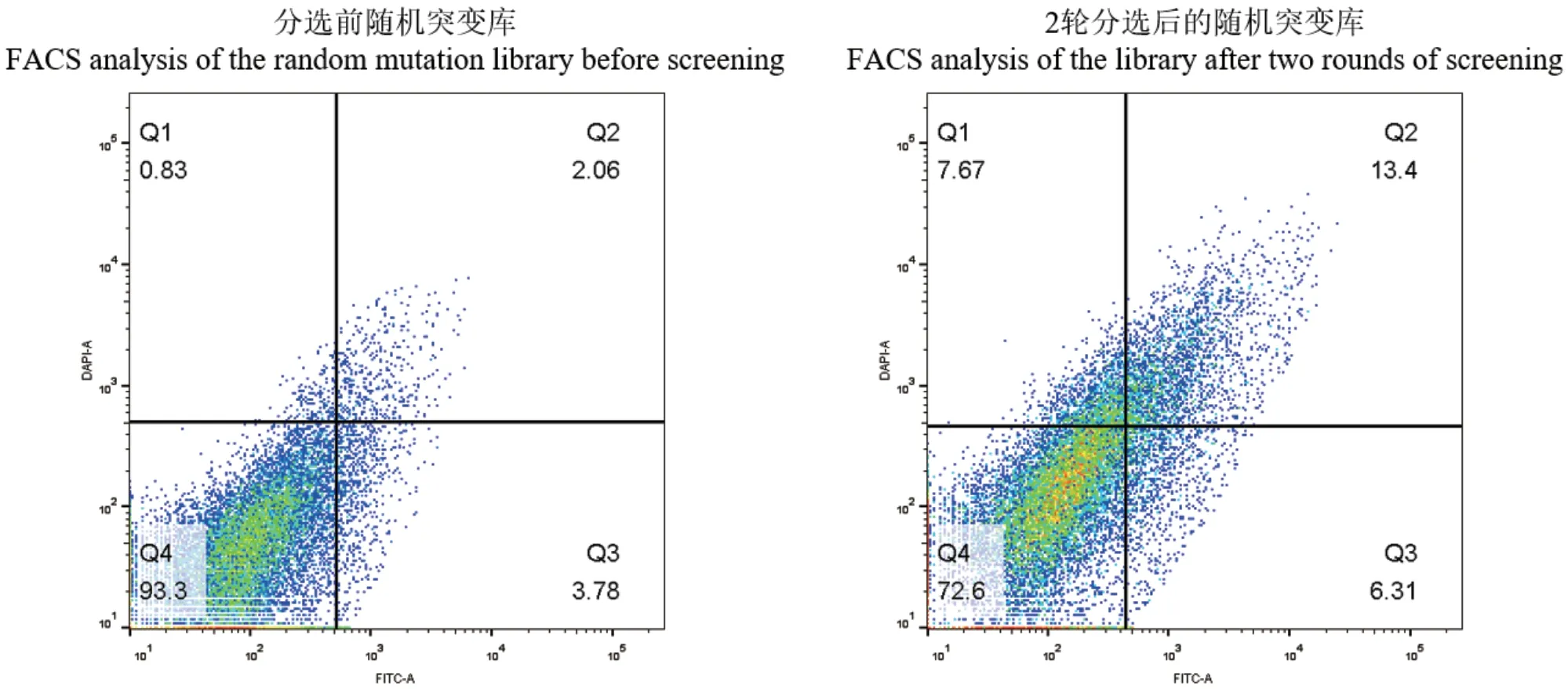
圖6 流式細胞儀分析分選前的隨機突變文庫和分選2輪后的隨機突變文庫Fig. 6 FACS analysis of the FutC random mutation libraries before screening and after two rounds of screening

圖7 TLC分析復篩得到的單克隆的粗酶液活力Fig. 7 TLC analysis of monoclonal crude enzyme activity after re-screening
2.4 FutC突變體的表達純化與活力測定
為了進一步驗證突變體的酶活,我們對野生型和篩選得到的突變體進行了蛋白表達純化和酶活測定。首先利用高效液相色譜建立了FutC的酶活測定方法。結果如圖8-A,B所示,熒光底物lactosebodipy和熒光產物2′-fucosyllactose-bodipy的保留時間分別為6.71 min和10.25 min。在0.025-0.2 mmol/L檢測范圍內,2′-fucosyllactose-bodipy的質量濃度和色譜峰面積呈現良好的線性關系,說明HPLC測活方法極為精確。隨后對野生型和篩選獲得的3個突變體進行蛋白表達純化,SDS-PAGE如圖8-C,蛋白純度在95%以上。比活力測定結果如表3,FutC(K102E)、FutC(R105C)、FutC(K282E) 對 于 熒光底物lactose-bodipy的比活力相比野生型分別提高了2.7倍,3倍和2.6倍。酶活測定結果表明我們通過超高通量篩選方法成功地從大容量的隨機突變庫中篩選獲得活力提高的FutC突變體,證明了該方法的有效性。
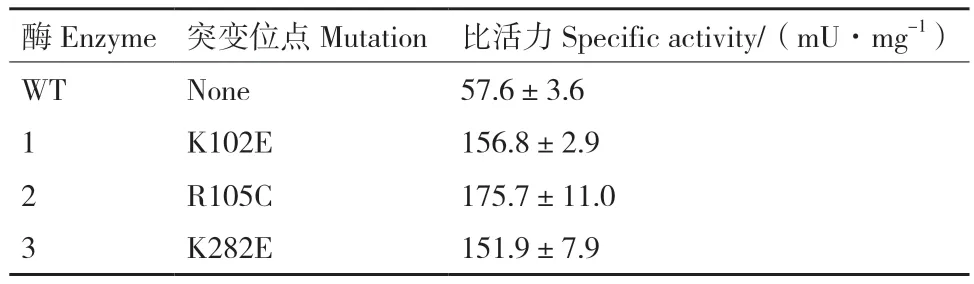
表3 FutC野生型和突變體對熒光乳糖lactose-bodipy的比活力Table 3 Specific activities of WT FutC and selected mutants using lactose-bodipy as acceptor
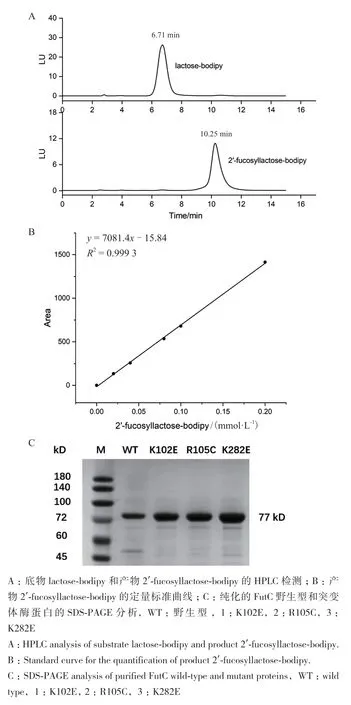
圖8 HPLC酶活測定方法的建立及FutC野生型和突變體的蛋白純化Fig. 8 Establishment of HPLC enzyme activity determination method and protein purification of FutC WT and mutant
3 討論
定向進化將隨機突變和高通量篩選技術結合,以此獲得具有理想特性的酶。超高通量篩選方法可以覆蓋隨機突變或組合飽和突變文庫,具備良好的檢測靈敏度和應用靈活性,為定向進化提供了高效的篩選工具。其中熒光激活細胞分選技術通過巧妙的設計將熒光信號與酶的催化反應相偶聯,已發展成為糖基轉移酶定向進化的有效手段。
作為巖藻糖基寡糖生物合成途徑中的關鍵酶,α-1,2-巖藻糖基轉移酶被廣泛應用于2′-巖藻糖基乳糖的生物合成。近年來,對于α-1,2-巖藻糖基轉移酶的研究已成為一個熱點方向。2008年Stein等[23]對幽門螺桿菌來源的α-1,2-巖藻糖基轉移酶FutC進行了詳細的酶學性質表征,鑒定了FutC的最適pH,溫度及底物譜。2014年Engels等[24]鑒定了一種來源于E.coli O126的新型α-1,2-巖藻糖基轉移酶WbgL。2020年Li等[25]通過改變反應系統中的不同酶量確定了α-1,2-巖藻糖基轉移酶是2′-巖藻糖基乳糖合成途徑中的限速酶,并對不同來源的α-1,2-巖藻糖基轉移酶的活力及熱穩定性進行了比較分析,通過同源建模推測出高度保守的基序HxRRxD負責GDP-L-巖藻糖的結合。目前對于α-1,2-巖藻糖基轉移酶的大部分研究依然停留在酶學性質的表征和結構的模擬預測階段,同時由于缺乏有效的篩選手段,尚未有研究報道其定向進化。
本研究針對α-1,2-巖藻糖基轉移酶定向進化過程中缺少高通量篩選方法的問題,建立并優化了基于α-1,2-巖藻糖基轉移酶FutC的超高通量篩選方法并證明了其應用價值,為后續定向進化提供了有利工具。FACS的胞內熒光捕獲策略利用了乳糖透過酶LacY的精確底物特異性,它可以識別底物但無法催化某類糖基化產物。在過去的研究中,導致LacY底物特異性差異修飾的關鍵糖基化位點已經在乳糖的半乳糖基的C-3羥基(β-1,3-半乳糖基轉移酶和α-2,3-唾液酸轉移酶)以及乳糖的葡萄糖基的C-3羥基(α-1,3-巖藻糖基轉移酶)上得到了驗證。本研究將該策略應用于α-1,2-巖藻糖基轉移酶用以建立其超高通量篩選方法,其糖基化修飾位點為乳糖的半乳糖基的C-2羥基,該策略的成功實施進一步拓展了FACS篩選方法在糖基轉移酶中的應用范圍。其次對該方法的優化解決了之前普遍存在細菌復蘇率和準確率過低的問題,極大提高了FACS篩選系統的效率。隨后定向進化成功獲得陽性突變體直接證明了該方法的有效性。但在篩選中,由于我們構建隨機突變文庫的DNA聚合酶存在堿基偏好性等問題,文庫質量相對較低。構建小而精的高質量突變文庫結合超高通量篩選方法,有望篩選獲得催化活力更高的突變體,為生物合成提供優質的酶源。此外,對于α-1,2-巖藻糖基轉移酶及其底物復合物晶體結構的解析極具研究價值,通過晶體結構的解析,我們將得到更多與酶催化機制有關的信息,確切的結構信息將為分子改造提供更進一步的支持。
4 結論
本研究建立了針對α-1,2-巖藻糖基轉移酶FutC的超高通量篩選方法,并成功篩選出催化活性提高的FutC突變體。該方法的建立為α-1,2-巖藻糖基轉移酶的定向進化提供了強大的進化工具,為后續篩選獲得更高活力的突變體打下了良好基礎。

