外泌體在卵巢癌中的研究進展
陳笑笑, 賀其志
(1. 同濟大學(xué)附屬第一婦嬰保健院婦科,上海 201204; 2. 同濟大學(xué)附屬第一婦嬰保健院病理科,上海 201204)
卵巢癌的死亡率居婦科惡性腫瘤之首[1],其早期癥狀隱匿,缺乏有效的篩查和檢測手段,約75%的患者確診時已屬晚期。此外,由于卵巢癌易轉(zhuǎn)移且化療后易耐藥,晚期卵巢癌患者的5年生存率只有20%~30%[2],對女性的生命健康造成嚴重的威脅。因此尋找靈敏度和特異度較高的卵巢癌早期診斷標志物,深入探討卵巢癌增殖、侵襲和轉(zhuǎn)移的機制,尋求有效抑制卵巢癌轉(zhuǎn)移的方法,對于降低卵巢癌的死亡率、提高5年生存率等均具有重要意義。外泌體是直徑為30~200 nm的細胞外囊泡,天然存在于各種體液中,包括血液、唾液、尿液、腦脊液和乳汁等。腫瘤細胞分泌的外泌體攜帶原發(fā)腫瘤特異性的蛋白質(zhì)和核酸,通過多種途徑促進腫瘤的增殖、轉(zhuǎn)移和侵襲[3],因而受到了廣泛關(guān)注。在卵巢癌中,腫瘤來源的外泌體在卵巢癌的發(fā)生、發(fā)展及其生物學(xué)行為中都有著重要的作用。
1 外泌體簡介
外泌體的形成始于細胞內(nèi)陷形成早期內(nèi)體,早期內(nèi)體進一步內(nèi)陷形成多囊體(multivesicular bodies, MVBs)。最后,MVB與細胞膜融合向外界分泌的腔內(nèi)囊泡(intrauminal vesicles, ILVs)稱為外泌體[4]。研究發(fā)現(xiàn),MVBs主要是由運輸所需的內(nèi)體分選復(fù)合體(endosomal sorting complex, ESCRT)介導(dǎo)形成的。ESCRT主要包含ESCRT 0、Ⅰ、Ⅱ、Ⅲ,其主要功能是提供泛素化的蛋白質(zhì)以誘導(dǎo)溶酶體降解。除此之外,其他蛋白也有助于外泌體的生物發(fā)生,包括凋亡誘導(dǎo)因子6相互作用蛋白(apoptosis-linked gene-2 interacting protein X, Alix),液泡分選蛋白4(vacuolar protein sorting 4, Vps4),腫瘤易感基因101蛋白(tumor susceptibility gene 101, TSG101)和染色質(zhì)修飾蛋白4(chromatin modifying protein 4, CHMP4)等[5]。目前,外泌體常見的生物標志物是四次穿膜蛋白(CD82、CD81、CD63和CD9)、熱休克蛋白(HSP70、HSP90)以及參與膜轉(zhuǎn)運與融合的相關(guān)蛋白(膜聯(lián)蛋白和Rab)[5]。外泌體的內(nèi)部包含隨機吞噬的細胞質(zhì)成分,富含mRNA、microRNA(miRNA/miRs),蛋白質(zhì)和脂質(zhì)。越來越多的研究表明,外泌體通過遞送多種生物分子介導(dǎo)信號轉(zhuǎn)導(dǎo),在腫瘤的生長、轉(zhuǎn)移、血管生成及免疫調(diào)節(jié)和代謝方面發(fā)揮了重要的作用。Wang等[6]證明了在肺癌細胞中高表達的miRNA-141可通過外泌體途徑進入腫瘤基質(zhì)血管內(nèi)皮細胞,然后通過調(diào)節(jié)生長終止特異性同源盒基因(growth arrest-specific homeobox gene,GAX)的表達促進血管生成,從而促進腫瘤的侵襲。Chang等[7]發(fā)現(xiàn)通過調(diào)節(jié)miR-1228在外泌體中的表達,有望使其在胃癌的治療中發(fā)揮重要作用。Sun等[8]發(fā)現(xiàn)lncRNA-MALAT1通過抑制miR-503-5p的表達,介導(dǎo)Janus激酶2(janus kinase 2, JAK2)/信號轉(zhuǎn)導(dǎo)及轉(zhuǎn)錄激活因子3(signal transducer and activator of transcription 3, STAT3)信號通路的激活,促進卵巢癌細胞的增殖并抑制其凋亡。總之,外泌體在腫瘤的發(fā)生及進展中發(fā)揮著重要的作用,在腫瘤診斷和治療方面具有獨特的優(yōu)勢和潛在的價值。
2 外泌體在卵巢癌轉(zhuǎn)移中的作用
外泌體在卵巢癌的發(fā)生、發(fā)展中扮演了重要的角色。卵巢癌細胞在生長過程中不斷將外泌體釋放到周圍環(huán)境,通過轉(zhuǎn)運特異性的核酸、蛋白質(zhì)等,提高卵巢癌細胞的侵襲力,促進卵巢癌的轉(zhuǎn)移。眾多研究證實,外泌體與卵巢癌的關(guān)系密切,具體見表1。

表1 外泌體在卵巢癌轉(zhuǎn)移中的機制
2.1 外泌體促進卵巢癌細胞上皮-間質(zhì)轉(zhuǎn)化(epithelial-mesenchymal transition, EMT)
腫瘤的發(fā)生、發(fā)展是一個極其復(fù)雜的過程,有多個調(diào)控和轉(zhuǎn)變在其中發(fā)揮作用。EMT是細胞的可塑性過程,伴隨著上皮表型的逐漸喪失和間充質(zhì)表型的獲得,其在腫瘤發(fā)生發(fā)展過程中,為癌細胞提供了生長和轉(zhuǎn)移潛能[9]。
E-鈣黏蛋白表達的缺失是EMT的關(guān)鍵。研究表明,經(jīng)過卵巢癌相關(guān)成纖維細胞(cancer-associated fibroblasts, CAFs)衍生的外泌體處理過SKOV-3和CAOV-3細胞后,其間質(zhì)標志物的表達升高,E-鈣黏蛋白的表達水平降低,促進EMT[10]。并且,CAF衍生的外泌體富含TGFβ1,可通過激活SMAD信號轉(zhuǎn)導(dǎo)進而調(diào)控癌細胞EMT[10]。Zong等[11]通過蛋白印跡法發(fā)現(xiàn)外泌體中的circ-WHSC1在卵巢癌組織中上調(diào),誘導(dǎo)癌細胞發(fā)生EMT,從而加速了卵巢癌的腹膜擴散。除此之外,將從卵巢癌分泌的包含CD44的外泌體轉(zhuǎn)移到人腹膜間皮細胞(human peritoneal mesothelial cells, HPMC),可以使HPMC重新編程為具有EMT的表型,從而促進卵巢癌的侵襲和轉(zhuǎn)移[12]。與良性腫瘤患者和健康者相比,卵巢癌患者的血清中miR-99a-5p水平顯著升高,并且纖連蛋白和波形蛋白的表達水平也顯著增加,進一步促進了上皮性卵巢癌(epithelial ovarian cancer, EOC)細胞發(fā)生EMT[13]。Cai等[14]還發(fā)現(xiàn)卵巢癌腹水中的外泌體通過傳遞miR-6780b-5p來增強卵巢癌細胞的EMT。卵巢癌的侵襲力不同,其分泌的外泌體對EMT的作用也有差異。與來自低侵襲能力細胞的外泌體相比,從高侵襲性卵巢癌細胞系中分離的外泌體在體內(nèi)更能促進卵巢癌發(fā)生EMT和轉(zhuǎn)移[15]。總之,EMT在卵巢癌的增殖和轉(zhuǎn)移中發(fā)揮著至關(guān)重要的作用,而外泌體是調(diào)節(jié)EMT的上游信號物,進一步研究外泌體對EMT的調(diào)控作用將有助于揭示其在卵巢癌轉(zhuǎn)移中的作用機制。
2.2 外泌體促進卵巢癌的血管生成
血管生成是腫瘤生長和轉(zhuǎn)移的重要營養(yǎng)來源。外泌體通過改變血管內(nèi)皮細胞的生物學(xué)特性和調(diào)節(jié)促血管生長因子來誘導(dǎo)血管生成,有利于腫瘤細胞的擴散和轉(zhuǎn)移[16]。
卵巢癌細胞分泌的外泌體含有轉(zhuǎn)錄因子2(activating transcription factor 2, ATF2)、轉(zhuǎn)移相關(guān)蛋白1(metastasis associated protein 1, MTA1)和CD147等,可誘導(dǎo)血管生成并增加血管通透性[16],促進腫瘤的增生和轉(zhuǎn)移。其次,外泌體表面的可溶性上皮性鈣黏蛋白(sE-cadherin, sE-cad)也可以調(diào)控腫瘤血管生成。Tang等[16]證明了卵巢癌患者的腹水中高表達的sE-cad以外泌體的形式大量釋放,誘導(dǎo)血管生成。隨著腫瘤的生長,血液供氧不足,腫瘤組織內(nèi)產(chǎn)生的乏氧環(huán)境促進其釋放外泌體,從而可刺激周圍血管形成。在乏氧條件下,卵巢癌細胞來源的外泌體中miR-130a的表達上調(diào),促進血管內(nèi)皮細胞增殖及血管形成[17]。隨著對以上研究的深入開展,將會有助于人們解析卵巢癌的血管生成分子機制,選擇新的靶點開展卵巢癌治療,以減少腫瘤的擴散。
3 外泌體影響卵巢癌的免疫微環(huán)境
外泌體在卵巢癌的腫瘤微環(huán)境中發(fā)揮了重要的作用,源自免疫細胞的外泌體可以靶向卵巢癌細胞發(fā)揮抗腫瘤作用,而卵巢癌細胞來源的外泌體通過多種途徑發(fā)揮免疫抑制和免疫逃逸的作用。卵巢癌細胞和免疫細胞之間通過外泌體相互作用,發(fā)揮抗腫瘤或促進腫瘤的作用,具體見表1。
卵巢癌衍生的外泌體抑制T細胞的活化。從腹水中發(fā)現(xiàn)大部分卵巢腫瘤細胞分泌的外泌體表面含有神經(jīng)節(jié)苷脂GD3,其對唾液酸依賴性T細胞有抑制作用[18],這種抑制作用在除去外泌體后,24~48 h內(nèi)會逆轉(zhuǎn),逆轉(zhuǎn)外泌體介導(dǎo)的T細胞下調(diào)的能力可能完全取決于細胞暴露于外泌體的持續(xù)時間[19]。在免疫抑制的各種機制中,攜帶精氨酸酶1(arginase-1, ARG1)的外泌體也是導(dǎo)致卵巢癌生長的重要因素。據(jù)報道,卵巢癌患者的腹水和血漿中含有攜帶ARG1的外泌體,其被運送至引流淋巴結(jié),被樹突狀細胞吸收并抑制抗原特異性T細胞增殖[20]。此外,卵巢癌患者腹水中的磷脂酰絲氨酸(phosphatidylserine,PS)陽性的外泌體可以阻斷T細胞中的NF-kB和NFAT信號通路,可逆地抑制T細胞活化[21]。
腫瘤相關(guān)巨噬細胞(tumor-associated macro-phages, TAMs)是腫瘤微環(huán)境中最常見的免疫細胞之一,癌細胞與TAMs之間的通信影響卵巢癌的生長與轉(zhuǎn)移[22]。盡管在癌癥中炎性細胞產(chǎn)生大量的M1炎性介質(zhì),但TAMs的表型特征始終顯示其缺乏M1功能,主要表達M2功能。M2巨噬細胞可以釋放免疫抑制因子支持卵巢癌的免疫逃逸。在卵巢癌中,受到IL-4、IL-10、IL-13和IL-33刺激的巨噬細胞分化為M2型并分泌TGF-β、精氨酸酶-1和IL-6來增強血管形成、基質(zhì)重塑和免疫抑制。TAMs衍生的外泌體中存在大量的miR-29a-3p和miR-21-5p,這兩種物質(zhì)通過外泌體轉(zhuǎn)移到CD4+T細胞,抑制STAT3調(diào)節(jié)Treg和Th17的比例,幫助卵巢癌逃避主動免疫反應(yīng)[23]。TAMs還通過STAT3信號級聯(lián)反應(yīng)分泌TGF-β,SDF-1和血管內(nèi)皮生長因子(vascular endothelial growth factor, VEGF)促進卵巢癌的轉(zhuǎn)移[24]。此外,M2型巨噬細胞通過外泌體轉(zhuǎn)移miR-221-3p靶向抑制細胞周期蛋白依賴性激酶抑制劑1B(cyclin-dependent kinase inhibitor 1B, CDKN1B),促進卵巢癌細胞的增殖[25]。在缺氧條件下,上皮性卵巢癌細胞分泌的外泌體含有豐富的miR-940,誘導(dǎo)巨噬細胞分化為M2表型[26]。源自卵巢癌干樣細胞的COX-2可以激活JAK和COX-2/PGE2途徑,以促進巨噬細胞的M2型極化[27]。總之,卵巢癌細胞可通過外泌體促進巨噬細胞分化成M2型,并且M2型巨噬細胞可以進一步分泌外泌體促進卵巢癌的生長和轉(zhuǎn)移,見圖1。
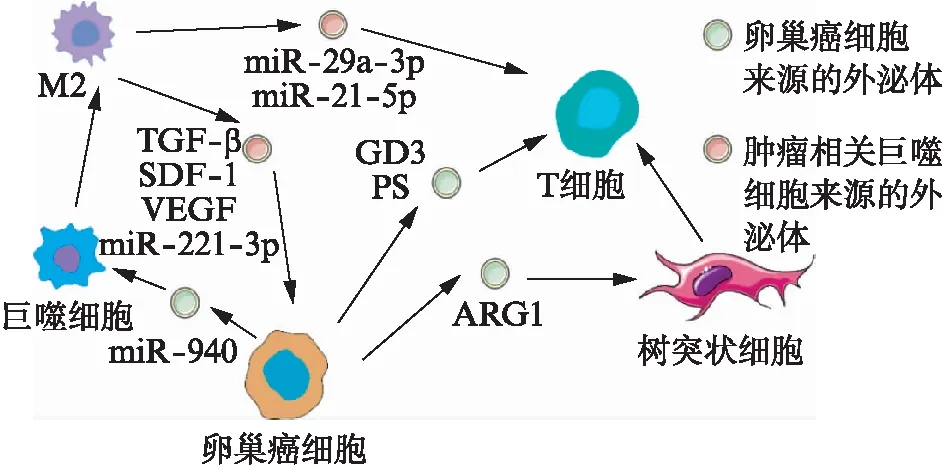
圖1 外泌體在卵巢癌免疫微環(huán)境中的作用Fig.1 Role of exosomes in the immune microen-vironment of ovarian cancer
4 外泌體在卵巢癌診斷方面的作用
由于卵巢癌的早期診斷率低、晚期死亡率高,已經(jīng)開展了大量的研究以篩查疾病潛在的生物標志物。CA125是最早鑒定出的卵巢癌生物標志物。研究發(fā)現(xiàn),卵巢癌治療成功時,循環(huán)系統(tǒng)中的CA125水平會降低,而水平升高則與耐藥和復(fù)發(fā)有關(guān)[28]。此外,CA125的表達也與其他疾病(例如肺癌和子宮內(nèi)膜癌)有關(guān),并受到其他因素(例如卵巢癌的進展和類型)的影響,缺乏診斷卵巢癌的特異性[28]。因此,以CA125為分子標志物得出的結(jié)果具有很高的假陽性和假陰性率,CA125不能作為診斷卵巢癌可靠的生物標志物[29]。除此之外,研究的另一種生物標志物人附睪蛋白4也像CA125一樣,不是可靠的生物標志物。這些生物標志物都具有較高的假陰性和假陽性率,必須進一步研究其他生物分子用于卵巢癌的早期檢測。
實際上,幾乎所有類型的細胞都釋放外泌體,可反映卵巢癌的病理變化,包括其生長、血管生成和轉(zhuǎn)移。由于缺乏早期檢測卵巢癌的方法,來源于卵巢癌細胞的外泌體被認為是有價值的生物標志物,主要存在于血液和腹水中,在早期診斷和預(yù)后具有巨大潛力。在一項研究中,觀察到miR-200a、miR-200b、miR-200c和miR-1290的水平在卵巢癌患者的腹水中升高,并且miR-200b水平與總生存率有關(guān)[30]。在另一項研究中,發(fā)現(xiàn)外泌體中miR-16,miR-21,miR-92a,miR-200b和miR-200c的表達水平與EOC患者的臨床病理和風(fēng)險參數(shù)之間存在著顯著相關(guān)性,并且外泌體中miR-200b的定量具有診斷和預(yù)后的意義[31]。這些研究結(jié)果都表明了卵巢癌患者與健康者或是良性卵巢腫瘤患者相比,其外泌體中的miRNA表達水平發(fā)生了巨大的變化。因此,卵巢癌外泌體中的miRNA有望成為新的生物標志物。
外泌體中的蛋白質(zhì)也已作為卵巢癌潛在的生物標志物得到大量研究。卵巢癌的外泌體中發(fā)現(xiàn)了CA125,其含量高于血液中游離的CA125[32],顯著地提高了卵巢癌診斷的靈敏度。研究表明,從卵巢癌患者血漿中提取出的外泌體含有連接蛋白4,其表達與腫瘤分期呈正相關(guān)且靈敏度和特異度均較高[33]。此外,卵巢癌患者與非卵巢癌患者的外泌體相比,表達較高水平的TGFβ1[10]、EpCAM[34]、ADAM-10[35]等。總之,這些外泌體中的蛋白質(zhì)具有成為卵巢癌生物標志物的潛力。
當(dāng)然,除了外泌體中的miRNA和蛋白質(zhì)可以作為卵巢癌潛在的分子標志物外,其他的外泌體相關(guān)分子也具有一定潛力。Lea等[36]發(fā)現(xiàn),通過ELISA檢測方法可以檢測到卵巢癌患者的血液中含有PS的外泌體,根據(jù)外泌體中PS的含量可以鑒別卵巢癌和卵巢良性腫瘤。盡管外泌體作為卵巢癌的生物標志物具有很大潛力,但要實現(xiàn)其臨床應(yīng)用仍然需要大量的研究。
5 外泌體在卵巢癌治療中的作用
藥物化療是治療卵巢癌并阻斷其惡性進展的重要方法,然而卵巢癌在化療后期極易產(chǎn)生耐藥,對治療效果產(chǎn)生巨大的影響。外泌體在卵巢癌化療耐藥的組織或細胞中表達下調(diào)或上升可發(fā)揮抑制卵巢癌化療耐藥性的作用,從而增強卵巢癌對化療的敏感性,起到對卵巢癌的治療作用。Zhao等[37]研究發(fā)現(xiàn),circRNA CDR1as在順鉑耐藥卵巢癌患者的血清外泌體中下調(diào),通過調(diào)控miR-1270/SCAI信號通路抑制耐藥卵巢癌細胞的增殖,促進順鉑誘導(dǎo)的耐藥卵巢癌細胞凋亡,增強了卵巢癌細胞的順鉑化學(xué)敏感性。研究發(fā)現(xiàn),順鉑耐藥的上皮性卵巢癌患者的血漿外泌體circFoxp1上調(diào),其作為致癌基因使上皮性卵巢癌對順鉑產(chǎn)生耐藥性,可作為上皮性卵巢癌潛在的治療靶點[38-39]。此外,源自抗原提呈細胞(antigen presenting cell, APC)的外泌體[如B細胞和樹突狀細胞(dendritic cells, DC)]在通過免疫調(diào)節(jié)的抗腫瘤反應(yīng)中也發(fā)揮重要的作用[40]。研究表明,來自DC的外泌體可以激活T細胞和NK細胞,并且DC細胞來源的外泌體可以影響晚期卵巢癌[40]。Besse等[41]使用DC細胞衍生的外泌體進行了針對晚期非小細胞肺癌的Ⅰ期臨床研究。22例卵巢癌患者接受了DC細胞衍生的富含IFN-γ的外泌體治療,其中7例病情穩(wěn)定超過4個月,且這些患者的NK細胞功能增強。抑制血管生成也是卵巢癌既定的治療靶標,一些臨床試驗已經(jīng)證實了VEGF靶向藥物在卵巢癌治療中的積極作用[42-43]。CD44在癌癥侵襲中也具有重要作用,其有望成為卵巢癌的治療靶標。但是,用CD44中和抗體進行全身治療的毒性水平太高[44],需要開發(fā)出無毒替代療法,這表明免疫療法是外泌體應(yīng)用于卵巢癌治療的選擇之一。Xu等[45]在一項臨床研究中發(fā)現(xiàn)miR-101可通過抑制神經(jīng)源性營養(yǎng)因子抑制卵巢癌細胞的侵襲和遷移。而卵巢癌外泌體中miR-101的表達降低可增強卵巢癌細胞的遷移。因此,miR-101也可能是卵巢癌的潛在治療藥物。盡管外泌體在卵巢癌治療上具有很大前景,但外泌體的大規(guī)模生產(chǎn)、尋找細胞來源及其對靶細胞的特異性方面仍然面臨許多挑戰(zhàn)。
6 展 望
外泌體在卵巢癌的進展中起著至關(guān)重要的作用。卵巢癌細胞釋放外泌體作用于體內(nèi)免疫細胞、間質(zhì)細胞、實質(zhì)細胞等,而這些細胞又分泌外泌體反過來作用于卵巢癌細胞,它們以外泌體作為細胞間通信介質(zhì)相互影響,形成特殊的微環(huán)境。因此,闡明卵巢癌與外泌體之間的關(guān)系對于理解腫瘤形成的機制非常關(guān)鍵。此外,卵巢癌中的外泌體包含多種生物信息分子,以一種物質(zhì)作為生物標志物,其靈敏度和特異度大都不盡如人意,或許將多個分子作為生物標志物會取得更好的效果。最后,利用外泌體治療卵巢癌也具有巨大潛力。外泌體具有穩(wěn)定性和特異性,可以作為藥物傳遞的載體,用于分子生物療法和抗腫瘤免疫療法。但是,將外泌體用于卵巢癌的治療還存在著許多挑戰(zhàn),例如目標外泌體的選擇、目標外泌體的分離和純化、工程化外泌體的作用效果等。外泌體在腫瘤生物學(xué)中的重要性以及各種研究結(jié)果都表明外泌體在腫瘤診療中的重要作用,應(yīng)對其開展進一步探索,為其臨床應(yīng)用奠定理論基礎(chǔ)。

