煙草TPP基因家族鑒定及表達模式分析
劉 濤,郭 存,鄒宗慶,金立權,吳 健,文利超,鄧智超,初雨蒙,王凌濤,李 偉,郭永峰
煙草TPP基因家族鑒定及表達模式分析
劉 濤1,2,郭 存3,鄒宗慶4,金立權5,吳 健5,文利超1,2,鄧智超1,2,初雨蒙1,2,王凌濤6,李 偉1*,郭永峰1*
(1.中國農業科學院煙草研究所,煙草行業基因資源利用重點實驗室,青島 266101;2.中國農業科學院研究生院,北京 100081;3.云南省煙草公司昆明市公司石林分公司,昆明 650000;4.福建省煙草公司龍巖市公司,福建 龍巖 361000;5.山東臨沂煙草有限公司蘭陵分公司,山東 臨沂 277700;6.湖北省煙草公司十堰市公司竹溪縣營銷部,湖北 十堰 442300)
海藻糖-6-磷酸磷酸酶(TPP)是植物海藻糖代謝過程的關鍵酶,在植物的生長發育及非生物脅迫響應過程中發揮著重要的作用。為挖掘參與煙草發育及抗逆脅迫的TPP基因家族成員,本研究通過生物信息學的方法,在普通煙草基因組中共鑒定出了15個基因,其中7個基因定位在染色體上。系統進化分析發現,新鑒定的煙草TPP成員可分為3個亞家族,分別為CLASS I、CLASS II和CLASS III。共線性分析表明,有5個煙草基因分別與7個擬南芥基因形成同源基因對。啟動子分析發現,NtTPP成員的啟動子上存在多種激素和非生物脅迫響應元件。表達模式分析發現,基因表達具有一定的組織特異性,大部分基因在根中的表達量最高,有12個基因在干旱脅迫下表達量上調,13個基因能夠被鹽脅迫顯著誘導表達。這說明NtTPP基因家族成員在煙草非生物脅迫應答中發揮著重要作用。
煙草;海藻糖-6-磷酸磷酸酶(TPP);干旱脅迫;鹽脅迫;表達模式
海藻糖是一種非還原性雙糖,由兩分子α-葡萄糖組成,廣泛分布于植物、動物以及微生物中[1]。研究發現海藻糖在植物應對各種生物以及非生物脅迫中發揮重要作用[2]。在極溫、高滲透壓及干燥失水等脅迫條件下,海藻糖能在細胞表面形成特殊的保護膜,降低逆境對生物分子結構的損害,維持生命體的生命過程和生物特征[3-4]。
海藻糖在植物中的合成主要包括以下兩個步驟:第1步,通過海藻糖-6-磷酸合成酶(TPS),尿苷二磷酸-葡萄糖(UDPG)和葡萄糖-6-磷酸葡萄糖(G6P)合成一種磷酸化中間體海藻糖-6-磷酸(T6P);第2步,海藻糖-6-磷酸(T6P)在海藻糖-6-磷酸磷酸酶(TPP)催化下去磷酸化合成海藻糖[5-6]。TPP是海藻糖合成途徑的限制性酶,在高等植物中廣泛分布,隨著植物全基因組測序的進行,TPP基因家族已在多種物種中被鑒定[7-9],主要特征是它們都含有一個Trehalose_PPase保守結構域。基因已被證實參與擬南芥[10-11]、水稻[12-14]、玉米[15-16]等多種植物的非生物脅迫響應。在煙草中,外源施加海藻糖不僅能夠提高煙苗的抗旱能力,還能鈍化煙草花葉病毒進而減輕病毒對煙葉的傷害[17-18]。WANG等[19]從普通煙草中克隆出了基因,發現熱脅迫可顯著提高基因的轉錄水平,同時NaCl、PEG和低溫脅迫也可輕微誘導其表達。
煙草是我國重要的經濟作物,在煙草的生長發育過程中,干旱、低溫、機械損傷、病蟲害等非生物和生物脅迫,均會導致煙葉減產降質,造成經濟損失。而海藻糖在植物抗逆過程中發揮重要作用,TPP作為合成海藻糖的關鍵酶,在煙草中的基因功能鮮有研究。因此,本研究利用比較基因組學和生物信息學手段,對煙草基因組中的TPP基因家族進行全面鑒定和分析,包括:系統進化分析,基因結構及TPP蛋白保守結構域分析,共線性分析,啟動子順式作用元件分析,組織特異性和非生物脅迫表達模式分析,為進一步明確基因功能和煙草抗逆品種培育奠定基礎。
1 材料與方法
1.1 試驗材料、試劑、儀器
材料:普通煙草品種K326,保存于中國農業科學院煙草研究所。將煙草種子先用75%酒精和過氧化氫消毒后,在超凈工作臺上播種到MS培養基上,轉至人工氣候室培養,溫度23 ℃,每天光照16 h,黑暗8 h。待其長出4片真葉后,移到MS液體培養基上培養(對照),以300 mmol/L甘露醇MS液體培養基模擬干旱處理,以100 mmol/L NaCl MS液體培養基作為鹽脅迫處理,培養0、1、3和6 h后分別取8株。
試劑:康為世紀RNA提取試劑盒(FFPE DNA/RNA Kit)、康為世紀反轉錄試劑盒(HiFi-MMLV cDNA Kit)。
儀器:ABI公司Veriti96 PCR儀和7500型熒光定量PCR儀。
1.2 試驗方法
1.2.1 煙草TPP家族鑒定及基本特征分析 從TAIR(https://www.arabidopsis.org)數據庫中下載擬南芥TPP家族成員的蛋白序列作為種子序列在煙草基因組數據庫(ftp://ftp.solgenomics.net/ genomes/Nicotiana_tabacum/)中進行同源比對搜索(BLASTP,E值<100)。獲得的序列在Pfam(http://pfam.xfam.org/)數據庫中對其保守結構域分析[20],因為TPP家族成員都包含Trehalose_PPase結構域(PF02358),因此去除不含Trehalose_PPase結構域的序列。利用在線網站Expasy(http://www. expasy.org/tools/protparam.html)中的ProtParam計算蛋白長度、分子量和等電點[21]。
1.2.2 系統進化分析 在NCBI數據庫(https://www. ncbi. nlm.nih.gov/)中下載水稻和小麥的TPP基因家族蛋白質序列。使用MEGA X軟件對擬南芥、小麥、水稻和煙草的TPP基因家族蛋白質序列進行多序列比對(MUSCLE法)和構建系統進化樹(鄰接法,bootstrap設置為1000)[22]。
1.2.3 煙草TPP家族基因結構及蛋白質保守結構域分析 在茄科數據庫(http://solgenomics.net/)中下載普通煙草K326的CDS和gDNA序列,從中提取TPP基因家族的信息,通過在線網站GSDS(http://gsds.cbi.pku.edu.cn/)分析其基因結構[23]。使用在線工具MEME(http://meme.sdsc.edu/meme)分析NtTPP基因家族成員的保守結構域[24]。
1.2.4 啟動子和共線性分析 在NCBI中提取煙草TPP基因家族上游2000 bp的啟動子序列,利用在線工具PlantCARE(http://bioinformatics.psb. ugent.be/webtools/plantcare/html/)檢測順式作用元件,篩選后用TBtools軟件進行可視化。將擬南芥和K326全基因組進行比對,對其共線性進行分析,建立同源基因對[25]。
1.2.5 基因表達模式分析 從NCBI的GEO數據庫(https://www.ncbi.nlm.nih.gov/gds)中下載EDWARDS等[26]2017年發布的普通煙草K326轉錄組數據(GSE95717),提取不同組織和低溫、干旱脅迫下的轉錄組數據,進行分析。
1.2.6 RNA提取和Real-time PCR分析 取對照、干旱和鹽處理0、1、3和6 h共4個時間段的煙草幼苗各8株,提取RNA,再反轉錄獲得cDNA。根據基因的CDS序列,使用qPrimerDB-qPCR Primer Database(https://biodb.swu.edu.cn/qprimerdb/)在線數據庫設計qRT-PCR引物(表1)。將提取的cDNA稀釋20倍作為qRT-PCR的模板。以作為內參基因,每個樣品3次重復,最終試驗結果采用2-ΔΔCt方法進行分析。
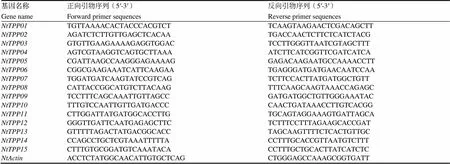
表1 qRT-PCR引物信息
2 結 果
2.1 NtTPP基因家族鑒定和理化性質分析
以擬南芥的TPP家族成員的蛋白質序列為種子序列,在煙草基因組數據庫中進行BLASTP檢索,獲得候選煙草TPP基因家族成員。利用Pfam數據庫對候選成員保守結構域分析后,篩選得到15個煙草TPP基因家族成員,其中有7個基因定位在染色體上。通過Prot Param工具分析煙草TPP基因家族成員的理化性質,結果表明其蛋白質長度在223~435個氨基酸之間,分子量在25?705.3~ 48?902.13 Da之間,等電點在6.31~9.68之間(表2)。
2.2 NtTPP基因家族系統進化分析
為進一步了解煙草TPP家族成員的進化關系,對單子葉植物(水稻、小麥)和雙子葉植物(擬南芥、煙草)的共62條蛋白質序列進行比對,并構建進化樹(圖1)。按照之前的文獻報道[7],我們將系統進化樹分為4個分支即CLASS Ⅰ、CLASS Ⅱ、CLASS Ⅲ和CLASS Ⅳ。其中CLASS Ⅱ只包含3個NtTPP基因家族成員,表明這3個基因與其他幾個物種的親緣關系較遠。NtTPP在亞家族CLASS Ⅰ和CLASS Ⅲ的成員數目均為6個,但在亞家族CLASS Ⅳ中并沒有NtTPP家族成員。
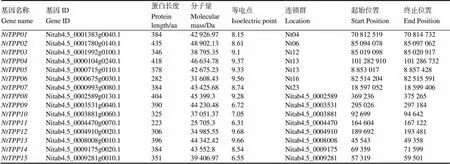
表2 普通煙草TPP基因家族鑒定及理化性質分析
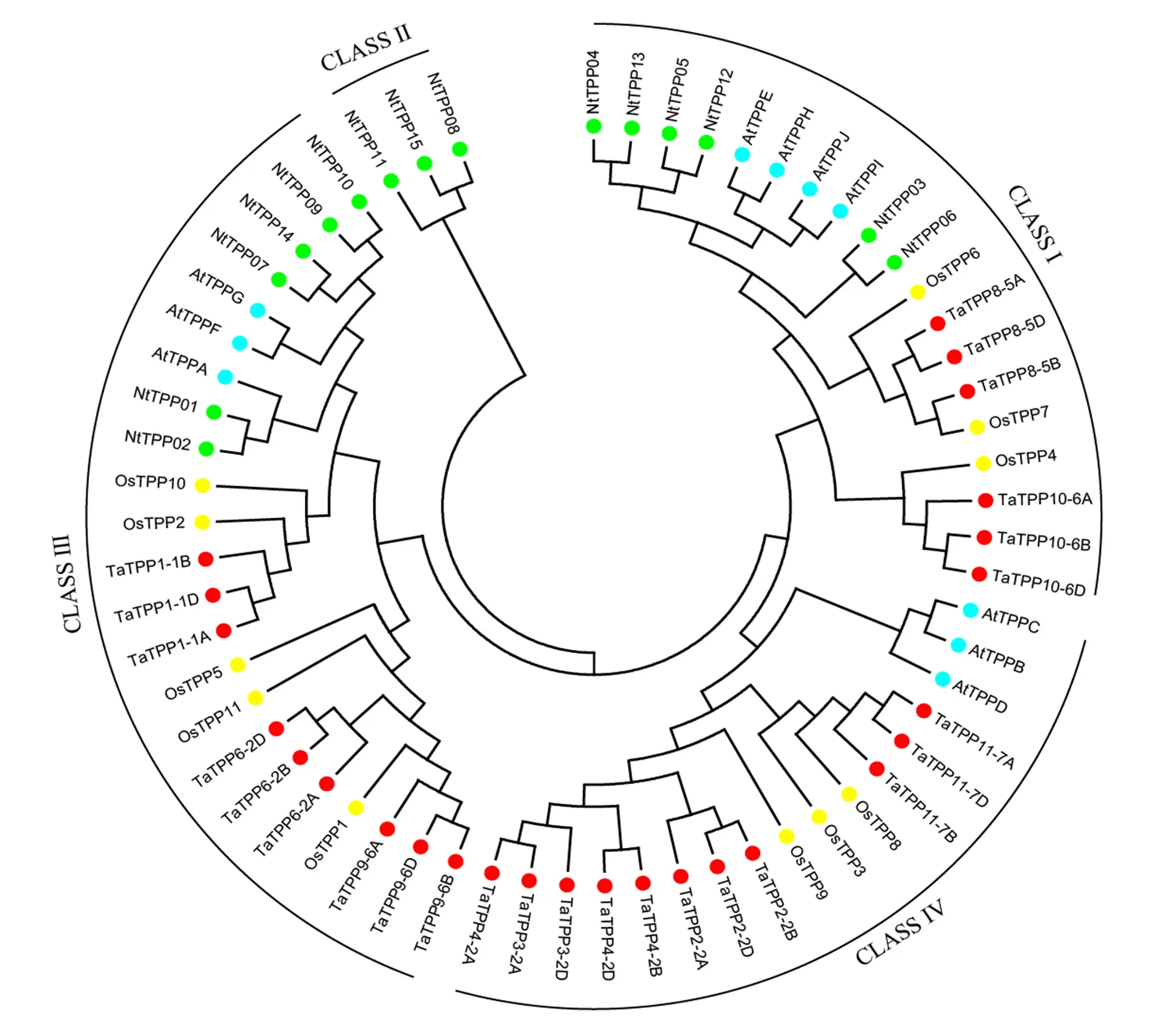
圖1 普通煙草TPP基因家族的系統進化分析
2.3 NtTPP基因結構和蛋白質保守基序分析
對NtTPP基因家族成員的基因結構分析發現(圖2),外顯子數目最多的是,包含13個外顯子,最少的是,僅有6個外顯子。CLASS Ⅰ亞家族的外顯子數目為6~10個,CLASS Ⅱ亞家族8~10個,CLASS Ⅲ亞家族10~13個。其中和的外顯子、內含子數目一致,均為11個,并且其位置和長度非常相似,表明這兩個基因在進化關系上極其保守。
用MEME軟件對NtTPP基因家族成員的蛋白質序列進行分析(圖2),共鑒定出15個保守基序(Motif 1~15)。CLASS Ⅰ和CLASS Ⅲ亞家族的保守基序均為8~12個,CLASS Ⅱ亞家族中僅有4個保守基序,其余兩個均為8個。其中Motif 1(TPP結構域)在煙草NtTPP基因家族中高度保守,該結構在海藻糖-6-磷酸磷酸酶(TPP)去磷酸化過程中起著重要的作用。值得注意的是,Motif 11僅存在于CLASS Ⅲ亞家族,Motif 14僅存在于CLASS Ⅰ亞家族,暗示這兩個亞家族功能可能比較特異。
2.4 NtTPP基因家族啟動子分析
分析上游調控序列有助于解釋基因調控的機制,進而預測其潛在功能[27]。使用在線工具PlantCARE,對NtTPP基因家族成員的上游2000 bp序列進行順式作用元件分析(圖3)。結果表明,在12個基因(、、、、、、、、、、和)的啟動子區域檢測到與干旱響應相關的順式作用元件(MBS);在13個基因(、、、、、、、、、、、和)的啟動子區域檢測到與脫落酸響應相關的順式作用元件(ABRE);在9個基因(、、、、、、、和)的啟動子區域檢測到與防御和逆境響應相關的順式作用元件(W-box、富含TC重復序列)。除此之外,NtTPP基因家族的啟動子區域還包含茉莉酸甲酯響應元件、赤霉素響應元件、生長素響應元件、乙烯響應元件、機械傷害響應元件、厭氧響應元件和低溫響應元件。值得注意的是含有5個脫落酸響應元件,含有高達8個防御和逆境響應的順式作用元件。表明NtTPP基因家族與煙草的抗逆相關。
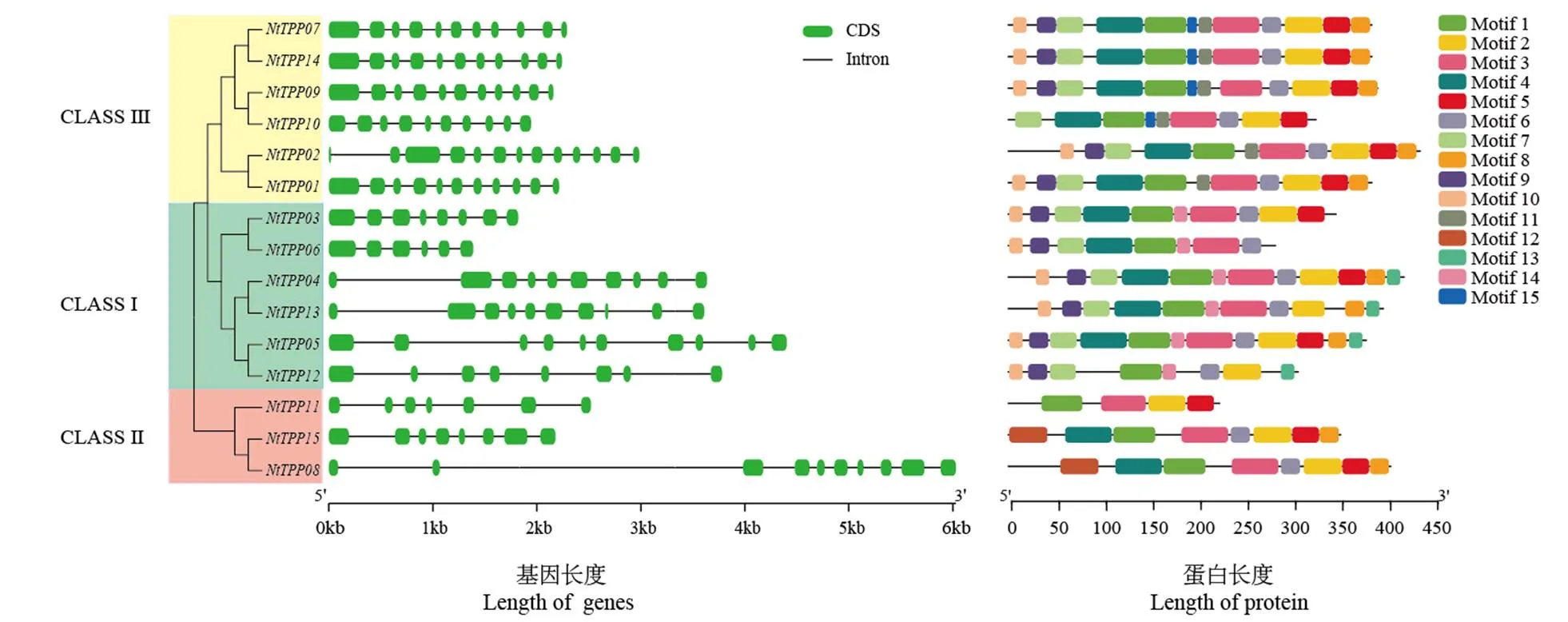
圖2 普通煙草TPP基因家族的基因結構及保守基序分析
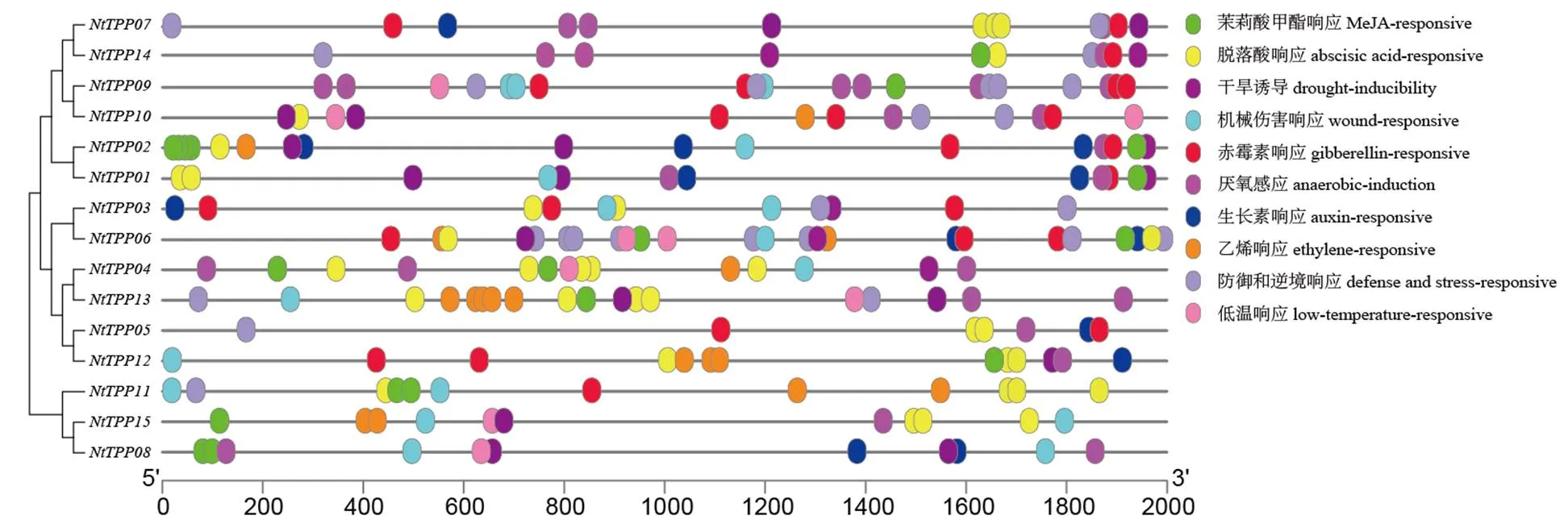
圖3 普通煙草TPP基因啟動子區順式作用元件分析
2.5 NtTPP基因家族的共線性分析
對煙草基因的潛在生物學功能進行分析,探索新基因與已經充分研究的基因的關系,通過共線性分析建立擬南芥與煙草之間的同源基因對(圖4)。分析結果表明,普通煙草與擬南芥為同源基因對,與、和為同源基因對,與和為同源基因對,與為同源基因對,與為同源基因對。煙草中有5個基因與擬南芥的7個基因形成共線對。
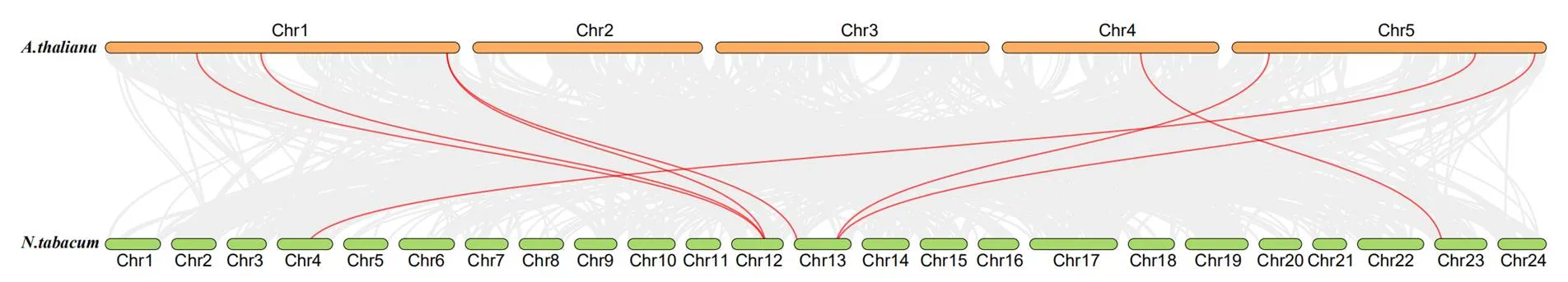
圖4 普通煙草和擬南芥的共線性分析
2.6 NtTPP基因家族表達模式
利用普通煙草轉錄組數據對基因在不同組織的表達模式分析,結果表明(圖5),基因在不同組織中的表達量變化較大。大部分基因在根中的表達量最高,在莖尖的表達量最低,包括CLASSⅠ亞家族的、和,CLASS Ⅱ亞家族的、和,CLASS Ⅲ亞家族的和。CLASS Ⅰ亞家族的和在莖中表達量較高,但在莖尖中表達量非常低。
對煙草轉錄組數據庫中的低溫和干旱數據進行分析發現,低溫處理1 d,CLASS Ⅲ亞家族的、和表達量明顯上調,但CLASS Ⅰ亞家族的和表達量出現下調趨勢。干旱處理1 d時,和表達量明顯上調,表達量下調較多。此外,、和表達量隨著處理時間的增加逐漸上升,在干旱處理8 d時達到最高。
2.7 脅迫處理下煙草NtTPP基因家族表達模式
為進一步探究基因的潛在功能,對15個基因在干旱和鹽脅迫處理下的表達模式進行分析表明(圖6、7),在干旱處理下,、、、、、、、和的表達量逐漸升高,并在6 h達到最高,其中,、和在6 h時表達倍數分別達到13、12和14倍,在1 h時表達量最高,但、和的表達量出現下降的趨勢。除此之外,表達量呈現先上升再下降的趨勢。干旱處理下有12個基因表達量呈現不同程度升高。
在鹽脅迫處理下,、、和表達量均出現先升高再降低再升高的趨勢,和表達量逐漸升高,并都在6 h時達到最高,表達倍數分別達到23和13倍,但和的表達量卻出現下降的趨勢。、、、、和在鹽脅迫處理1 h時表達量最高,其中在1 h時表達倍數達到12倍,隨后迅速下降。鹽脅迫處理下有13個基因表達量呈現不同程度升高。

注:紅色和綠色分別表示基因表達的上調和下調。

圖6 普通煙草TPP基因家族在干旱處理下的表達模式分析

圖7 普通煙草TPP基因家族在鹽處理下表達模式分析
3 討 論
本研究在普通煙草基因組中鑒定得到15個基因,均含有TPP保守結構域。系統進化分析將其劃分為3個亞家族,分別是CLASS Ⅰ、CLASS Ⅱ和CLASS Ⅲ,其中CLASS Ⅱ亞家族的、和與其他物種的TPP基因親緣關系較遠,說明它們在煙草中可能發揮特有的功能。進化分析發現煙草中沒有亞家族CLASS Ⅳ成員,這與基因在擬南芥、水稻以及小麥中的進化不一致,表明CLASS Ⅳ亞家族成員可能在煙草長期的進化過程中丟失。對其基因結構和蛋白保守結構域的分析發現,同一亞家族內基因結構非常相似,Motif 1(TPP結構域)在所有的NtTPP基因家族成員中均有,Motif 11僅存在于CLASS Ⅲ亞家族,Motif 14僅存在于CLASS Ⅰ亞家族。對其啟動子上的順式作用元件分析表明,NtTPP基因家族成員包含大量與植物激素響應以及抗逆響應相關的順式作用元件,進一步表明該基因家族在影響煙草生長發育及抗逆脅迫中扮演著重要的角色。
對煙草NtTPP基因家族轉錄組數據分析發現,NtTPP基因家族的大多數成員在低溫和干旱脅迫條件下均有響應。前人研究發現過表達、和分別能提高擬南芥、水稻和玉米的耐旱性[11,14-15];過表達基因能提高擬南芥高鹽脅迫耐受性[10]。我們進一步利用qRT-PCR對基因的表達模式進行驗證,發現除和外,其他煙草NtTPP家族成員在干旱和鹽脅迫誘導下表達量不同程度增加。其中、和在干旱脅迫下表達量增加較大,、和在鹽脅迫下表達量增加較大。另外在干旱脅迫條件下表達量顯著上調,該基因是擬南芥在煙草中的同源基因,先前的研究表明,可通過減少氣孔開放和改善根系結構來提高擬南芥的抗旱能力[28],在干旱條件下表達量上調暗示著該基因在煙草中也有相似功能。另外,在鹽脅迫條件下轉錄水平也顯著升高,表明該基因在煙草抵御逆境過程中有著重要作用。本研究通過NtTPP基因家族成員在非生物脅迫下的表達模式分析,初步鑒定一些抗逆基因、、、、、和,為研究其功能差異和提高栽培煙草的耐受性奠定基礎。
4 結 論
本研究從普通煙草基因組中鑒定到15個TPP基因,劃分為3個亞家族,分別為CLASS Ⅰ、CLASS Ⅱ和CLASS Ⅲ,均含有保守的TPP結構域。啟動子分析發現大量與逆境響應有關的順式作用元件存在于NtTPP家族成員的啟動子上,并且大部分基因在根中的表達量較高,同時對干旱和鹽脅迫均有響應,說明基因可能主要利用根部來提高煙草的抗逆能力,具體的作用機制還需要進一步在煙草中對該基因進行敲除以及過表達等方式來驗證。
[1] ELBEIN A D, PAN Y T, PASTUSZAK I, et al. New insights on trehalose: a multifunctional molecule[J]. Glycobiology, 2003, 13(4): 17R-27R.
[2] PAUL M J, PRIMAVESI L F, JHURREEA D, et al. Trehalose metabolism and signaling[J]. Annu Rev Plant Biol, 2008, 59: 417-441.
[3] Sundaramurthi P, PATAPOFF T-W, SURYANARAYANAN R. Crystallization of trehalose in frozen solutions and its phase behavior during drying[J]. Pharm Res, 2010, 27(11): 2374-2383.
[4] HACKEL C, ZINKEVICH T, BELTON P, et al. The trehalose coating effect on the internal protein dynamics[J]. Phys Chem Chem Phys, 2012, 14(8): 2727-2734.
[5] AVONCE N, MENDOZA-VARGAS A, MORETT E, et al. Insights on the evolution of trehalose biosynthesis[J]. BMC Evol Biol, 2006, 6: 109.
[6] PONNU J, WAHL V, SCHMID M. Trehalose-6-phosphate: connecting plant metabolism and development[J]. Front Plant Sci, 2011, 2: 70.
[7] DU L, LI S, DING L, et al. Genome-wide analysis of trehalose-6-phosphate phosphatases (TPP) gene family in wheat indicates their roles in plant development and stress response[J]. BMC Plant Biol, 2022, 22(1): 120.
[8] RAHMAN M M, RAHMAN M M, EOM J S, et al. Genome-wide identification, expression profiling and promoter analysis of trehalose-6-phosphate phosphatase gene family in rice[J]. Journal of Plant Biology, 2021, 64(1): 55-71.
[9] 張穎,陳浩,管淑君,等. 玉米TPP家族基因生物信息學及表達分析[J]. 分子植物育種,2021,19(8):2450-2459.
ZHANG Y, CHEN H, GUAN S J, et al. Bioinformatics and expression analysis of TPP family genes in maize[J]. Molecular Plant Breeding, 2021, 19(8): 2450-2459.
[10] KRASENSKY J, BROYART C, RABANAL F A, et al. The redox-sensitive chloroplast trehalose-6-phosphate phosphataseregulates salt stress tolerance[J]. Antioxid Redox Signal, 2014, 21(9): 1289-1304.
[11] LIN Q, YANG J, WANG Q, et al. Overexpression of the trehalose-6-phosphate phosphatase family geneimproves the drought tolerance of[J]. BMC Plant Biol, 2019, 19(1): 381.
[12] PRAMANIK M H R, IMAI R. Functional identification of a trehalose 6-phosphate phosphatase gene that is involved in transient induction of trehalose biosynthesis during chilling stress in rice[J]. Plant Mol Biol, 2005, 58(6): 751-762.
[13] SHIMA S, MATSUI H, TAHARA S, et al. Biochemical characterization of rice trehalose-6-phosphate phosphatases supports distinctive functions of these plant enzymes[J]. FEBS J, 2007, 274(5): 1192-1201.
[14] JIANG D, CHEN W, GAO J, et al. Overexpression of the trehalose-6-phosphate phosphataseincreases drought tolerance in rice[J]. Plant Biotechnology Reports, 2019, 13(3): 285-292.
[15] ACOSTA-PéREZ P, CAMACHO-ZAMORA B D, ESPINOZA-SáNCHEZ E A, et al. Characterization of trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase genes and analysis of its differential expression in maize () seedlings under drought stress[J]. Plants (Basel), 2020, 9(3): 315.
[16] RODRíGUEZ-SALAZAR J, SUáREZ R, CABALLERO- MELLADO J, et al. Trehalose accumulation inimproves drought tolerance and biomass in maize plants[J]. FEMS Microbiol Lett, 2009, 296(1): 52-59.
[17] 徐向麗,易克,蔣紅梅,等. 外源海藻糖對干旱脅迫下煙草幼苗抗旱性的影響[J]. 安徽農業科學, 2010, 38(33):18675-18677.
XU X L, YI K, JIANG H M, et al. Effect of exogenous trehalose on the drought-resisting of tobacco seedling under drought stress[J]. Journal of Aahui Agricultural Sciences, 2010, 38(33): 18675-18677.
[18] 陳芊伊. 外源海藻糖增強煙草對普通花葉病抗性的研究[D]. 鄭州:河南農業大學,2017.
CHEN Q Y. The research of disease resistance to TMV in tobacoo enhanced by trehalose treatment[D]. Zhengzhou: Henan Agricultural University, 2017.
[19] WANG Y J, HAO Y J, ZHANG Z G, et al. Isolation of trehalose-6-phosphate phosphatase gene from tobacco and its functional analysis in yeast cells[J]. J Plant Physiol, 2005, 162(2): 215-23.
[20] FINN R D, COGGILL P, EBERHARDT R Y, et al. The Pfam protein families database: towards a more sustainable future[J]. Nucleic Acids Research, 2016, 44(D1): D279-D285.
[21] GARG V K, AVASHTHI H, TIWARI A, et al. MFPPI - multi FASTA protparam interface[J]. Bioinformation, 2016, 12(2): 74-77.
[22] 鄧智超,田冬冬,宋青松,等. 煙草OSCA基因家族鑒定及非生物脅迫誘導表達模式分析[J]. 中國煙草科學,2022,43(1):14-21.
DENG Z C, TIAN D D, SONG Q S, et al. Genome wide identification and expression analysis of the OSCA gene family in response to abiotic stresses in tobacco[J]. Chinese Tobacco Science, 2022, 43(1): 14-21.
[23] HU B, JIN J, GUO A Y, ZHANG H, et al. GSDS 2.0: an upgraded gene feature visualization server[J]. Bioinformatics, 2015, 31(8): 1296-1297.
[24] BAILEY T L, BODEN M, BUSKE F A, et al. MEME SUITE: tools for motif discovery and searching[J]. Nucleic Acids Res, 2009, 37: W202-W208.
[25] 李志遠,宋青松,劉江,等. 普通煙草脂氧合酶基因家族鑒定及表達模式分析[J]. 中國煙草科學,2021,42(5):86-94.
LI Z Y, SONG Q S, LIU J, et al.Identification and expression analysis of the lipoxygenase gene family in tobacco (L.) [J]. Chinese Tobacco Science, 2021, 42(5): 86-94.
[26] EDWARDS K D, FERNANDEZ-POZO N, DRAKE-STOWE K, et al. A reference genome forenables map-based cloning of homeologous loci implicated in nitrogen utilization efficiency[J]. BMC Genomics, 2017, 18(1): 448.
[27] YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. Organization of cis-acting regulatory elements in osmotic- and cold-stress-responsive promoters[J]. Trends Plant Sci, 2005, 10(2): 88-94.
[28] LIN Q, WANG S, DAO Y, et al.trehalose-6-phosphate phosphatase geneenhances drought tolerance by regulating stomatal apertures[J]. J Exp Bot, 2020, 71(14): 4285-4297.
Identification and Expression Pattern Analysis of the TPP Gene Family in Tobacco
LIU Tao1,2, GUO Cun3, ZOU Zongqing4, JIN Liquan5, WU Jian5, WEN Lichao1,2, DENG Zhichao1,2, CHU Yumeng1,2, WANG Lingtao6, LI Wei1*, GUO Yongfeng1*
(1. Key Laboratory of Tobacco Gene Resources, Institute of Tobacco Research of CAAS, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. Kunming Branch of Yunnan Provincial Tobacco Company, Kunming 650000, China; 4. Fujian Tobacco Company Longyan City Company, Longyan, Fujian 361000, China; 5. Shandong Linyi Tobacco Co., Ltd., Lanling Branch, Linyi, Shandong 277700, China; 6. Hubei Tobacco Company Shiyan City Company Zhuxi County Marketing Department, Shiyan, Hubei 442300, China)
Trehalose-6-phosphate phosphatase (TPP) is a key enzyme in trehalose metabolism and plays an important role in plant growth and abiotic stress response. In order to excavate members of the TPP gene family involved in tobacco development and stress response, we identified 15genes in the common tobacco genome through bioinformatic methods, with 7 of thegenes located on chromosomes. Phylogenetic analysis revealed that the newly identified tobacco TPP family members could be divided into three subfamilies: CLASS I, CLASS II and CLASS III. Syntenic analysis revealed that there were eight homologous gene pairs between Arabidopsis and tobacco. Sequence analysis showed that the promoters ofgenes contained various hormone- and stress-related elements. Furthermore, the expression ofgenes was studied in different tissues and most of thegenes were expressed at the highest level in roots. The expression pattern analysis showed that 12genes were up-regulated under drought stress, and 13genes could be induced by salt treatments. This indicates that thegene family members play an important role in drought and salt stress responses of tobacco.
tobacco; trehalose-6-phosphate phosphatase(TPP); drought stress; salt stress; expression pattern
10.13496/j.issn.1007-5119.2022.06.001
S572.03
A
1007-5119(2022)06-0001-08
中國農業科學院科技創新工程(ASTIP-TRIC02)
劉 濤(1998-),男,在讀碩士研究生,研究方向:煙草育種。E-mail:2230928343@qq.com
,E-mail:李 偉,liwei06@caas.cn;郭永峰,guoyongfeng@caas.cn
2022-06-07
2022-09-27

