蘑菇中鵝膏毒肽間接競爭ELISA檢測方法的建立
劉河冰,秦 譽,邢維維,馬立才
(北京維德維康生物技術有限公司,北京 100095)
蘑菇引起的食物中毒一直是世界上許多國家重點關注的食品安全問題之一。近年來,我國因誤食毒蘑菇而引起的中毒事件頻發(fā),且死亡率居高不下。我國蘑菇資源豐富,有記載的毒蘑菇多達480多種,其中,鵝膏菌屬類蘑菇含有一種毒性環(huán)肽,即鵝膏毒肽[1]。鵝膏毒肽能與真核細胞RNA聚合酶Ⅱ、DNA模板及新合成的RNA形成穩(wěn)定的四元復合物,進而阻礙蛋白質的合成,最終導致肝臟等組織細胞的壞死[2]。據(jù)報道,我國90%以上的蘑菇食物中毒死亡事件都是由鵝膏毒肽引起的[3]。鵝膏毒肽主要包括α-鵝膏毒肽、β-鵝膏毒肽和γ-鵝膏毒肽,對人的口服半數(shù)致死量(LD50)分別為0.3、0.5和0.2 mg/kg[4?5]。誤食含有鵝膏毒肽的毒蘑菇后,一旦出現(xiàn)了中毒癥狀,搶救效果往往不好,死亡率較高[6]。因此,早期診斷對于鵝膏毒肽中毒的救治尤為重要。
目前,檢測鵝膏毒肽的方法主要有液相色譜法[7?8]、超高效液相色譜-串聯(lián)質譜法[9?11]、超高效液相色譜-四極桿飛行時間質譜[12?15]、基因擴增技術[16?17]、毛細管電泳法[18?19]、酶聯(lián)免疫吸附法[20?23]等。儀器方法是近年來應用最為廣泛的檢測方法,具有靈敏度高、準確性好等優(yōu)點,但是儀器方法操作繁瑣,價格昂貴,不適用大批量樣品的現(xiàn)場檢測。超分支滾環(huán)擴增技術對人員的操作技術要求較高,很難實現(xiàn)廣泛的推廣使用。相比之下,酶聯(lián)免疫分析方法作為一種操作簡便、靈敏度高、檢測時間短的快檢方法,在蘑菇毒素檢測項目中備受關注,許多國家已經(jīng)批準了一系列商業(yè)ELISA試劑盒的應用,但國內對于α-鵝膏毒肽的免疫學檢測方法的報道較少[24?25]。
因此,本研究欲建立一種快速、靈敏、準確的蘑菇中α-鵝膏毒肽間接競爭ELISA檢測方法,為突發(fā)毒蘑菇中毒事件的快速診斷提供一種便捷可靠的檢測技術手段,對保障人們的生命健康有著重要的現(xiàn)實意義。
1 材料與方法
1.1 材料與儀器
甲醇(CH3OH)、碳酸氫鈉(NaHCO3)、硫酸銨((NH4)2SO4) 中國醫(yī)藥集團有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)、N,N-二甲基甲酰胺(DMF) 上海江萊生物科技有限公司;N-羥基琥珀酰亞胺(NHS) 北京中生瑞泰科技有限公司;牛血清蛋白(BSA)、卵清蛋白(OVA) 美國Amresco公司;辣根過氧化物酶(HRP)、弗氏完全佐劑(FCA)和弗氏不完全佐劑(FICA)等藥物 Sigma公司;6~8周齡Balb/c雌鼠 北京實驗動物研究中心,實驗動物許可證號SYXK(京)2020-0038;α-鵝膏毒肽、β-鵝膏毒肽和γ-鵝膏毒肽等標準品(純度≥95%) 上海安譜實驗科技股份有限公司;蘑菇樣品,共計30份 美廉美超市、物美溫泉品超市和前沙澗早市。
ES-A電子天平 天津德安特傳感技術有限公司;Sorvall LYNX 6000超速離心機、MK3酶標儀美國Thermo Fisher Scientific;KQ-100E超聲波清洗儀 昆山市超聲儀器有限公司。
1.2 實驗方法
1.2.1 溶液配制 鵝膏毒肽標準溶液:準確稱取1.0 mg鵝膏毒肽標準品,用甲醇溶解并定容至10 mL,配制成100 ppm的標準品儲備液,于?20 ℃避光保存,備用;洗液(PBST):取300 μL Tween-20加入到100 mL PBS(0.02 mol/L)中混勻,備用。
1.2.2 鵝膏毒肽抗原的制備 稱取α-鵝膏毒肽標準品10 mg,10 mL DMF溶解,再加入6.25 mg EDC與3.75 mg NHS,室溫反應3 h。然后,再加入1.42 mg 6-氨基己酸,室溫反應過夜,采用薄層制備板純化得半抗原(圖1)。
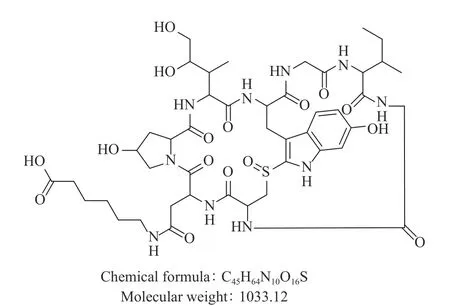
圖1 α-鵝膏毒肽半抗原結構Fig.1 The structure of α-amanitin hapten
稱取2.29 mgα-鵝膏毒肽半抗原,用0.5 mL DMF溶解,200 r/min室溫攪拌10 min,加入1 mg EDC溶解后再加入1 mg NHS,室溫500 r/min攪拌活化2~3 h。將上述反應液逐滴加入到5 mL含有1%BSA(包被原:1% OVA)的碳酸氫鈉緩沖溶液(0.1 mol/L)中,500 r/min室溫攪拌反應24 h。用1 L 0.01 mol/L PBS(pH7.2)透析3 d(4 ℃,100 r/min),每天換液3次(早中晚各一次),共計換液9次。將透析產(chǎn)物5000 r/min離心6 min,即得到鵝膏毒肽完整抗原,并通過MALDI-TOF/MS對所合成抗原的偶聯(lián)比進行測定[26]。
1.2.3 單克隆抗體的制備 使用1.2.2制備的免疫原免疫6~8周齡的健康雌性BALB/c小鼠,共4只,免疫前需觀察7 d。將100 μg免疫原用無菌生理鹽水稀釋至1 mg/mL,首次免疫加入等量的弗氏完全佐劑,完全乳化后,采用頸背部皮下、多點注射的方式免疫4只小鼠。共免疫6次,每次免疫間隔時間均為2周。具體免疫方案見表1。

表1 單克隆抗體(小鼠)的免疫程序Table 1 Monoclonal antibody (mouse) immune program
四免一周后,對小鼠眼眶進行采血,室溫放置2 h,4000 r/min離心10 min。然后,采用間接ELISA方法對血清效價進行檢測[27]。末次免疫后,將免疫小鼠的脾細胞與小鼠骨髓瘤細胞(SP2/0)混合,用50%PEG進行細胞融合,用HAT培養(yǎng)基懸浮均勻,再加入適量的飼養(yǎng)細胞,于96孔培養(yǎng)板中,37 ℃,5%CO2培養(yǎng)箱中培養(yǎng),5 d后用HAT培養(yǎng)基半換液,9 d后進行全換液。然后采用間接ELISA方法,選擇和標記效價高、抑制率高的陽性雜交瘤細胞。將陽性雜交瘤細胞用半固體培養(yǎng)基培養(yǎng)法進行2~3次培養(yǎng),將最終獲得的陽性單克隆細胞株采用體內誘生法制備腹水,腹水采用Protein A親和層析柱進行純化,最終得到鵝膏毒肽單克隆抗體。
1.2.4 特異性試驗 選擇與α-鵝膏毒肽具有類似結構的β-鵝膏毒肽,γ-鵝膏毒肽和鬼筆毒肽進行ELISA測定,通過標準曲線分別得到各自的IC50值,然后根據(jù)下式計算α-鵝膏毒肽結構類似物的交叉反應率(%):
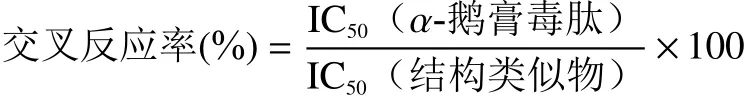
式中:IC50(α-鵝膏毒肽)為引起50%抑制的α-鵝膏毒肽濃度(μg/L);IC50(結構類似物)為引起50%抑制的結構類似物濃度(μg/L)[28]。
1.2.5 ic-ELISA檢測方法的建立 用包被液將包被抗原稀釋至最適濃度,按照100 μL/孔加入酶標板,孵育一定時間。用PBST洗板3次后,每孔加入150 μL封閉液,封閉一段時間,棄去封閉液并拍干。競爭反應:加入鵝膏毒肽標準品或待測樣品,50 μL/孔,再加入50 μL合適濃度的抗體工作液,37 ℃孵育競爭反應30 min。用PBST(300 μL/孔)洗板3次后,每孔加入100 μL的酶標二抗HRP-IgG,37 ℃孵育一段時間。用PBST(300 μL/孔)洗板3次后,加入新鮮配制的TMB溶液(100 μL/孔),37 ℃避光反應15 min。加入2 mol/L H2SO4(50 μL/孔),用酶標儀測定各孔的OD450nm值。
1.2.6 ic-ELISA方法的優(yōu)化
1.2.6.1 包被原和抗體工作濃度的優(yōu)化 利用矩陣法對包被原和抗體的工作濃度進行優(yōu)化。用包被液將抗原分別按1:500、1:1000、1:2000、1:4000、1:8000和1:16000進行稀釋,鵝膏毒肽單克隆抗體分別按1:750、1:1500、1:3000、1:6000、1:12000、1:24000和1:48000稀釋,按照1.2.5步驟進行操作,確定吸光度值為2.0附近的組合作為最佳包被原和抗體工作濃度。
1.2.6.2 包被條件的篩選 分別用含0.05 mol/L的Tris-HCl(pH8.0)、0.05 mol/L的碳酸鹽緩沖液(CB,pH9.6)、0.01 mol/L PBS作為包被液(pH7.4),分別置于37 ℃孵育1 h、2 h、4 ℃孵育過夜,然后按照1.2.5的方法進行檢測。比較各組OD值,確定該方法中最佳包被條件。
1.2.6.3 封閉條件的篩選 分別用5%脫脂乳、5%的BSA、2%明膠作為封閉液,分別置于37 ℃條件下封閉30、45、60、90 min。按照1.2.5步驟進行操作,根據(jù)IC50和ODmax/IC50確定最佳封閉條件。
1.2.6.4 酶標二抗工作條件的優(yōu)化 在優(yōu)化后的包被原和抗體工作濃度,包被及封閉條件下,羊抗鼠酶標二抗按照1:500、1:1000、1:2000、1:4000和1:8000進行稀釋,分別以20、25、30和40 min孵育時間來進行反應,按照1.2.5步驟操作,根據(jù)IC50和ODmax/IC50確定最佳酶標二抗稀釋濃度和孵育反應時間。
1.2.7 樣品前處理 稱取(2±0.05)g經(jīng)烘干、均質后的蘑菇樣品于50 mL離心管中,加入6 mL甲醇,充分渦動10 min;4000 r/min以上離心5 min,取4 mL上層有機相,于50~60 ℃水浴氮氣吹干。加入1 mL正己烷,再加入0.5 mL樣品稀釋液(氯化鈉0.4 g,十二水合磷酸氫二鈉0.268 g,氯化鉀0.01 g,磷酸二氫鉀0.01 g,去離子水100 mL配制而成),充分渦動10 s;4000 r/min以上離心5 min,除去上層有機相,取下層進行檢測。
1.2.8 標準曲線的建立 取6份處理后的蘑菇樣品,向其中添加鵝膏毒肽的標準溶液,使其終濃度分別為0、0.5、1.0、2.0、4.0、8.0、16.0 μg/kg,充分混勻后,按照1.2.7節(jié)進行樣本處理。采用所建立的ic-ELISA方法進行檢測,每個添加量分別重復5次,取其OD450nm平均值,并繪制標準曲線。
1.2.9 ic-ELISA檢測方法的評價
1.2.9.1 檢出限 選取α-鵝膏毒肽陰性的蘑菇樣品20份,按照1.2.7、1.2.5進行樣本的處理和檢測,依據(jù)1.2.8建立的標準曲線,計算20份樣本檢測結果的均值和標準差。20份樣本測定結果的均值加上3倍標準偏差即為本方法的檢出限[29]。
1.2.9.2 準確度和精密度 分別采用添加回收率和變異系數(shù)(CV)來評價方法的準確度和精密度。將蘑菇空白樣品中分別添加終濃度為2.0、4.0、8.0 μg/kg的α-鵝膏毒肽,每個濃度做3個平行,按照1.2.7中的方法進行樣品前處理,采用1.2.5中ic-ELISA方法進行檢測,計算添加回收率[30]。
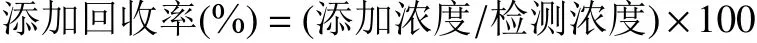
在3個不連續(xù)的工作日內重復測定3次,按照下述公式計算批內和批間變異系數(shù):
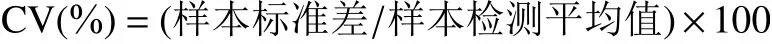
1.3 數(shù)據(jù)分析
在標準曲線制作過程中,以樣本中添加的α-鵝膏毒肽質量濃度(μg/kg)的自然對數(shù)值為X軸,吸光度OD值為Y軸,采用Origin 8.0軟件擬合四參數(shù)競爭標準曲線。
2 結果與討論
2.1 鵝膏毒肽抗原的合成與鑒定
本研究在α-鵝膏毒肽分子的羧基位置引入6-氨基己酸,獲得含有6碳間隔臂的半抗原(分子量為1033.12),有利于高特異性抗體的制備。據(jù)文獻報道,其它類型的間隔臂也用于鵝膏毒肽半抗的合成,例如琥珀酸酐、混合酸酐和三聚氯氰等[22?23]。α-鵝膏毒肽是一種非免疫原性的低分子量半抗原,因此需要將其與載體蛋白偶聯(lián)才能刺激動物反應并產(chǎn)生抗體[31]。本研究使用牛血清白蛋白(BSA)和卵清蛋白(OVA)作為載體蛋白,分別制備α-鵝膏毒肽免疫原和包被原,并使用基質輔助激光解吸電離飛行時間質譜法(MALDI-TOF)對免疫原的偶聯(lián)比進行測定。結果如圖2所示:載體蛋白BSA的分子質量為64772.026,免疫原的分子質量為75135.321,經(jīng)計算可知,免疫原AMA-BSA的偶聯(lián)比為10.03。
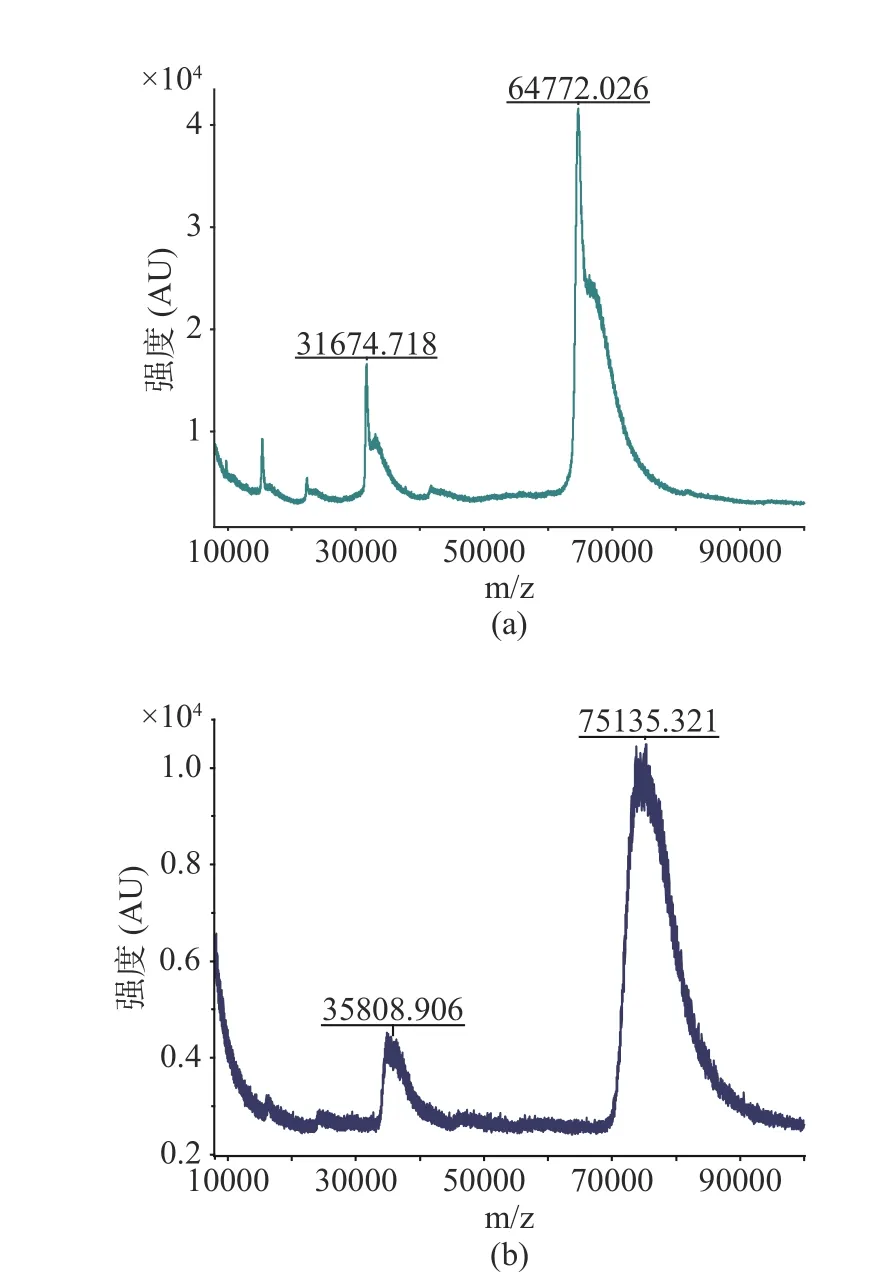
圖2 BSA(a)和α-AMA-BSA(b)的MALDI-TOF-MS圖譜Fig.2 MALDI-TOF-MS spectrum of BSA and α-AMA-BSA
2.2 抗體的制備與特異性評價
2.2.1 鼠單克隆抗體的制備 小鼠四免一周后,對小鼠進行眼眶采血,采用間接ELISA方法測定其血清效價,數(shù)據(jù)見表2。從表中數(shù)據(jù)可以看出,3#小鼠的血清效價最高(1:12800,OD=2.016)。因此,選擇3#小鼠進行下一步的脾細胞融合試驗。
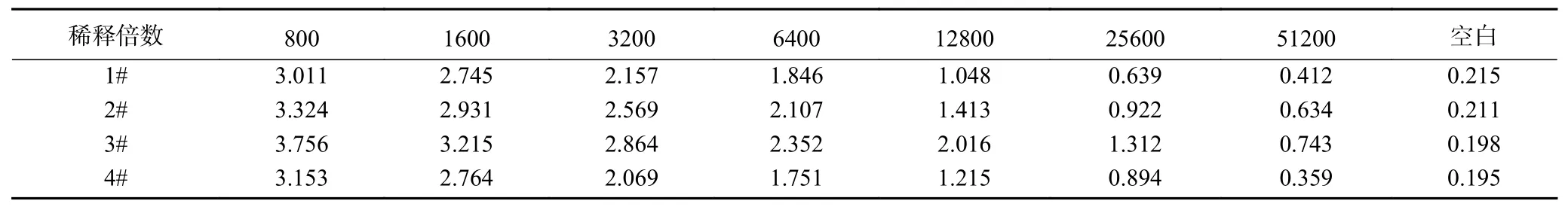
表2 免疫Balb/c小鼠血清效價ELISA檢測結果Table 2 The serum titer of immunized Balb/c mice by ELISA
融合細胞后,經(jīng)3次克隆后陽性率達100%,采用間接競爭ELISA方法篩選得到效價高、免疫抑制率的雜交瘤細胞13H4。然后,將篩選得到的雜交瘤細胞注射到小鼠腹腔,采用體內誘生法制備腹水。7 d后,觀察小鼠產(chǎn)生抗體的情況,待腹部明顯膨大時,收集腹水。采用Protein A親和層析柱對收集的腹水進行純化,最終得到純化的α-鵝膏毒肽鼠單克隆抗體,其效價和IC50分別為1:32000和1.91 μg/L。
2.2.2 特異性試驗結果 用間接競爭ELISA方法對α-鵝膏毒肽及其類似物進行檢測,以測定所制備單克隆抗體的特異性(表3)。結果顯示,α-鵝膏毒肽與β-鵝膏毒肽和γ-鵝膏毒肽的交叉反應率分別為84.14%和76.70%,而鬼筆毒肽的交叉反應率均小于0.50%,這種交叉反應率的差異是由其分子結構的不同造成的(表3)[32]。由此可見,本研究所制備的α-鵝膏毒肽單克隆抗體具有良好的特異性,可應用于免疫學快檢方法的開發(fā)。
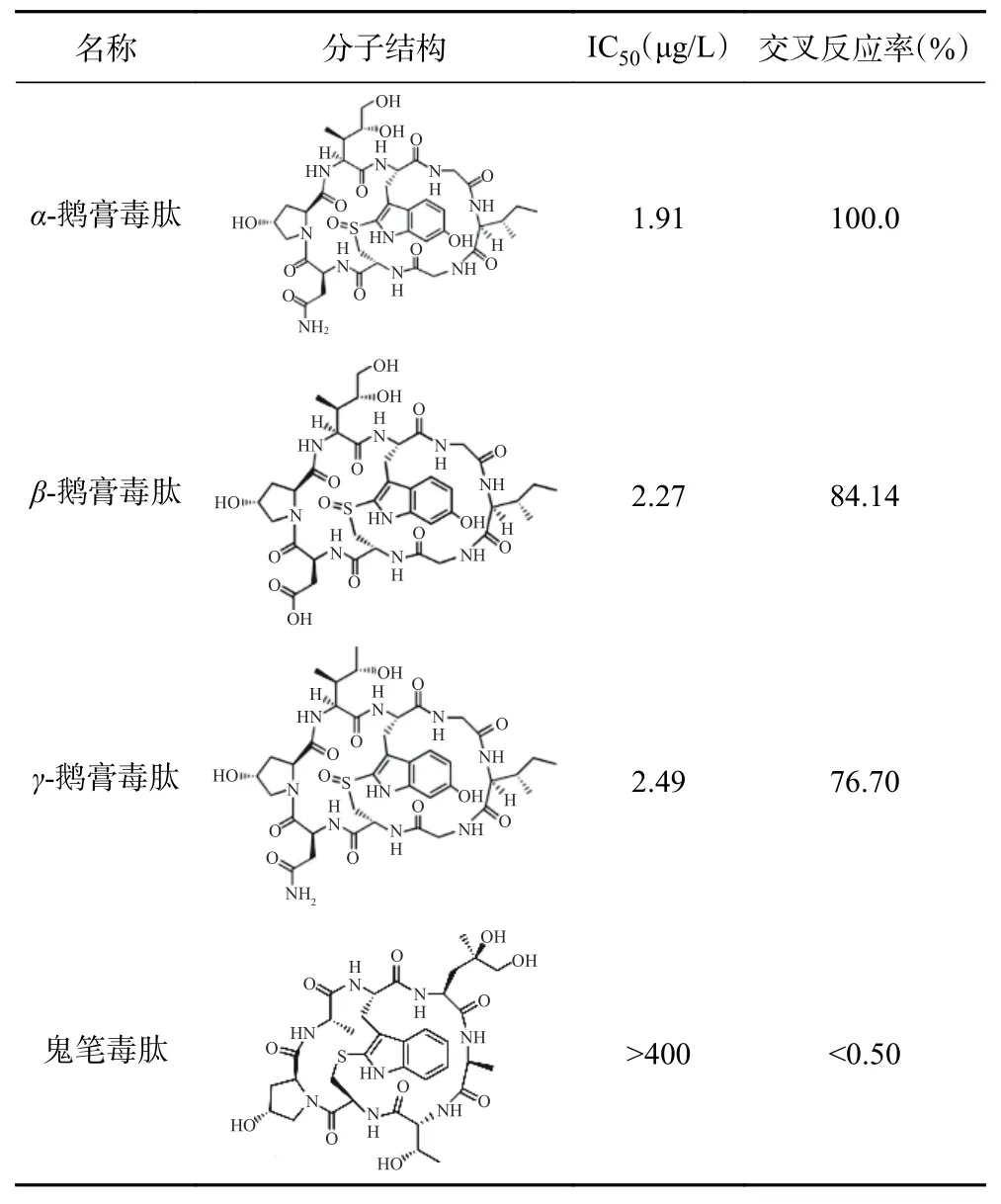
表3 鵝膏毒肽單克隆抗體的特異性Table 3 The specificity of amanitin monoclonal antibody
2.3 反應條件的優(yōu)化
2.3.1 包被原和抗體工作濃度的確定 包被原、抗體的濃度直接影響方法的線性范圍、靈敏度、最低檢測限等,是建立免疫學檢測方法的核心研究內容。本研究以OD值接近2.0時的包被原濃度和抗體稀釋度作為最佳抗原包被濃度與最適抗體稀釋度。結果如表4所示,隨著包被原和抗體稀釋度的增加,OD值呈現(xiàn)下降趨勢。當單抗的稀釋度為1:6000,包被原稀釋度為1:1000時,OD值在2.0左右,因此選擇1:6000為抗體稀釋濃度,1:1000為包被抗原稀釋濃度,進行后續(xù)試驗。
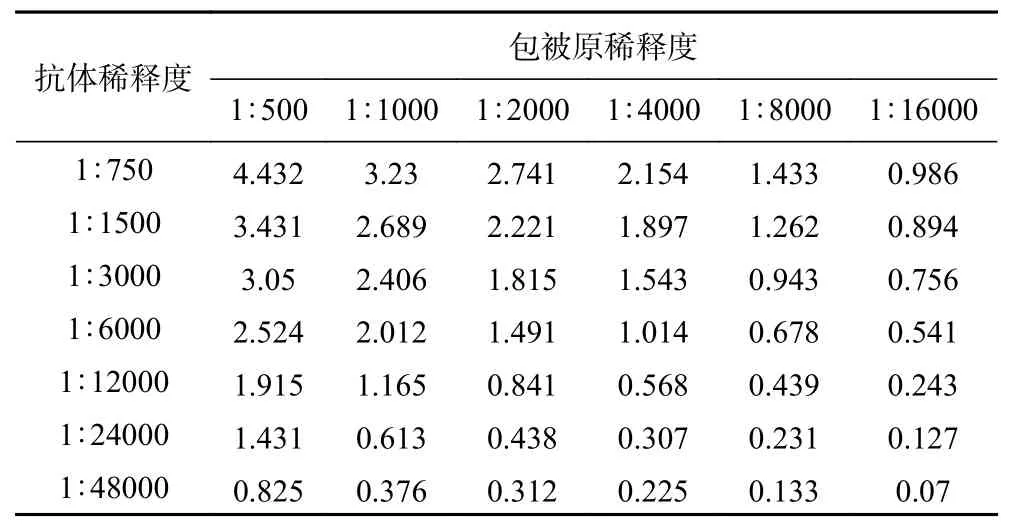
表4 包被原濃度和抗體稀釋度的確定Table 4 Determination of the concentration of coating antigen and antibody
2.3.2 最佳包被條件的確定 通過建立ic-ELISA方法對包被條件進行優(yōu)化,根據(jù)OD值確定最佳包被時間和包被液。結果如表5所示,0.05 mol/L碳酸鹽緩沖液(pH9.6)作為抗原包被液,4 ℃孵育過夜時,OD值在2.0左右。因此選擇0.05 mol/L碳酸鹽緩沖液(pH9.6),4 ℃孵育過夜作為最佳包被條件。
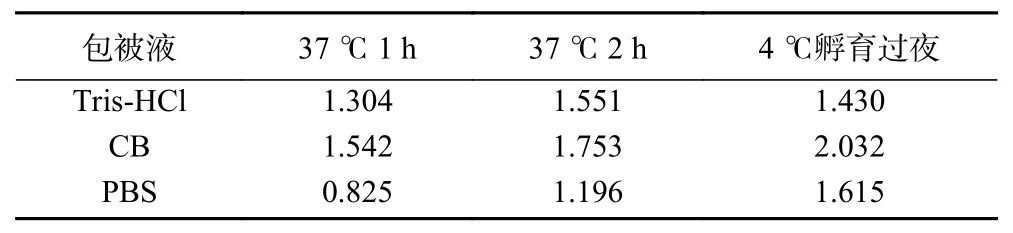
表5 包被條件的優(yōu)化Table 5 Optimization of coating conditions
2.3.3 封閉條件的確定 封閉是影響ic-ELISA檢測方法的重要因素之一,選擇合適的封閉液不僅可以發(fā)揮穩(wěn)定劑和保護劑的作用,還可以減少抗原或抗體的非特異性結合[33?34]。因此,本研究對其封閉條件進行優(yōu)化,結果由圖3、圖4所示,不同種類的封閉液和封閉時間對其結果影響較大。當選擇5%的脫脂乳作為封閉液,封閉60 min時,IC50最低,ODmax/IC50值最大。因此,本試驗選擇5%的脫脂乳作為封閉液,封閉時間為60 min。
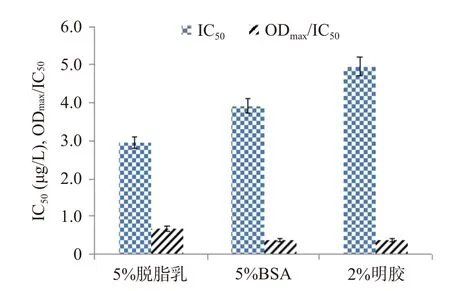
圖3 封閉液的優(yōu)化Fig.3 Optimization of blocking buffer
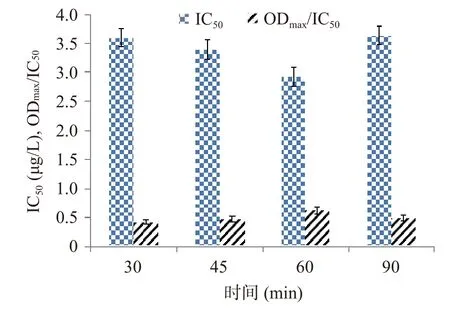
圖4 封閉時間的優(yōu)化Fig.4 Optimization of blocking time
2.3.4 酶標二抗工作濃度和孵育時間的確定 在ic-ELISA方法中,抗體與酶標二抗的結合受到二抗?jié)舛纫约胺磻獣r間的影響。稀釋濃度大,可節(jié)約二抗的使用量,節(jié)省成本,但稀釋倍數(shù)過大時會造成底物顯色較弱,方法的線性范圍窄。因此,需要對二抗工作濃度和孵育時間進行優(yōu)化。結果由圖5可知,當孵育時間為30 min時,IC50值最小,ODmax/IC50值最大,故選擇孵育時間為30 min。酶標二抗不同稀釋倍數(shù)的數(shù)據(jù)見圖6,同理可得出酶標二抗?jié)舛认♂尡稊?shù)為1:1000時為最佳條件。
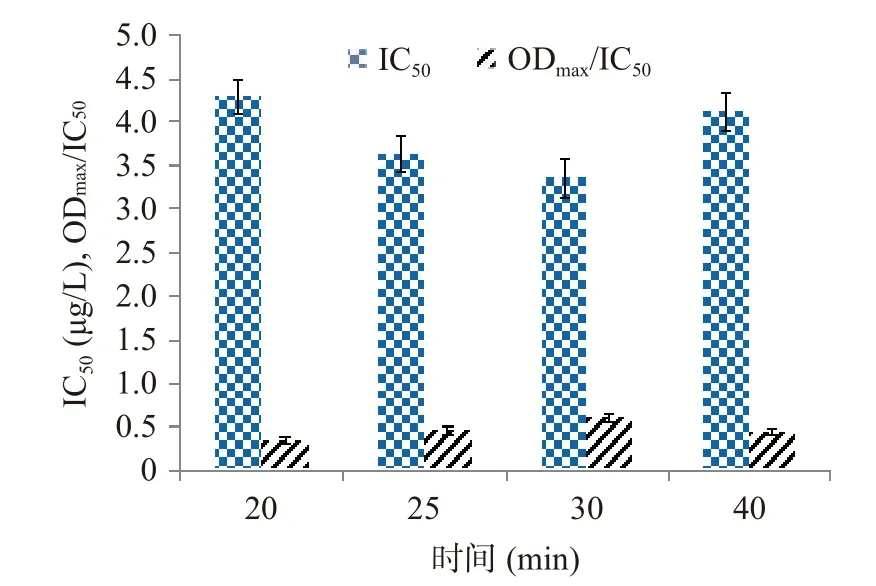
圖5 二抗孵育時間的優(yōu)化Fig.5 Optimization of the incubation time with secondary antibody
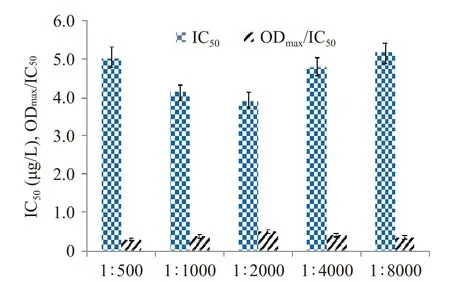
圖6 二抗工作濃度的優(yōu)化Fig.6 Optimization of the working concentration of the secondary antibody
2.4 標準曲線
α-鵝膏毒肽擬合得到的四參數(shù)曲線如圖7所示,其方程為Y=0.7458+3.53431/(1+(x/2.1966)1.8025),IC50為2.80 μg/kg,該標準曲線的線性區(qū)間(IC20~IC80)為1.18~15.00 μg/kg,R2=0.9989。
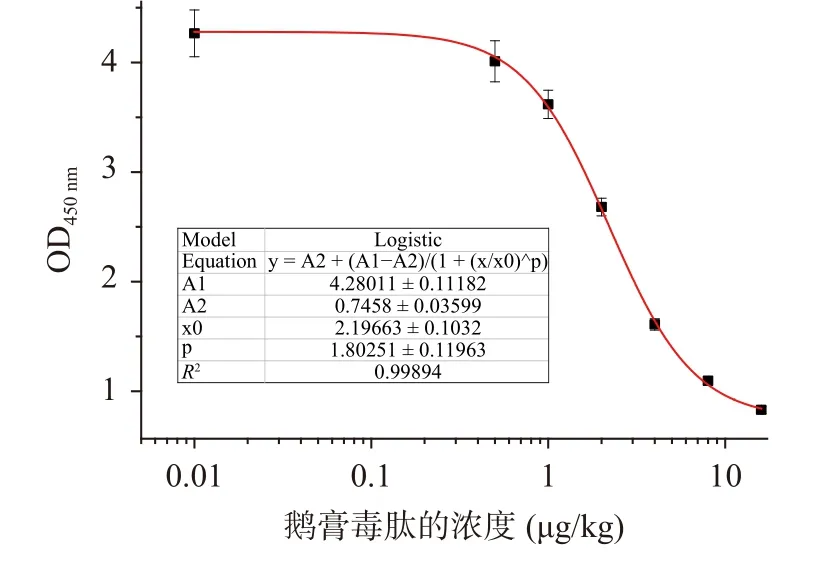
圖7 ic-ELISA檢測α-鵝膏毒肽的標準曲線Fig.7 The standard curve of ic-ELISA for detecting α-amanitin
2.5 方法學評價
2.5.1 檢出限測定結果 本研究利用ic-ELISA方法檢測20份陰性的蘑菇,從表6中可以看出,20個樣本檢測結果的平均值為0.43 μg/kg,標準差為0.15 μg/kg,計算得到該方法蘑菇樣本中α-鵝膏毒肽的檢出限為0.88 μg/kg。

表6 鵝膏毒肽空白樣品測定結果(μg/kg)Table 6 The detection results of amanitin in free mushroom samples by the established ic-ELISA(μg/kg)
2.5.2 準確度和精密度測定結果 回收率實驗是通過計算分析方法的實驗誤差和操作過程的損失,來評價所建立方法的可靠性。本研究在蘑菇樣本中依次添加α-鵝膏毒肽標準物質,使其終濃度分別為2.0、4.0和8.0 μg/kg,使用本研究所建立的ELISA方法檢測得到的結果如表7所示。本方法對蘑菇中α-鵝膏毒肽添加回收率為85.66%~113.05%,批內變異系數(shù)為5.35%~9.54%,批間變異系數(shù)為小于15%。免疫檢測方法的準確度和精密度受到多種因素的影響,包括樣本基質差異、前處理方法的提取效率、檢測操作的偏差等。在多數(shù)的國家標準或行業(yè)標準中,免疫學檢測方法及儀器檢測方法的準確度在80%~120%,精密度在15%以內。由此可見,本研究所建立的ic-ELISA方法具有較好的準確度和精密度,能夠滿足實際檢測的需求。
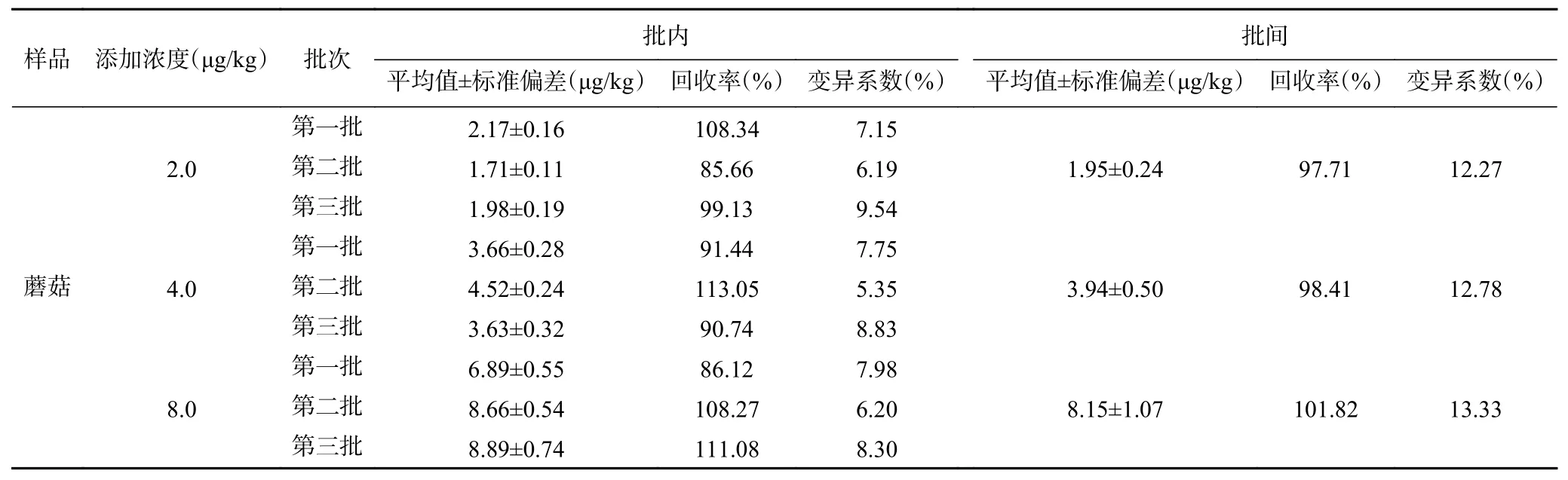
表7 ic-ELISA準確度和精密度Table 7 Accuracy and precision of the established ic-ELISA
3 結論
本研究成功合成了α-鵝膏毒肽半抗原(分子量為1033.12),并制備了α-鵝膏毒肽單克隆抗體。通過優(yōu)化反應條件,建立了蘑菇中α-鵝膏毒肽的間接競爭酶聯(lián)免疫吸附檢測方法。該方法的IC50為2.80 μg/kg,線性范圍為1.18~15.00 μg/kg,檢測限為0.88 μg/kg。除β-鵝膏毒肽(84.14%)和γ-鵝膏毒肽(76.70%)以外,與其它類似物的交叉反應率均小于0.50%,表明該方法特異性良好。該方法對蘑菇中α-鵝膏毒肽的添加回收率為85.66%~113.05%,批內變異系數(shù)為5.35%~9.54%,批間變異系數(shù)小于15%。由此可見,本研究所建立的ic-ELISA方法準確度、精密度、靈敏度較高,且性能穩(wěn)定,可用于蘑菇中α-鵝膏毒肽的殘留檢測,為突發(fā)毒蘑菇中毒事件的毒素分析提供了一種可靠的方法。

