一種改良的豬圓環病毒2型熒光定量PCR檢測方法的建立
張鑫玉,吳 瓊,張 濤,周 波,溫海京,崔德鳳*,張永紅*
(1.北京農學院動物科學技術學院/獸醫學(中醫藥)北京市重點實驗室,北京 102206;2.河北農業大學動物科技學院,保定071000;3.中牧實業股份有限公司,北京 100070)
豬圓環病毒2型(porcine circovirus type 2,PCV2)是圓環病毒科圓環病毒屬的成員之一,也是目前世界上最小的DNA病毒,其基因組全長1 700 bp左右,包含11個開放閱讀框(open reading frame,ORF)。該病毒感染豬可與豬繁殖與呼吸綜合征病毒混合感染引起斷奶仔豬多系統衰竭綜合征(postweaning multisystemic wasting syndrome, PMWS)。此外,PCV2還與豬皮炎與腎病綜合征( porcine dermatitis and nephropathy syndrome,PDNS)、豬呼吸道疾病綜合征(porcine respiratory disease complex,PRDC)及母豬的生產繁殖障礙等疾病相關。故PCV2已成為嚴重阻礙養豬業發展的主要病原之一[1-3]。感染PCV2的患病母豬大大降低受孕率,增加感染母豬的流產率,導致可能產下木乃伊胎[4]。由于PCV2感染豬群存在臨床發病與亞臨床感染,其體內的病毒載量不同,易引起PCV2檢測的漏檢,出現診斷錯誤而延誤病情[5]。
針對PCV2的檢測方法有很多,如酶聯免疫吸附試驗、病毒分離、聚合酶鏈式反應等,這些方法都存在著操作煩瑣復雜、耗時較長以及檢測方法相對敏感性較低等弊端[6],故而針對PCV2建立一種操作簡便、靈敏的、快速的檢測方法非常必要。ORF2編碼PCV2的衣殼蛋白,是PCV2重要的抗原基因[7],因此ORF2成為診斷鑒別PCV2的關鍵靶基因。該研究針對PCV2的ORF2基因設計一對特異性引物,利用SYBR Green熒光染料建立一種快速、靈敏的實驗室內PCV2的絕對定量PCR技術檢測方法,為臨床中PCV2的診斷及流行病學調查提供有效的技術支持。
1 材料與方法
1.1 材 料
豬圓環病毒1型(porcine circovirus type 1,PCV1)、豬圓環病毒2型(PCV2)、豬繁殖與呼吸綜合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、豬瘟病毒(classical swine fever virus,CSFV)、豬細小病毒(porcine parvovirus,PPV)、豬博卡病毒(porcine boca virus,PBoV)均由北京農學院獸醫學(中醫藥)北京市重點實驗室保存。Pure Plasmid Mini Kit高純度質粒小提試劑盒(CW0548S,北京康為世紀生物科技有限公司);Pro Taq HS SYBR Green預混型qPCR試劑盒(AG11701, 湖南艾科瑞生物工程有限公司)。ABI step one plus型熒光定量PCR(ABI公司),4 ℃臺式冷凍離心機(Thermo公司),Nano Drop 2000分光光度計(Thermo公司)。
1.2 引物合成及標準品質粒的制備
根據GenBank中已公布的PCV2序列(NC_005148.1),由北京擎科生物科技有限公司合成,將目的基因片段645 bp插入PUC57載體,成功構建含有PCV2目的基因片段的PUC57-Cap重組克隆質粒,該質粒作為熒光定量PCR擴增的標準品質粒。根據該基因序列應用Primer 5.0軟件設計一對熒光定量PCR擴增引物,擴增引物序列Cap-F是5′-GAGGCGGGCGTTGAAGATGC-3′;Cap-R是5′-AGGAGGCGTTACCGAAGGAGAAG-3′。PCR擴增產物135 bp。該引物由北京擎科生物科技有限公司合成。
1.3 熒光定量PCR反應條件的優化
為了建立最適熒光定量PCR檢測方法,通過篩選引物濃度及退火溫度,提高檢測方法的效率。分別取0.2、0.3、0.4和0.5 μmol/L的上游引物、下游引物Cap-F、Cap-R 進行引物濃度的篩選,以105copies/μL的質粒作為模板,通過矩陣法進行熒光定量PCR試驗,從而篩選出最佳的引物濃度。進而通過已篩選出的最佳引物濃度,以5.0×105copies/μL的質粒作為擴增模板進行熒光定量PCR反應,調整退火溫度區間為63、64、65、66和67 ℃,篩選出最佳的退火溫度。
1.4 PCV2熒光定量PCR標準曲線的建立
通過Nano Drop 2000分光光度計測定標準品質粒的吸光度OD280 nm及OD260 nm,計算出重組質粒為5.0×1010copies/μL,連續10倍倍比稀釋,以108、107、106、105、104、103、102、101copies/μL這 8個不同濃度梯度的質粒作為模板進行熒光定量PCR檢測。反應體系為Pro Taq HS SYBR Green Mix(2×)10 μL,Cap-F 0.4 μL,Cap-R 0.4 μL,Rox 0.4 μL,模板 2 μL,ddH2O補足體系至20 μL。熒光定量PCR反應條件是95 ℃預變性30 s,95 ℃ 15 s,66 ℃ 30 s,采集熒光,40個循環。
1.5 PCV2熒光定量PCR檢測方法特異性分析
以PCV1、PRRSV、CSFV、PPV、PBoV的病毒DNA為對照組,以5.0×106copies/μL的標準品質粒為陽性對照,以無菌水為陰性對照,進行PCV2熒光定量PCR檢測方法的特異性檢測。
1.6 PCV2熒光定量PCR檢測方法重復性分析
選取105、104和103copies/μL的標準品質粒進行組間及組內的重復性試驗。不同濃度的標準品每組進行3個平行重復試驗為組內重復性試驗,分別進行3次重復為組間重復性試驗。每次所得熒光定量PCR的Ct值的平均值、標準差以及變異系數進行分析。
1.7 PCV2熒光定量PCR與普通PCR敏感性分析
將標準品質粒模板10倍倍比稀釋,用不同濃度梯度的標準品進行常規PCR擴增及熒光定量PCR擴增,分析兩種方法的最低檢出量,比較兩種方法的敏感性差異。
1.8 臨床樣本檢測
對已知臨床背景有PCV2發病史的豬場采集到的30份樣本,包括6份血液樣本和24份環境樣本進行PCV2流行病學調查。用已建立的熒光定量PCR方法進行檢測,同時與常規PCR檢測方法進行對比,分析差異。
2 結 果
2.1 熒光定量PCR反應體系的優化
采用矩陣法篩選出0.2、0.3、0.4和0.5 μmol/L中的最優濃度。Cap-F/Cap-R均為0.4 μmol/L時,對106copies/μL的標準品質粒進行熒光定量PCR擴增可獲得較小Ct值,且獲得的擴增曲線優于其他濃度,故而最終引物濃度選擇0.4 μmol/L,見圖1。
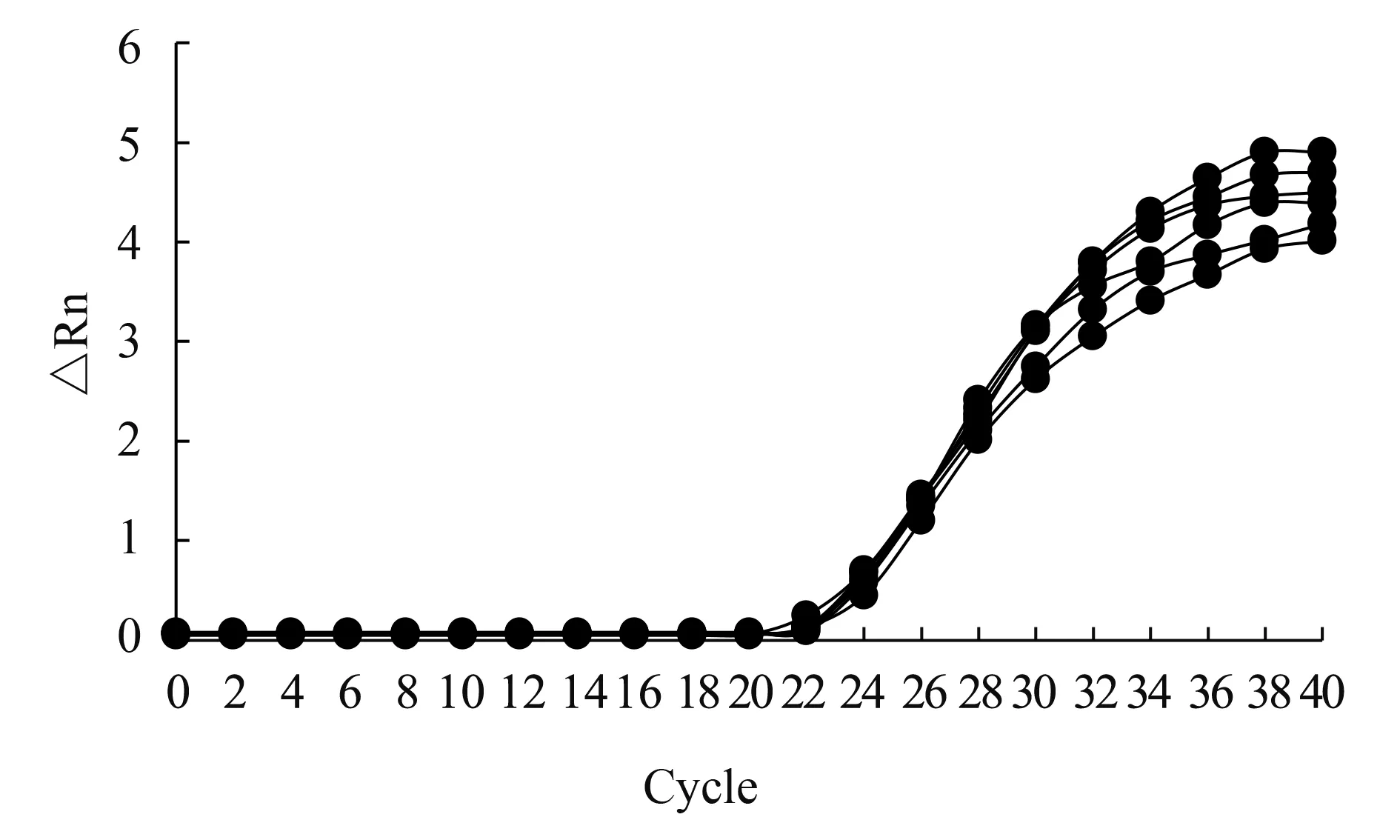
圖1 引物濃度優化結果Fig.1 The results of primer concentration optimization
熒光定量PCR擴增反應退火溫度優化結果見表1,在66 ℃時可獲得較小Ct值,因此確定最佳退火溫度為66 ℃。
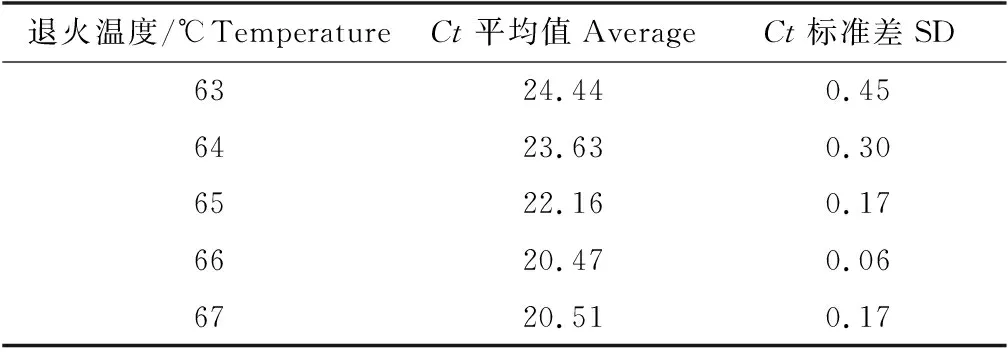
表1 退火溫度優化數據Tab.1 Annealing temperature optimization data
2.2 熒光定量PCR標準曲線的建立
熒光定量PCR標準曲線見圖2。所得線性方程Y=-3.137X+29.85,該檢測方法的擴增效率105.403%,反應的相關系數R2=0.999。在實時熒光定量PCR反應結束后,針對其溶解曲線進行分析,結果見圖3。擴增產物的熔解溫度是89.74 ℃,未出現由于引物二聚體及其他非特異性擴增產物等原因導致的其他峰值。該結果符合熒光定量PCR技術要求,可以用于PCV2的絕對定量分析。
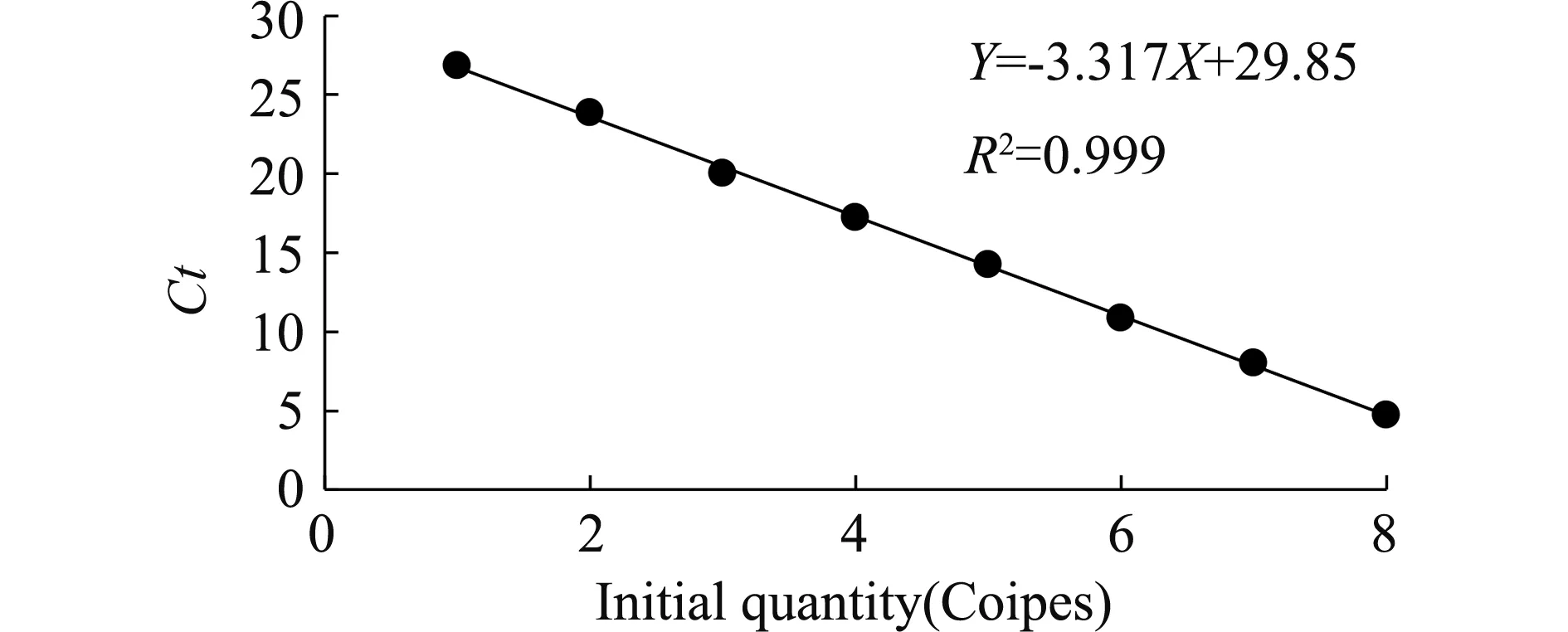
圖2 熒光定量PCR檢測方法的標準曲線Fig.2 Standard curve of real-time fluorescence quantitative PCR
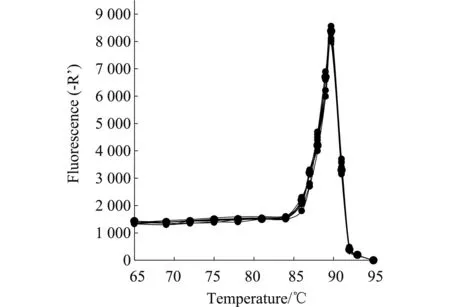
圖3 熒光定量PCR檢測方法的熔解曲線Fig.3 Melting curve of real-time fluorescence quantitative PCR
2.3 熒光定量PCR檢測方法的敏感性結果
檢測方法的敏感性是評估該檢測技術靈敏性的重要指標,故而針對常規PCR與實時熒光定量PCR兩種檢測方法的敏感性進行比較分析。將陽性標準品質粒10倍倍比稀釋,常規PCR擴增結果的最低檢出量5.0×104copies/μL(圖4),而實時熒光定量PCR檢測方法在5.0×101copies/μL時仍有擴增,說明實時熒光定量PCR檢測方法比常規PCR方法靈敏1 000倍。
2.4 熒光定量PCR檢測方法的特異性結果
根據已建立的實時熒光定量PCR檢測方法,對PCV1、PRRSV、豬CSFV、PPV、PBoV及PCV2病毒核酸進行檢測。只有PCV2在Ct值為20左右時出現S形曲線,而檢測的其他樣本均未擴增,判定結果為陰性,見圖5。該試驗建立的熒光定量PCR方法的特異性較強,未出現假陽性,可以用于后續臨床樣本分析。
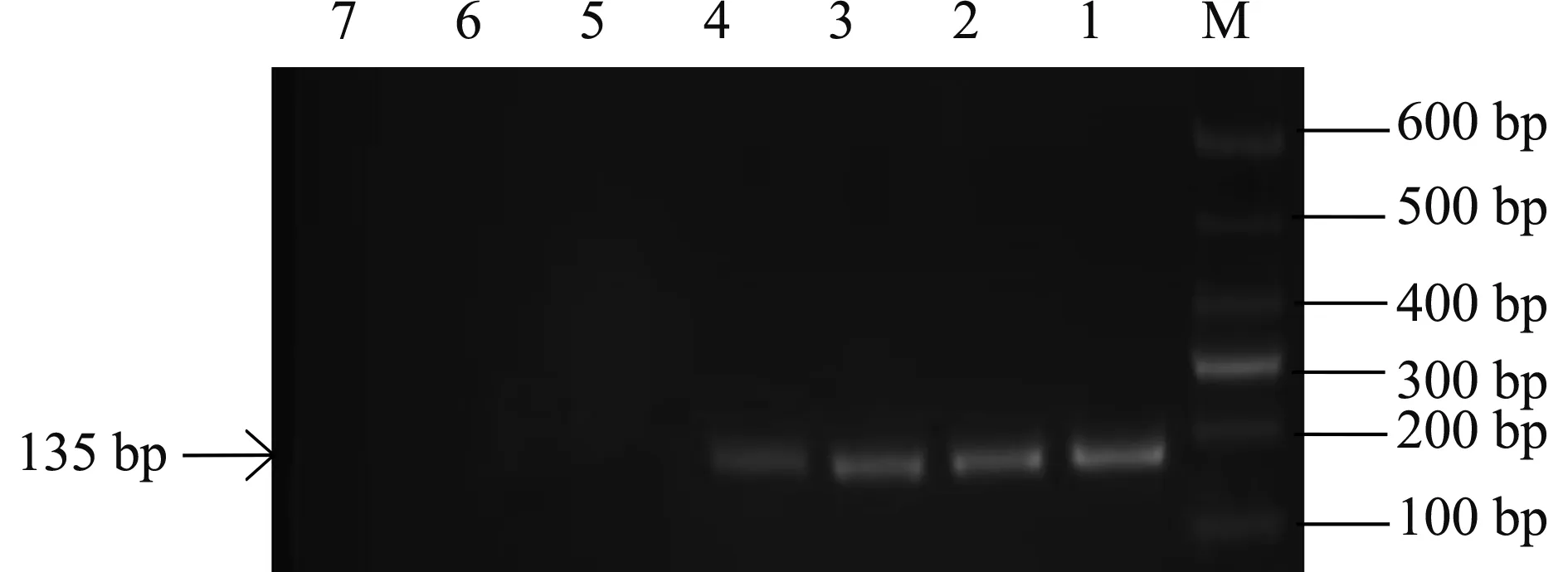
注:M是Maker;1是5.0×107 copies /μL;2是5.0×106 copies /μL;3是5.0×105 copies/μL;4是5.0×104copies/μL;5是5.0×103 copies/μL;6是5.0×102 copies/μL;7是5.0×101 copies/μL。Note: M is Marker; 1 is 5.0×107 copies/μL; 2 is 5.0×106 copies/μL; 3 is 5.0×105 copies/μL; 4 is 5.0×104 copies/μL; 5 is 5.0×103 copies/μL; 6 is 5.0×102 copies/μL; 7 is 5.0×101 copies/μL.圖4 常規PCR檢測結果Fig.4 PCR test results
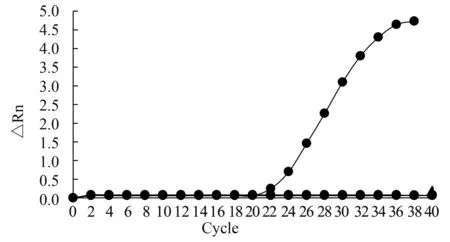
圖5 實時熒光定量PCR特異性結果Fig.5 Specific results of real-time fluorescence quantitative PCR
2.5 熒光定量PCR檢測方法的重復性分析
熒光定量PCR檢測方法的重復性試驗見表2。組內和組間變異系數均小于0.05。已建立的熒光定量PCR檢測方法具有較高的穩定性。
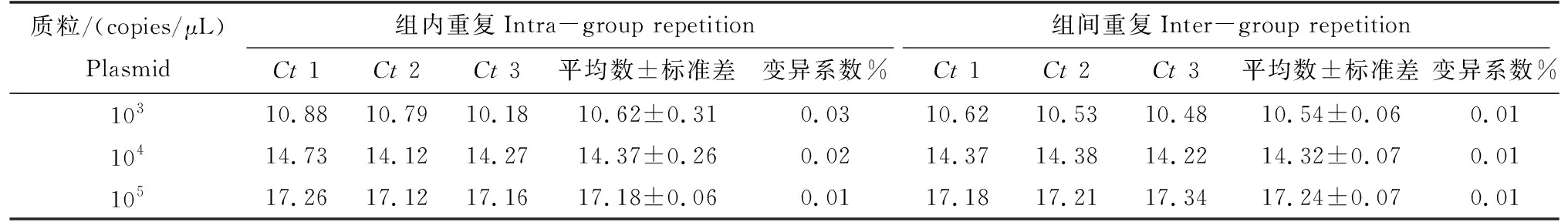
表2 實時熒光定量PCR重復性試驗Tab.2 Repeatability of real-time fluorescence quantitative PCR
2.6 臨床樣本檢測
根據該研究建立的熒光定量PCR檢測方法和常規PCR方法,對已知臨床背景有PCV2發病史的豬場采集到的30份樣本,包括6份血液樣本和24份環境樣本進行PCV2流行病學調查。常規PCR檢測結果10份樣本陽性,陽性率33.3%。熒光定量PCR檢測結果19份樣本陽性,陽性率63.3%,結果見表3。該研究所建立的熒光定量PCR檢測方法比常規PCR檢測方法的檢出率高出30.0%,說明該方法具有較好的靈敏性,并且可以實現定量分析樣本中的病毒載量,能夠適用于豬場內PCV2病毒的疫情檢測及疫病的篩查工作,為實驗室內檢測PCV2提供有效的技術支持。
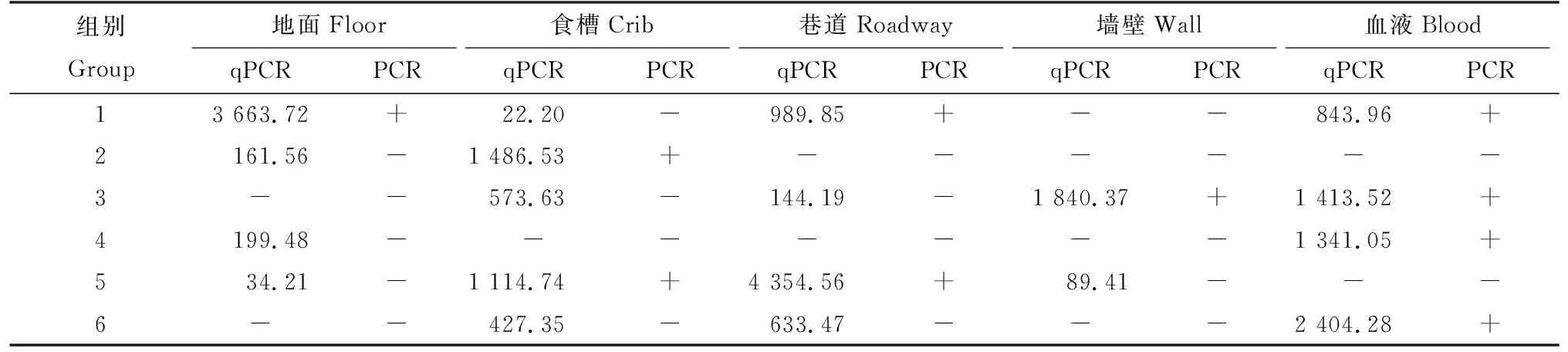
表3 臨床樣本檢測結果Tab.3 Test results of clinical samples
3 討 論
近幾年來,隨著養殖業的快速發展,大型規模化養豬場隨之增多,針對豬場的各類疫情防控尤為重要。目前PCV2早已在全球范圍內廣泛流行,給全球養豬業帶來不利影響,造成極其嚴重的經濟損失。建立一種操作簡便、快速有效的檢測豬圓環病毒2型病毒的方法,監測PCV2的傳播、流行及防控具有十分重要的意義。傳統病毒的分離檢測方法耗時較長,不能為臨床診斷提供較為快速準確的數據。常規PCR對反應條件要求較高,并且容易出現引物二聚體等副產物,大大影響試驗結果的準確性[8]。實時熒光定量PCR技術是由Applied Biosystems公司研發出的一種可用于定量檢測的技術,常用的有熒光染料SYBR Green和熒光標記Taqman探針,可實時定量監測反應過程中的產物擴增變化,靈敏性高,特異性強且能快速定量檢測出結果[9]。
該研究建立的熒光定量PCR檢測方法根據ORF2基因設計引物。ORF2位于PCV2病毒基因組的互補鏈上編碼具有高度免疫原性的Cap蛋白。Cap蛋白在PCV2病毒的致病性中起重要作用[10],有研究表明,Cap蛋白可以使感染PCV2的豬產生大量抗體,故而Cap蛋白成為檢測PCV2的重要抗原[11]。該研究根據SYBR Green染料法建立的熒光定量PCR檢測方法的標準曲線方程Y=-3.137X+29.85,R2為0.999,說明該試驗線性關系良好;擴增效率105.403%,說明該方法的擴增效率優異;熔解曲線在89.74 ℃時只出現了單峰,說明引物特異性強,沒有出現引物二聚體等副產物;該方法的組間及組內的變異系數均小于0.05%,說明具有良好的穩定性及重復性;該方法PCV2最低檢出量5.0×101copies/μL,比常規PCR檢測方法的靈敏度高1 000倍。將已建立的絕對定量熒光PCR檢測方法用于臨床樣本檢測,并且與常規PCR進行對比,常規PCR檢測30個樣本,其中10個樣本為陽性,絕對定量熒光PCR檢測30個樣本,其中19個樣本為陽性。絕對定量熒光PCR的檢出率明顯高于常規PCR,該試驗建立的檢測方法具有更強的靈敏性,為后續用于臨床檢測PCV2提供有效的技術支持。
石林等[12]根據ORF1設計引物,建立的PCV2 Taqman實時熒光定量PCR檢測方法的最低檢測值8.828×106copies/μL;于靜等[5]根據ORF2建立的SYBR染料熒光定量PCR檢測方法的最低檢測值1×102copies/μL;郭慧娟等[13]建立的Taqman熒光定量PCR檢測方法的最低檢出量4.53×102copies/μL。該研究建立的豬圓環病毒2型絕對定量PCR檢測方法為熒光定量PCR檢測豬圓環病毒2型方法的一個補充,靈敏度高于石林等[12]和于靜等[5]及郭慧娟等[13]的研究結果。相較于徐通等[14]建立的常規PCR方法,該試驗操作簡單、耗時較短、可定量檢測出病毒濃度,且不易產生氣溶膠污染等問題,有效降低了生物安全風險,同時可進行大批量樣本的快速檢測。可為臨床中感染發病及處于亞臨床狀態中的生豬進行早期診斷、疫病的篩查、探索PCV2的發病規律及其流行的特點,為PCV2的早期發現治療贏得時間,大大減少因PCV2爆發感染導致的豬場經濟損失。

