‘章姬’草莓莖尖脫毒及快繁技術研究
陳甘牛,苗 杰,陸兆軍,趙 瑩,孫曉慧,宋 黎,王世偉,喬艷輝,柴傳平
(1.煙臺市森林資源監測保護服務中心,山東煙臺264000;2.沂南縣國有林場總場,山東沂南276300;3.山東省林業科學研究院,山東濟南250014)
草莓(Fragaria×ananassa Duch.)是薔薇科草莓屬植物,植物學分類為多年生草本植物,果樹學分類為小漿果植物,是世界七大水果之一,素有“水果皇后”的美稱。‘章姬’草莓是日本靜岡縣農民育種家章弘先生于1992年選育的品種,為日本主栽品種之一,其特點是果實大,長圓形,味濃甜,畸形少,可溶性固形物含量9%~14%,豐產,休眠期淺,適宜鮮食和加工。1996年遼寧東港市草莓研究所引入試栽成功,2000年后在膠東地區大面積推廣栽培。
草莓適應性強,在全球分布廣泛。美、日、韓等發達國家早已根據本國市場需求建立了自己的草莓脫毒快繁體系,廣泛應用于生產實踐中,草莓產量和質量有了較大提高。我國草莓種苗生產方式一直沿用傳統的無性繁殖方式,品質退化嚴重,大面積感染病毒。目前國內感染病毒種類主要有4 種:斑駁病毒、皺縮病毒、輕型黃邊病毒和鑲脈病毒,這些病毒大部分為潛隱性病毒,含有病毒的草莓早期無明顯表現特征,不進行專業性的檢測無法分辨其是否存在病毒[1-2]。感染的病毒易造成復合感染,導致果實品質及產量下降,嚴重時可致草莓減產75%,田間無特效藥和有效防治手段[3]。已有的研究報道,許多學者認為莖尖培養與熱處理結合脫毒是草莓較好的脫毒方法,但脫毒效果與熱處理方式、莖尖的大小和草莓的品種密切相關[4]。本研究采用生長健壯的‘章姬’草莓為材料,通過熱處理脫毒后剝離莖尖,利用正交試驗設計方法,建立莖尖脫毒及快繁技術體系,為實現草莓脫毒苗的產業化發展提供技術支撐。
1 材料和方法
1.1 材料
試驗材料‘章姬’草莓由煙臺綠食農林科技草莓研究所苗圃提供。2019年3月初選取生長健壯、匍匐莖充實、無病蟲斑、具典型‘章姬’性狀的優良單株為試驗材料。
1.2 方法
1.2.1 外植體滅菌和無菌苗的建立
以草莓匍匐莖的莖尖端2~3 cm 為外植體材料,去除形態學末端。3%洗潔精溶液浸泡15 min,期間用毛刷輕微攪動,流水沖洗1~2 h,無菌水沖洗1~2 次,移入超凈工作臺。用75%酒精處理時間分別為30 s、60 s和90 s,用無菌水沖洗2~3 次后,再用2%次氯酸鈉處理時間分別為4 min、8 min 和12min,再用無菌水沖洗4~5 次后無菌吸水紙吸干表面水分,切取長度為0.8~1.0 cm 頂芽莖段接種到MS 培養基中。每個處理20 瓶,每瓶接種3 個莖段,3 個重復。培養7 d 后,剔除霉菌細菌污染苗,統計污染率,建立草莓無菌苗體系。
1.2.2 高溫處理
將草莓無菌苗置于工智能氣候箱中,參考聶園軍[5]的做法,采用逐步升溫的方式(每小時升溫1℃)對無菌苗進行高溫處理培養,起始溫度25 ℃,終止溫度38 ℃,分別處理28 d、38 d、48 d。人工氣候箱光照時間14 h,光照強度3000~5000 lx,相對濕度70%。每個處理20 瓶,每瓶接種2 棵無菌苗,3 個重復。28~48 d 后統計存活率。
1.2.3 病毒檢測
脫毒效果檢驗參考顧地周[6]電子顯微鏡檢測法,利用負染色法,對脫毒處理的葉片進行染色,再將染色的葉片制成60 nm 的超薄葉片,每棵成活苗取3 個葉片,在電子顯微鏡下觀察葉片中的病毒顆粒,如果沒有則證明已脫毒。
1.2.4 愈傷組織誘導
試驗按照正交設計L9(34),采用3 因素3 水平設計,共9 個組合。分別是培養基(MS、1/2MS 和white)、6-BA(0.5 mg·L-1、1 mg·L-1、1.5 mg·L-1)和IBA(0.25 mg·L-1、0.5 mg·L-1、0.75mg·L-1),將剝離高溫處理后成活苗的0.5~0.8 mm 莖尖接種,每個組合20 瓶,每瓶接種3 個莖尖。30d 后統計誘導率,并記錄愈傷組織生長情況。
1.2.5 不定芽誘導
把質地致密、顏色淡黃的愈傷組織接種到含不同濃度的6-BA 和IBA 的MS 培養基上,每個處理接種20 瓶,每瓶3 塊。定期觀察愈傷組織的再分化狀態,30 d 后統計不定芽誘導率。
1.2.6 生根培養
叢生芽高度2.5 cm 時,切成單株轉至生根培養基。基礎培養基選用1/2MS 培養基,NAA 濃度設0 mg·L-1、0.25 mg·L-1、0.5 mg·L-1、0.75 mg·L-14 個梯度,每個處理接種20 瓶,每瓶接種3 棵生根苗,28 d 后統計生根情況。
培養基中含蔗糖25 g·L-1、瓊脂粉8 g·L-1、pH 為5.8~6.2。將組培材料置于光照強度2000 lx,光照時間14 h·d-1,培養溫度(25±2) ℃的生化培養箱中培養[7]。
1.2.7 數據處理及分析
(1)污染率(%) = 污染外植體數/接種外植體總數×100%
(2)存活率(%) = 存活外植體數/接種外植總體數×100%
(3)脫毒率(%) = 脫除病毒的葉片數/檢測葉片數×100%
(4)愈傷組織誘導率(%) = 愈傷組織的外植體數/接種外植體數×100%
(5)不定芽誘導率(%) = 愈傷組織出芽數/接種愈傷組織總數×100%
(6)生根率(%) = 生根苗數/接種苗數×100%
2 結果與分析
2.1 不同消毒處理對外植體染菌率的影響
外植體無菌苗體系的建立是直接影響組織培養成敗的重要因素,單獨使用一種消毒劑,污染率較高,效果差[8]。本試驗采用75%酒精和2%次氯酸鈉聯合處理草莓外植體,消毒效果較好。
不同滅菌時間對外植體的影響由表1 看出,污染率隨著滅菌處理時間的延長而降低,75%酒精處理無莖段死亡現象,2%次氯酸鈉隨處理時間的延長,對外植體的損傷越大,主要表現為褐化嚴重、植株枯萎,消毒時間為12 min 時,編號3 和6 均死亡1 株、編號9 死亡2 株。編號9 即75% 酒精處理90 s、2%次氯酸鈉處理12 min,污染率最低0%,存活率93.33%,但是芽基部表面褐化,切口枯萎;編號8 即75%酒精處理90 s、2%次氯酸鈉處理8 min,污染率最低0%,存活率最高100%,莖段生長正常,無褐化枯萎現象發生。綜合分析試驗結果表明‘章姬’草莓最佳的滅菌處理為75%酒精90 s、2%次氯酸鈉8 min。
2.2 病毒檢測
用電子顯微鏡檢測法檢驗無菌苗存活率及脫毒率。由表2 可知,無菌苗在38℃恒溫條件下培養10 d后,植株生長開始減慢,培養28 d 后,葉片開始變黃,植株部分枯死。培養38 d 后,無菌苗成活率大大降低,脫毒率大幅提升,植株幾乎停止生長;培養48 d 后,成活率低至30.00%,脫毒率達最大值85.19%,存活的植株萎蔫,生長不良。因此在溫度一定的條件下,存活率隨培養時間的延長而降低,脫毒率則與培養時間成正比,培養時間越長,脫毒率越高。為取得更高的脫毒率,培養時間應越長越好,但是,成活率則相反,且植株長勢差,不利于后期的愈傷組織誘導。綜合存活率、脫毒率及植株生長情況的考慮,確定‘章姬’草莓38 ℃恒溫條件下培養時間38 d 為宜。
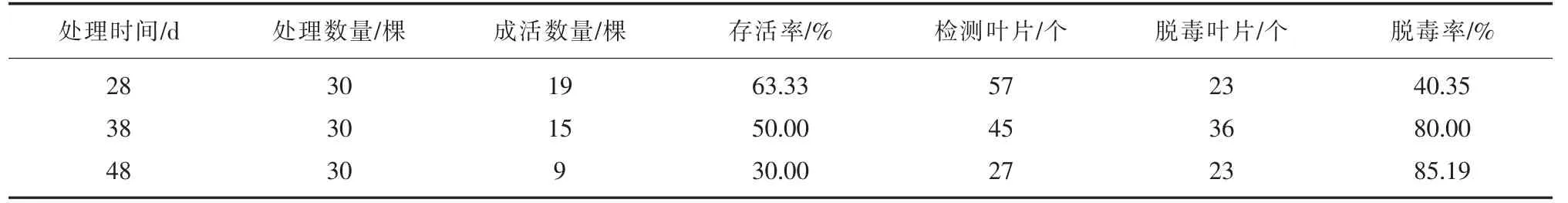
表2 38 ℃條件下不同處理時間對無菌苗存活率和脫毒率的影響
2.3 不同因素對愈傷組織誘導的影響
脫毒草莓莖尖接種到誘導培養基上7 d 左右,緊貼培養基莖尖切口處開始膨大,顏色變淡,14 d 后切口處膨大的愈傷組織顏色淡綠,30 d 后變為淡黃色、顆粒狀愈傷組織,體積增大。不同植物生長調節劑組合對草莓莖尖愈傷組織的產生和生長狀態影響不同。愈傷組織誘導率統計結果見表3。
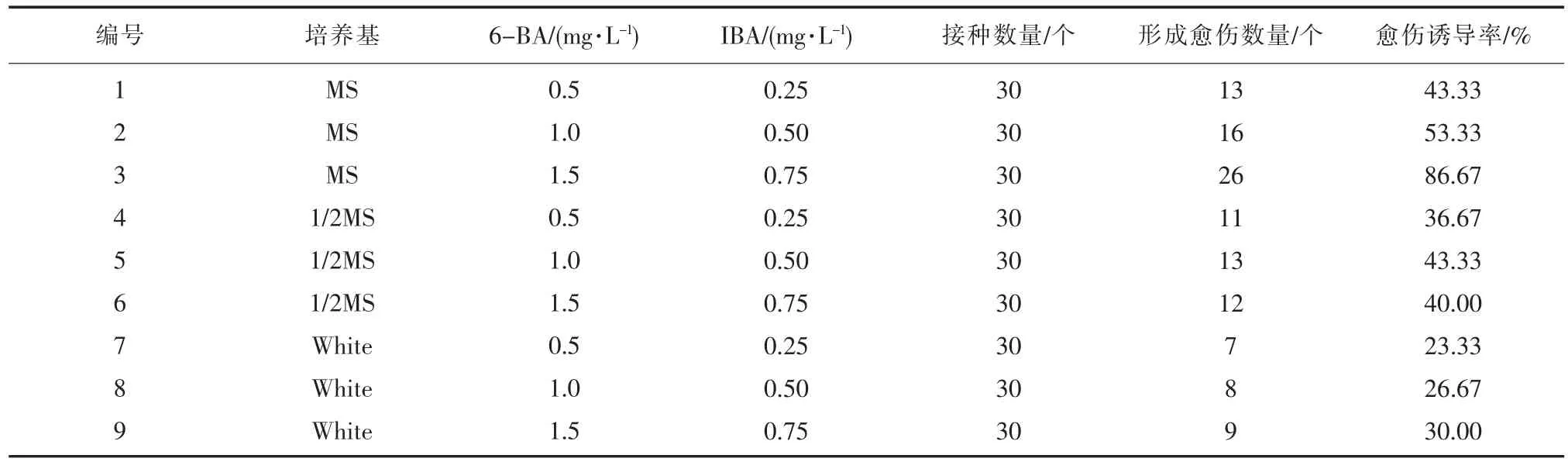
表3 不同因素對愈傷組織誘導的影響
激素濃度一定的情況下,MS、1/2MS、White 對愈傷組織的誘導率總體趨勢為MS>1/2MS>White。在MS 培養基愈傷組織的誘導率隨激素的增高而增大,其中,以編號3 誘導率最高,達86.67%。由此確定,‘章姬’草莓莖尖愈傷組織最佳誘導培養基為MS + 6BA1.5 mg·L-1+ IBA0.75 mg·L-1。
2.4 植物生長調節劑對不定芽誘導的影響
愈傷組織接種到不定芽誘導培養基上7 d,顏色由淡黃色轉為黃綠色,體積增大。14 d 時,愈傷組織突起明顯,出現綠色芽點。隨著時間的延長芽點數量增多,逐漸分化為芽叢,28 d 左右形成叢生芽,苗高2~3 cm,葉片2~3 片。
由表4 可知,培養基中無添加植物生長調節物質時,愈傷組織未見再分化。附加0.25 mg·L-1NAA 時,不定芽誘導率較低,僅3.33%,添加1.50 mg·L-16-BA 時,不定芽誘導率43.33%;隨著NAA 和6-BA 濃度的升高,不定芽誘導率都分別升高。
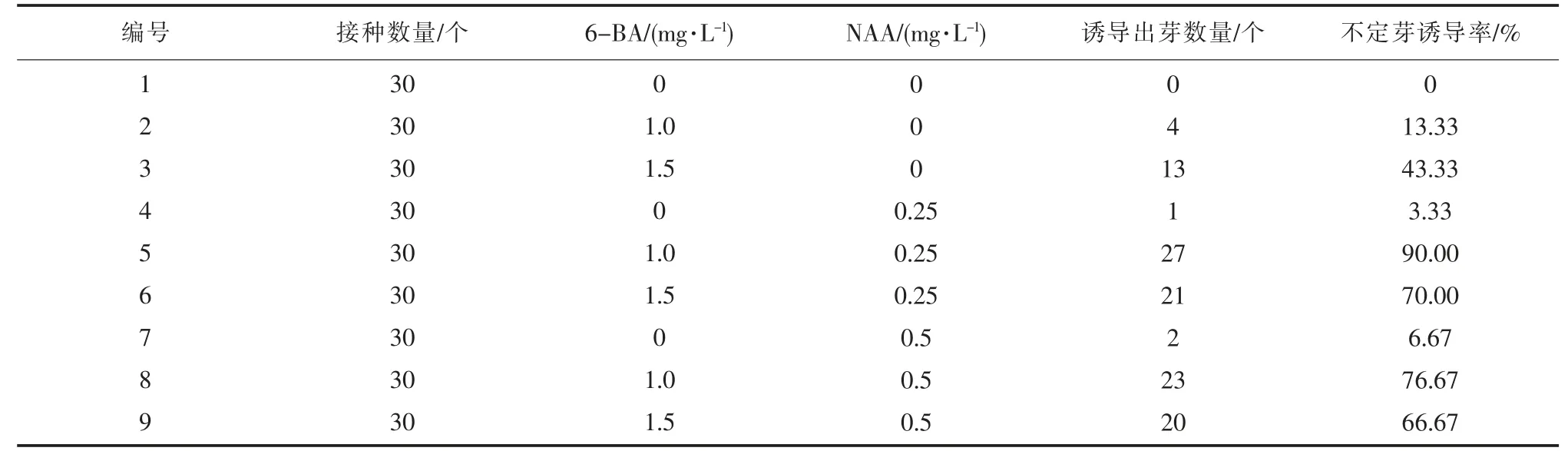
表4 不同植物生長調節物質對不定芽誘導率的影響
同時添加6-BA 與NAA,在NAA 濃度一定時,誘導率隨6-BA 濃度的遞增而呈拋物線狀變化,6-BA 濃度在1.0 mg·L-1時分化率達到最高,由此可見細胞分裂素與生長素配比使用更有利于再分化[9]。綜合試驗結果可知,適宜‘章姬’草莓不定芽誘導的培養基為MS + 6-BA1.0 mg·L-1+ NAA0.25 mg·L-1,不定芽誘導率最高90.00%,產生大量叢生芽。
2.5 IBA 對草莓生根的影響
把叢生芽切成單株接種到含有不同濃度IBA 的生根培養基中,15d 后部分小苗基部開始膨大,20 d 開始出現白色不定根,35 d 根長2~3 cm,發根數條,小苗長勢良好。
由表5 可知,在培養基中未添加IBA 時,小苗無生根現象,只看到莖段及葉片增大。當IBA 的濃度范圍為0.25~0.75 mg·L-1時,生根率明顯提高,IBA 濃度0.75 mg·L-1時,生根率最高93.33%;而IBA 濃度>1.0 mg·L-1時,生根率逐漸下降。由此得出‘章姬’草莓最佳生根培養基為1/2 MS + IBA 0.75 mg·L-1,主根明顯,植株生長健壯。

表5 不同濃度IBA 對草莓植株生根的影響
3 結論和討論
外植體消毒是快繁體系建立的重要環節,由于外植體來源于田間,不可避免的附有大量的病毒和細菌,因此,消毒劑的種類、濃度、消毒時間的選擇尤為重要。本試驗采用75%酒精消毒90 s,再用2%次氯酸鈉處理8 min,結果表明二者聯合比單獨使用消毒效果好,污染率0%,存活率100%。
莖尖培養是最常見的草莓組培快繁方法。利用莖尖的快速分生能力不僅能在組培條件下獲得大量的優質種苗,還可以結合脫毒技術生產脫毒種苗[10]。當前,草莓莖尖脫毒研究多集中在莖尖大小的選擇、生長調節劑的種類和劑量、高溫處理等方面。陳婕[11]采用熱-化結合處理(熱處理結合病毒醚處理)的方法獲得生根能力更強的優質脫毒草莓苗。莖尖脫毒通常莖尖長度越小越好,但是實際操作中,莖尖越小,脫毒率增高的同時,死亡率也隨之增加。筆者在長期的工作實踐中,發現0.5~0.8 mm 的莖尖長度適合愈傷組織誘導,還方便操作,因此,本研究采用38 ℃高溫處理后無毒的無菌苗,剝離0.5~0.8 mm 的莖尖進行培養,獲得了生長健壯的優質脫毒‘章姬’草莓苗。
在愈傷組織誘導中,不同植物對各類營養成分的需求也有差異[12]。本試驗選用了3 種(MS、1/2 MS 和white)基本培養基,附加不同濃度的6-BA 和IBA,采用正交試驗,發現適宜草莓愈傷組織誘導的基本培養基為MS,可能是MS 培養基中鉀鹽、銨鹽、硝酸鹽等無機鹽更適宜草莓莖尖誘導形成愈傷組織,其誘導率主要受到6-BA 濃度的影響,在一定范圍內,誘導率隨6-BA 濃度的升高而升高,誘導的愈傷組織在再分化過程中更容易分化成苗。最適愈傷組織誘導的培養基配比MS+6BA1.5 mg·L-1+IBA0.75 mg·L-1,誘導率86.67%。
植物所需生長調節物質的種類和濃度,在不同培養階段是不同的,二者以適宜濃度配比使用,有利于形成完整植株,濃度過高或過低,會影響再生植株發生及長勢[13]。本研究發現,草莓愈傷組織再分化過程中細胞分裂素和生長素聯合使用更利于愈傷組織再分化,較高濃度的6-BA 與適宜濃度IBA 也有助于草莓愈傷組織再分化,但IBA 濃度過高對再分化不利。因此最適宜不定芽誘導的培養基配比MS + 6-BA1.0 mg·L-1+NAA0.25 mg·L-1,不定芽誘導率達90%。本試驗建立的‘章姬’草莓莖尖脫毒快繁體系對其他品種草莓的脫毒和工廠化育苗具有一定的參考意義。

