不同品牌校準品對血清堿性磷酸酶檢測結果可比性的影響
林斐然,歐元祝,劉文彬,虞嘯炫,葛丹紅,趙 冉
(上海市臨床檢驗中心,上海 200126)
堿性磷酸酶(alkaline phosphatase,ALP)水平是診斷和鑒別診斷骨骼、肝膽系統(tǒng)疾病的常用指標,其檢測結果的準確性對疾病診斷和預后管理至關重要。國家衛(wèi)生健康委臨床檢驗中心正確度驗證計劃和上海市臨床檢驗中心正確度驗證計劃結果均顯示,ALP正確度驗證計劃合格率一直較其他酶學項目低[1]。
國際臨床化學和檢驗醫(yī)學聯(lián)合會于2011年正式公布了ALP酶學國際參考方法[2]。基于參考測量程序,體外診斷試劑廠商可通過連續(xù)溯源鏈賦值,將測量結果準確傳遞給校準品。但是,傳遞過程中偏差的引入和校準品中的化學物質都有可能影響各檢測系統(tǒng)檢測結果的準確性和不同檢測系統(tǒng)檢測結果的可比性。本實驗室以AU校準品、C.f.a.s.校準品、ALP國家二級標準物質[GBW(E)090920 ALP血清(液體)標準物質,簡稱標準物質]作為校準品,通過對比、分析使用不同校準品校準后的ALP檢測結果,為進一步開展血清ALP檢測標準化工作和臨床檢驗結果互認提供參考。
1 材料和方法
1.1 樣本來源
收集上海交通大學醫(yī)學院附屬仁濟醫(yī)院新鮮血清樣本25例,覆蓋低、中、高濃度;另收集2018年第2次上海市臨床檢驗中心5個濃度水平常規(guī)化學室間質量評價樣本。
1.2 儀器與試劑
美國貝克曼庫爾特公司AU5800全自動生化分析儀(簡稱AU5800)及配套試劑(批號5728)、校準品(批號1120,溯源性Beckman Master Calibrator,凍干粉),瑞士羅氏公司cobas c501全自動生化分析儀(簡稱c501)及配套試劑(批號337631)、校準品[批號25013301,溯源性Original formulation IFCC5(1983),凍干粉]。ALP國家二級標準物質GBW(E)090920[標準值222.6 U/L,擴展不確定度(k=2)為5.6 U/L;溯源性Original formulation IFCC9(2011);冰凍人血清]。
1.3 方法
使用c501配套C.f.a.s.校準品和標準物質對c501的ALP項目進行校準,分別為羅氏配套系統(tǒng)和標準物質-c501系統(tǒng);使用AU5800配套校準品和標準物質對AU5800上的ALP項目進行校準,分別為AU5800配套系統(tǒng)和標準物質-AU5800系統(tǒng);見表1。校準通過后,檢測25例新鮮血清樣本和5個濃度水平室間質量評價樣本,每個樣本測定2次,計算均值。以標準物質校準后的檢測值為參比系統(tǒng),采用Excel軟件分別計算c501配套系統(tǒng)與標準物質-c501系統(tǒng)檢測結果均值之間的相對偏移、相關性和AU5800配套系統(tǒng)與標準物質-AU5800系統(tǒng)檢測結果均值之間的相對偏移和相關性。以樣本序號為X軸,相對偏移為Y軸,繪制散點圖。

表1 檢測系統(tǒng)具體情況
使用標準物質、C.f.a.s.校準品、AU校準品分別對2臺儀器的ALP項目進行校準。校準通過后檢測25例新鮮血清樣本及5個濃度水平室間質量評價樣本,每個樣本測定2次,計算均值。以c501檢測值為參比系統(tǒng),用Excel軟件計算2臺儀器檢測值之間的相對偏移、相關性(標準物質-c501系統(tǒng)與標準物質-AU5800系統(tǒng)、c501配套系統(tǒng)與C.f.a.s.-AU5800系統(tǒng)、AU校準品-c501系統(tǒng)與AU5800配套系統(tǒng)、c501配套系統(tǒng)與AU5800配套系統(tǒng)),以樣本序號為X軸,相對偏移為Y軸,繪制散點圖。
2 結果
2.1 不同系統(tǒng)檢測結果
c501配套系統(tǒng)與標準物質-c501系統(tǒng)、AU5800配套系統(tǒng)與標準物質-AU5800系統(tǒng)的相關性良好(r值)均>0.999。兩兩系統(tǒng)間偏移均<10%,c501配套系統(tǒng)與標準物質-c501系統(tǒng)比較均為負偏移,AU5800配套系統(tǒng)與標準物質-AU5800系統(tǒng)比較均為正偏移,室間質量評價樣本與臨床血清樣本的相對偏移均無明顯差異。見表2、圖1。
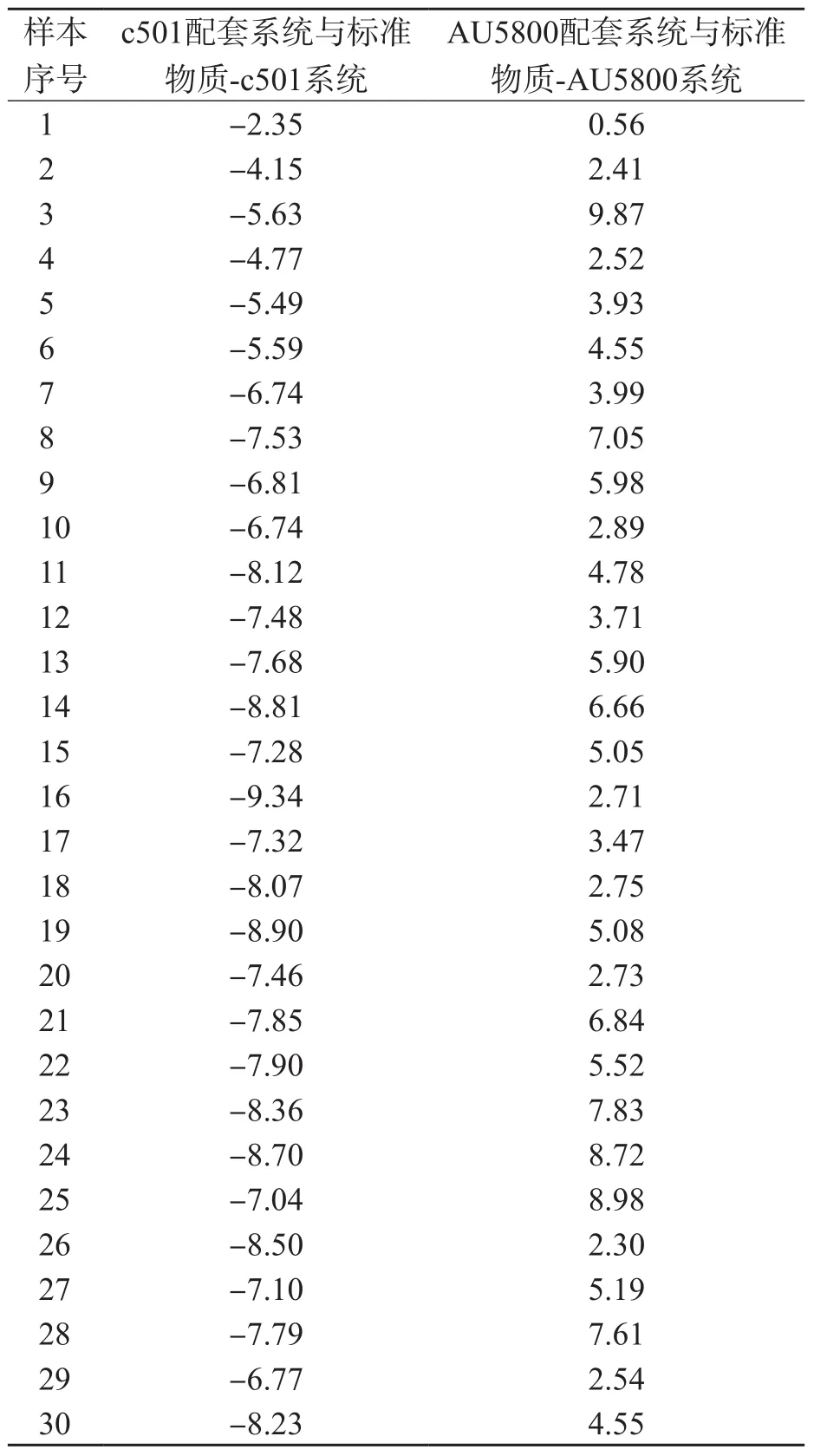
表2 各配套系統(tǒng)與以標準物質為校準品的檢測系統(tǒng)ALP檢測結果的相對偏移 %
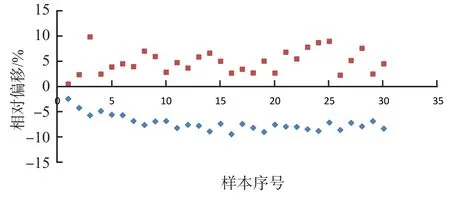
圖1 各配套系統(tǒng)與以標準物質為校準品的檢測系統(tǒng)的相對偏移分布
2.2 不同標準物質校準后2臺儀器檢測結果
使用標準物質、C.f.a.s.校準品、AU校準品分別校準c501和AU5800,2個系統(tǒng)之間ALP檢測結果相關性良好(r值均>0.999)。使用標準物質校準后,2個系統(tǒng)臨床血清樣本檢測結果的相對偏移在±4%以內,而室間質量評價樣本檢測結果的相對偏移為9%~16%。使用C.f.a.s.校準品校準后,檢測臨床樣本時,2個系統(tǒng)臨床血清樣本檢測結果的相對偏移為負偏移(18%~25%),室間質量評價樣本檢測結果的相對偏移為負偏移(7%~10%)。使用AU校準品校準后,檢測臨床樣本時,2個系統(tǒng)臨床血清樣本檢測結果的相對偏移為負偏移(-22%~-14%),室間質量評價樣本檢測結果的相對偏移為負偏移,縮至-10%~-4%。使用配套校準品校準后,檢測臨床樣本時,2個系統(tǒng)偏移為正偏移(3%~17%),檢測室間質量評價樣本時,增至25%~31%。見表3、圖2。
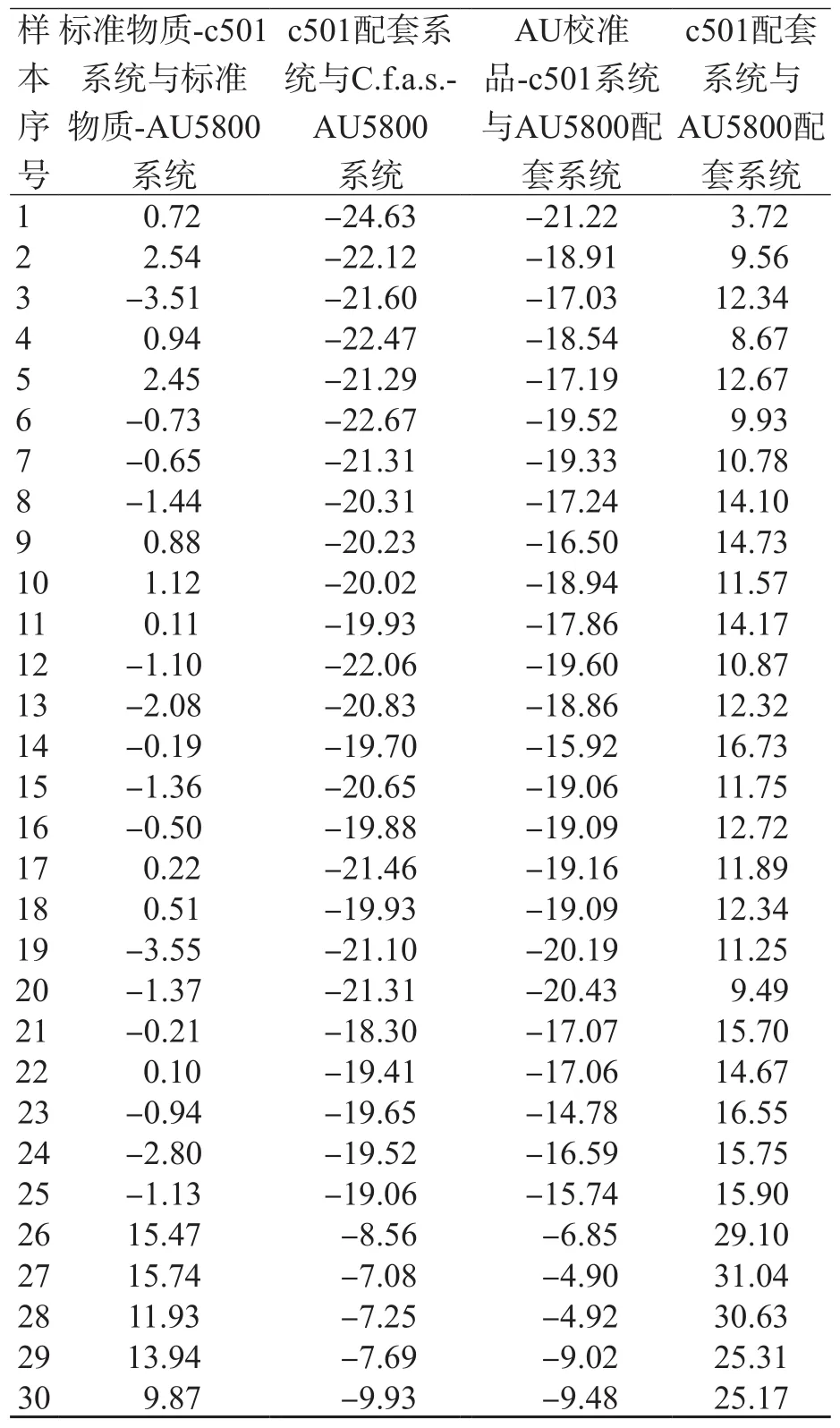
表3 不同校準品校準的檢測系統(tǒng)間ALP檢測結果的相對偏移 %
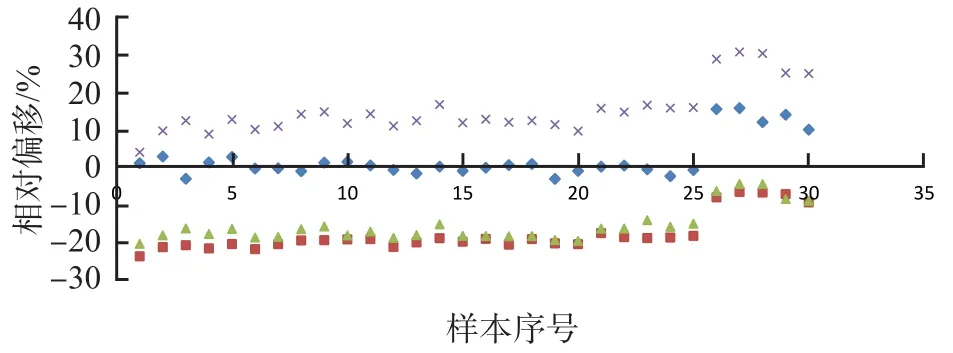
圖2 不同校準品校準的檢測系統(tǒng)間偏移分布圖
3 討論
在不同ALP檢測系統(tǒng)之間,影響檢測結果的主要因素是緩沖液種類和試劑配方[3]。目前,商品化ALP試劑品牌較多,統(tǒng)計近幾年上海市臨床檢驗中心和國家衛(wèi)生健康委臨床檢驗中心室間質量評價上報的ALP試劑信息和檢測方法,以及不同品牌的ALP試劑說明書,發(fā)現(xiàn)國內90%以上,上海100%都是基于國際臨床化學和檢驗醫(yī)學聯(lián)合會推薦的方法,使用2-氨基-2-甲基-1-丙醇緩沖液。進一步分析上海市臨床檢驗中心ALP室間質量評價和正確度驗證統(tǒng)計結果,截至2020年,均值差異最大且呈規(guī)律性差異的主要為瑞士羅氏公司試劑和美國貝克曼庫爾特公司試劑。體外診斷試劑檢測系統(tǒng)準確性需通過校準品的不間斷比較鏈進行量值傳遞。校準品量值傳遞的有效性、可靠性是廠商保證其檢測結果準確、可追溯的重要工具[4]。基于臨床實驗室ALP試劑使用情況,從校準品角度出發(fā),本研究選取了具有代表性的AU5800系統(tǒng)配套校準品、c501系統(tǒng)配套C.f.a.s.校準品和標準物質,通過分析不同品牌、基質校準品對臨床血清樣本和室間質量評價樣本ALP檢測結果可比性影響,為進一步開展血清ALP檢測標準化工作和臨床結果互認提供參考。
本研究結果顯示,檢測臨床血清樣本時,使用各檢測系統(tǒng)配套校準品校準,與使用標準物質校準結果相比較,c501配套系統(tǒng)呈負偏移,AU5800配套系統(tǒng)呈正偏移,與國家衛(wèi)生健康委臨床檢驗中心正確度驗證結果和意大利的一項研究結果一致[1,5]。標準物質是溯源到2011年ALP酶學參考方法,已知2011的ALP推薦程序與1983年Tietz方法(30 ℃)[6]相比,改變了2-氨基-2-甲基-1-丙醇濃度和測量溫度(從30 ℃到37 ℃)。本研究所使用的C.f.a.s.校準品是溯源至1983年的方法,美國貝克曼庫爾特公司宣稱AU校準品可溯源至Master校準物,可追溯性尚不明確,這可能是導致2個系統(tǒng)檢測結果偏移的主要原因,目前瑞士羅氏公司已逐漸將中國市場的校準品溯源調整至國際臨床化學和檢驗醫(yī)學聯(lián)合會(37 ℃)的方法。本研究發(fā)現(xiàn),使用標準物質校準與使用配套校準品校準相比,c501和AU5800 ALP血清樣本檢測值相對偏移由約15%降至±4%。而2臺生化分析儀即使使用相同廠商校準品,相對偏移依然不能縮小,且超過了使用各自配套系統(tǒng)校準品校準后的相對偏移。使用C.f.a.s.校準品校準后,AU5800檢測值較c501檢測值更低,而使用AU校準品校準后,c501檢測值較AU5800檢測值更高,使得配套系統(tǒng)校準品校準時為正偏移,而2臺儀器使用相同廠商校準品校準時,卻均為負偏移。校準品只能專用于指定型號儀器、試劑、方法和檢測程序組成的檢測系統(tǒng),才能發(fā)揮其校準和溯源作用[7]。可見,使用非配套校準品會為檢測結果引入更大偏差,無法互通。羅氏公司和貝克曼庫爾特公司試劑采用的都是國際臨床化學和檢驗醫(yī)學檢測值聯(lián)合會推薦的方法,以2-氨基-2-甲基-1-丙醇作為緩沖液。雖然成分用量略有不同,但是使用具有互換性的標準物質校準后,2個檢測系統(tǒng)檢測結果的偏移是可以被明顯縮小的。有文獻指出,為了使校準品能更穩(wěn)定,實驗室進行了更多前處理,以去除更多血清中的成分,這樣的參考物質與患者新鮮血清樣本的互換性產生了嚴重問題[8]。本研究2個品牌的校準品雖然也是人血清基質,但附加了化學添加物及非人類來源相關酶,存在基質效應,無法用于非配套檢測系統(tǒng)。而標準物質為冰凍人血清,減少了雜物引入,降低了校準品傳遞過程中基質效應的影響,且通過了互換性評價,使得2個檢測系統(tǒng)檢測結果偏移縮小,更有利于各檢測系統(tǒng)和實驗室間檢測結果一致性和可比性。
本研究結果顯示,室間質量評價樣本檢測結果與臨床血清樣本比較,呈現(xiàn)出一些不同,使用配套系統(tǒng)校準與標準物質校準后的偏移結果同檢測血清樣本結果基本保持一致;但使用配套校準品分別校準后,相對偏移幾乎是校準純血清時的2倍,使用標準物質校準后,相對偏移有所縮小,但仍比校準純血清時偏移要大,有基質效應的室間質量評價樣本放大了2個系統(tǒng)間的相對偏移,也說明只有具有互換性的室間質量評價樣本才能真實反映檢測系統(tǒng)間的差異。而使用非配套校準品同時校準2臺儀器后,相對偏移反而縮小到10%以內,可能是因為校準品和室間質量評價樣本同為處理過的血清物質,均為凍干品,基質效應的影響反而有所縮減。提示有基質效應的室間質量評價樣本并不能完全展示各系統(tǒng)的真實檢測結果,有可能會放大或縮小系統(tǒng)間差異。
綜上所述,血清ALP檢測標準化以及臨床結果互認工作任重而道遠。人血清ALP測定的常規(guī)程序中主要使用的是2-氨基-2-甲基-1-丙醇和二乙醇胺[9]。近幾年,國家衛(wèi)生健康委臨床檢驗中心和上海市臨床檢驗中心上報的試劑信息統(tǒng)計結果顯示,我國臨床實驗室采用的ALP檢測方法基本統(tǒng)一,都是基于國際臨床化學和檢驗醫(yī)學聯(lián)合會推薦的方法,緩沖液為2-氨基-2-甲基-1-丙醇。雖然國際臨床化學和檢驗醫(yī)學聯(lián)合會于2011年正式公布了ALP酶學國際參考方法,但2個品牌ALP檢測試劑并沒有及時更新為新的國際參考方法。此外,使用具有溯源性和互換性的血清參考物質作為校準品,能大大提高不同檢測系統(tǒng)間檢測結果的準確性和可比性,有利于不同實驗室間檢測結果的標準化和一致性。而多數(shù)商品化校準品存在基質效應,未經互換性評價,僅服務于指定配套檢測系統(tǒng),無法互通。由于缺乏可交換性,使用通用物質進行校準,并不會促成檢測結果的一致性[10]。試圖通過使用同一品牌校準品校準未經驗證的不同檢測系統(tǒng),而達到不同檢測系統(tǒng)間結果一致性的方法不可取。臨床實驗室在日常工作中,應盡可能選用經驗證、有溯源性的配套校準品,建立實驗室的參考區(qū)間,以保證檢測結果的準確、可靠。臨床實驗室作為檢測系統(tǒng)的終端用戶,必須確保其使用的校準品可追溯到最高水平[9]。使用無基質效應血清樣本的正確度驗證計劃與使用含有基質效應的室間質量評價可以更準確地反應不同系統(tǒng)間檢測結果的差異。為了提高ALP檢測結果的準確性和可比性,還需要試劑廠商、臨床實驗室和各級臨床檢驗中心的共同努力。

