低溫脅迫對玉米生理生化指標的影響
郭 揚
低溫脅迫對玉米生理生化指標的影響
郭揚
(濰坊工商職業(yè)學院山東濰坊262200)
文章以敏感型玉米品系先玉330及抗性品系先玉335為實驗材料,經低溫處理后,探究不同品系玉米生理生化的變化。實驗發(fā)現(xiàn):低溫脅迫下玉米膜脂受損,導致細胞膜透性明顯增大;由于膜脂過氧化,丙二醛的含量也明顯升高;光合作用相關的數(shù)據(jù)指標明顯呈現(xiàn)下降趨勢,造成玉米干物質的積累量下降;為了清除自身多余的活性氧,超氧化物歧化酶和過氧化氫酶的含量明顯升高,提高了玉米對低溫脅迫的抗性。通過了解玉米在低溫脅迫下的生理活性變化,以期為玉米的高效抗逆品系的選育提供理論基礎。
玉米;低溫冷害;低溫脅迫;生理調節(jié);調節(jié)機制
低溫冷害是目前限制我國農業(yè)產業(yè)發(fā)展的主要環(huán)境因素之一,特別是春季時節(jié)的倒春寒、秋季霜凍等,對我國作物苗期生長及秋季收獲期的產量產生了巨大的影響[1]。有研究表明,低溫脅迫影響玉米的光合作用、呼吸作用、水分和營養(yǎng)的吸收和運輸?shù)雀鞣N生理過程。低溫脅迫下,植物細胞膜流動性減弱,細胞液及離子的轉運進出細胞受到抑制,因此保衛(wèi)細胞中水分缺失,造成氣孔阻力增大,導致氣孔部分甚至完全關閉,影響二氧化碳的吸收。此外,植物體內進行的眾多生理生化反應,均需要酶的參與,低溫導致酶的催化活性降低,減緩了植物生化反應[2]。
滲透調節(jié)是抵御低溫脅迫的重要方式。在寒冷條件下,植物體內如可溶性糖、脯氨酸及部分離子等外泄,造成細胞滲透勢降低,而在高抗品種中細胞內容物外泄程度低于敏感品系[3]。研究發(fā)現(xiàn)滲透調節(jié)是植物抗寒的重要機制,寒冷條件下細胞液濃度下降,導致保衛(wèi)細胞滲透壓下降,氣孔關閉;當保衛(wèi)細胞中Ca2+、K+等離子濃度增大時,可以增強保衛(wèi)細胞的滲透調節(jié)能力,保障二氧化碳的正常吸收,維持正常的光合作用。因此,離子、可溶性糖等的含量變化對維持細胞的滲透調節(jié)能力有著重要的作用。
植物在低溫脅迫下的膜脂過氧化損傷和細胞膜透性的增大是低溫對植物的另一傷害途徑[4]。低溫脅迫條件下,植物體內細胞膜的成分磷脂發(fā)生過氧化反應,產生具有強氧化性的脂質過氧化物和丙二醛(MDA)。生物膜損傷程度可以通過葉片電導值來檢測,電導值越大代表細胞膜損傷越嚴重。細胞膜的穩(wěn)定性實際上也反映了玉米不同品種的抗寒性,可以作為選育優(yōu)良抗逆性品系的一項生理指標。在低溫脅迫下,對不同玉米品種進行電導值的測定,電導值的范圍為25%~80%[5]。所以,清除細胞中的氧自由基是植物在低溫下的重要自我保護機制。植物體內氧自由基的清除,主要依靠保護酶,包含超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)等,在清除生物體內自由基方面具有重要作用。有研究選用15個抗性不同的玉米作為實驗材料,在三葉期進行低溫處理24 h之后,檢測發(fā)現(xiàn)CAT活性和SOD活性與玉米的抗性正相關,損傷嚴重的玉米品種中酶的活性明顯低于損傷較低的玉米品種中酶的活性[6]。研究發(fā)現(xiàn),POD能夠清除植物體內多余的過氧化氫,抑制過氧化氫進一步反應生成有毒害作用的氧自由基。另有研究發(fā)現(xiàn),POD在不同的植物中參與低溫脅迫應答的程度不同,在部分植物中POD只在幼苗期參與植物的低溫脅迫的應答[7]。
綜上所述,低溫已經成為世界性的限制各國農業(yè)發(fā)展的環(huán)境問題,前期關于低溫脅迫下玉米的抗逆性研究已經有部分成果,特別是在形態(tài)指標到生理生化指標等方面獲得了十分重要的結論,但是得到的結果大都不能統(tǒng)一,結論差異性較大。因此,本研究以兩個玉米品種為研究對象,設置低溫冷害和凍害,研究在低溫脅迫下,玉米苗期的生理生化指標如滲透調節(jié)物質、保護酶活性及光合作用等的變化,以期為玉米優(yōu)良性狀的選育提供理論基礎。
1 材料與方法
1.1 實驗材料
本實驗按照前期萌發(fā)實驗選擇敏感型和耐冷型的2個玉米品種先玉330和先玉335。
1.2 實驗材料處理
將玉米種子經75%的酒精消毒后,用無菌水沖洗表面多余的酒精;將營養(yǎng)土混合少量蛭石的混合土壤滅菌,用于玉米幼苗的培養(yǎng)。
種期接種:將育苗基質按草炭土∶田間土∶河沙=2∶2∶1的體積比混合均勻,澆透水,將消毒后的種子均勻點種于基質上,于25 ℃溫度條件,16 h/8 h(光/暗)光周期,光強120 μmol/(m2·s)~400 μmol/(m2·s)下培養(yǎng)。
苗期接種:將生長4周(三葉一心)、生長狀態(tài)一致的幼苗移栽至含滅菌河沙的小盆中(直徑×高=11.5 cm×8 cm),每2 d噴施一次Hoagland營養(yǎng)液。
低溫脅迫處理:玉米長到三葉一心時,在人工智能型培養(yǎng)箱(RXZ-0450)中進行培養(yǎng),低溫冷害(8 ℃)和凍害(0 ℃)處理,第1 d、2 d取樣進行相關指標的測定。
1.3 指標測定方法
1.3.1 細胞膜透性的測定
取玉米同一位置的葉片,滅菌水洗凈,用打孔器打取小圓片(避開大葉脈)。取適量小圓片于試管中,加入10 mL去離子水。將試管放入真空干燥器內抽氣10 min,取出試管,間隔幾分鐘振蕩1次。在室溫(25 ℃)下保持30 min,用DDSJ-308A型電導儀測定外滲液的電導值。將試管放入沸水中水浴10 min,冷卻至室溫后,再測定電導值。細胞膜相對透性以兩次電導值的百分比表示。
1.3.2 葉綠素含量的測定
隨機選取符合實驗要求的葉片,插入到SPAD-502葉綠素儀測量其葉綠素含量。
1.3.3 MDA含量的測定
取玉米同一位置的葉片,用10%三氯乙酸(TCA)提取MDA,離心取上清液,加入0.6%硫代巴比妥酸(TBA),沸水浴15 min,迅速冷卻,利用比色法測定MDA含量。
1.3.4 SOD活性的測定
測定SOD的活性采用氯化硝基四氮唑藍光化還原法,其原理是SOD能夠抑制氮藍四唑(NBT)在光下的還原作用。在氧化物質存在的條件下,核黃素被光還原,在有氧的條件下易再氧化產生O2-,可以將氮藍四唑還原為藍色的甲腙,并且在560 nm處有最大的吸光度,而SOD能夠清除O2-,從而抑制甲腙的形成,通過反應體系中藍色的變化,可以計算SOD活性的大小。測定方法參考湯紹虎等[8](2012)。
1.3.5 CAT活性的測定
測定CAT的活性采用高錳酸鉀滴定法,其原理是CAT能夠催化H2O2分解為H2O2和O2,可以根據(jù)H2O2的消耗量以及O2的生成量測定CAT活力的大小。H2O2在240 nm波長下有一定的吸光值,可以根據(jù)吸光值的變化速度計算CAT的活性,測定方法參考湯紹虎等[8](2012)。
2 結果與分析
2.1 低溫脅迫對玉米幼苗細胞膜透性的影響
由圖1可知,0 ℃處理下的兩個玉米品種葉片的細胞膜透性均大于8 ℃和25 ℃處理,說明溫度越低,對細胞膜的傷害越大,電導物質滲出增多。8 ℃處理對細胞膜通透性的影響程度不及0 ℃低溫處理,仍可以看出冷害的作用,并且耐冷型品種的細胞膜透性明顯低于敏感型品種。
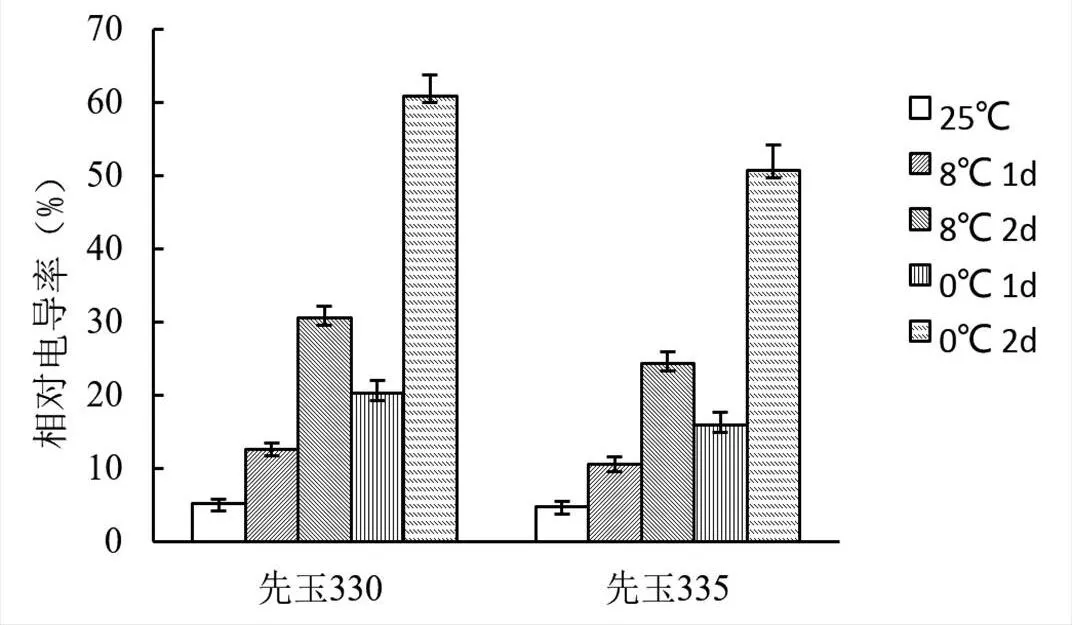
圖1 低溫脅迫對不同玉米品種細胞膜透性的影響
2.2 低溫脅迫對玉米幼苗光合作用的影響
由表1可以看出,在正常培養(yǎng)條件下不同玉米品種的光合指標不同。低溫處理后,敏感品系先玉330和抗性品系先玉335的光合作用相關指標都有相應程度的下降,特別是0 ℃處理2 d之后,兩個品系的光合速率都有明顯的下降,但是抗性品系的下降程度明顯低于敏感品系,氣孔導度、細胞間二氧化碳濃度和葉綠素含量也都有相應的下降。
表1低溫脅迫對玉米葉片光合指標的影響
處理蒸騰速率(E)光合速率(A)氣孔導度(G)胞間CO2濃度(CI)葉綠素含量(SPAD) 先玉33025 ℃5.89±0.1214.4±0.15756.7±0.154418±0.10646.9±0.134 8 ℃ 1 d4.39±0.1454.3±0.12652.63±0.129398±1.6445.69±0.629 8 ℃ 2 d4.03±0.1783.92±0.12948.98±0.106384±3.14140.29±0.756 0 ℃ 1 d3.98±0.1533.56±0.13945.98±0.126376±5.32135.79±0.151 0 ℃ 2 d3.14±0.1253.26±0.11836.98±0.104354±6.17630.86±0.932 先玉33525 ℃6.19±0.7195.89±0.12560.56±0.107455±6.12655.96±0.965 8 ℃ 1 d5.78±0.1375.04±0.10858.76±0.104432±5.64952.98±1.256 8 ℃ 2 d5.04±0.1034.59±0.19850.89±0.109405±4.95648.85±1.563 0 ℃ 1 d5.23±0.1174.59±0.16551.72±0.128398±5.67650.79±0.688 0 ℃ 2 d4.89±0.1043.46±0.13248.24±0.261375±6.98545.89±1.985
2.3 低溫脅迫對玉米幼苗丙二醛(MDA)的影響
MDA作為膜脂過氧化產物,在一定程度上也可以反映植物受低溫傷害的程度。以生長4周(三葉一心)的兩個品系的玉米為材料,經低溫處理后,使用比色法測定MDA的含量,結果如圖2。低溫處理后兩個品系中的MDA含量明顯升高,而抗性品系先玉335中MDA含量上升幅度明顯低于敏感品系先玉330。
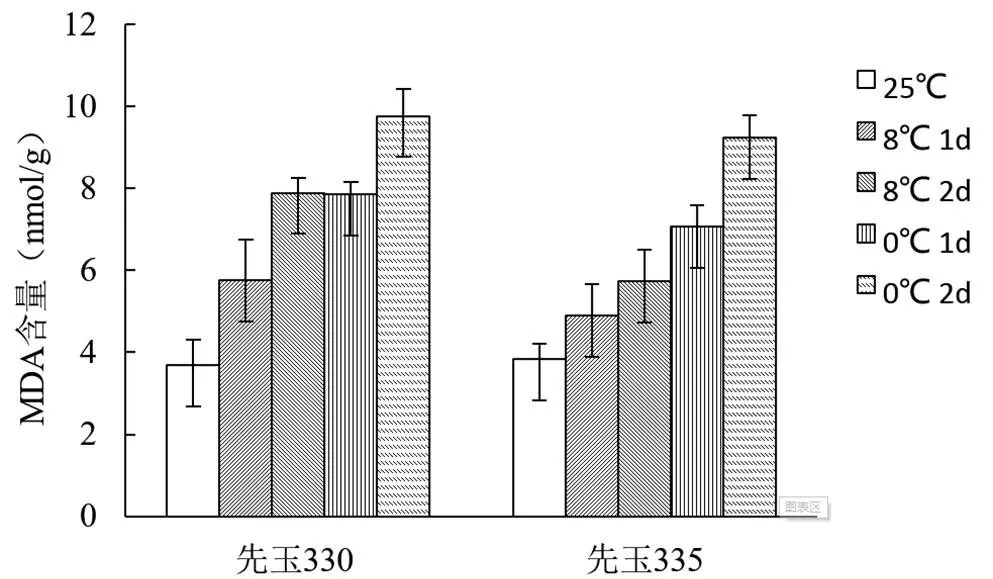
圖2 低溫脅迫對不同玉米品種MDA的影響
2.4 低溫脅迫對玉米幼苗SOD活性的影響
超氧化物歧化酶(SOD)是植物在逆境條件下產生的自我保護的酶,能夠清除體內多余的活性氧,防止細胞膜脂質的過氧化。由圖3分析可知,低溫處理之后,兩個品系的玉米品種SOD活性明顯升高,且抗性品系的提升幅度明顯高于敏感品系。
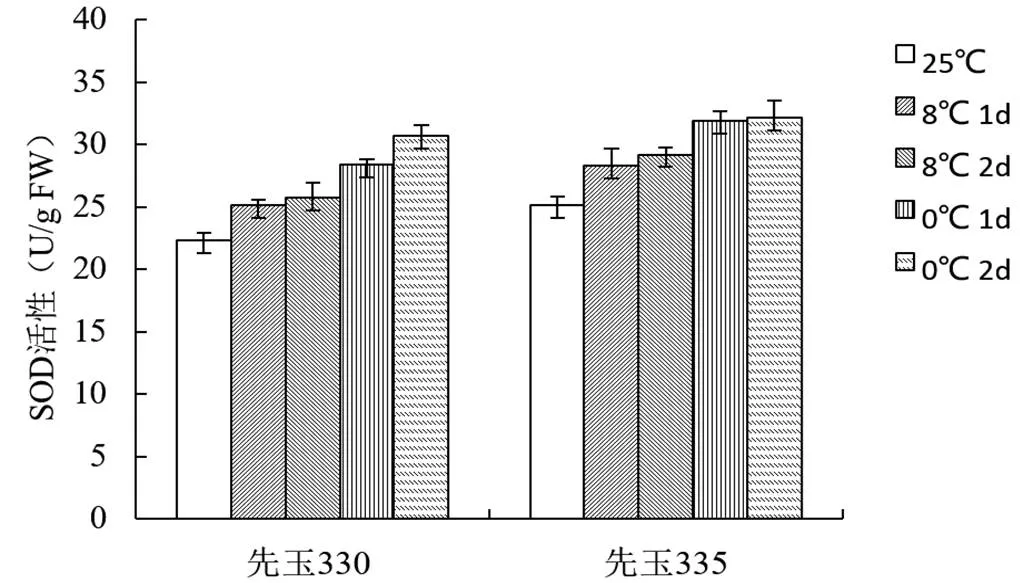
圖3 低溫脅迫對不同玉米品種SOD活性的影響
2.5 低溫脅迫對玉米幼苗POD活性的影響
過氧化物酶(POD)是植物產生的一種氧化還原酶,能夠清除由于膜脂過氧化產生的過氧化氫,抑制氧自由基的產生,減弱膜脂的過氧化。由圖4可知,經過低溫處理之后,玉米體內POD活性明顯升高,且先玉335的POD活性提升幅度明顯高于先玉330。
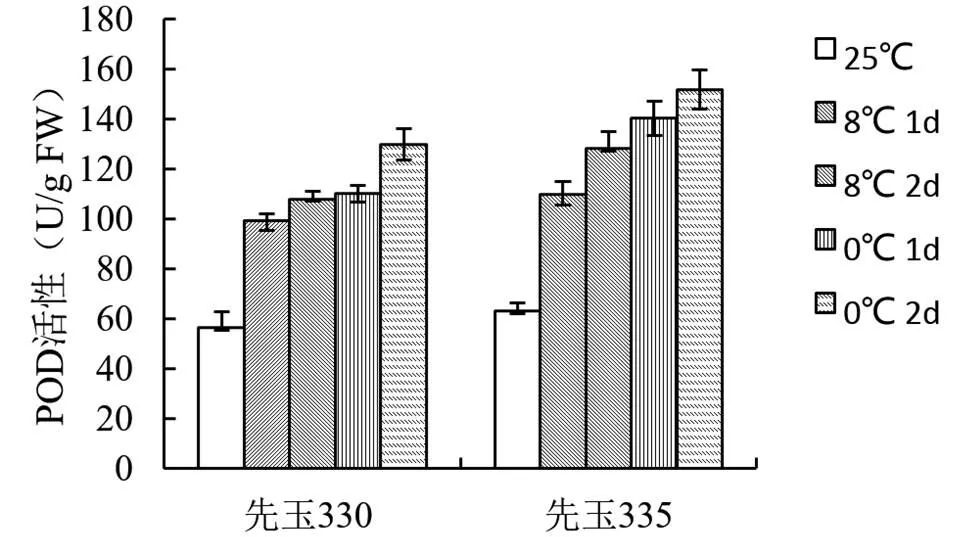
圖4 低溫脅迫對不同玉米品種POD活性的影響
3 討論
玉米生長發(fā)育的發(fā)芽期、苗期對低溫脅迫非常敏感。本研究采用生長4周的幼苗進行低溫處理下生理指標的檢測,實驗中可以發(fā)現(xiàn),隨著低溫脅迫處理時間的延長,兩個品系均受到不同程度的生理損害。細胞膜具有選擇透過性,能夠允許部分分子、離子通過,但是低溫損傷會導致細胞膜通透性增大。有研究發(fā)現(xiàn),作物在低溫脅迫下細胞膜結構遭到破壞,導致丙二醛含量明顯升高[9]。玉米是高光效作物,適合在較強的光下生長,有研究發(fā)現(xiàn)逆境條件下,玉米光合色素含量降低,最終導致光合作用減弱,嚴重影響玉米有機物的積累[10,13]。本研究中抗性品種的受抑制程度明顯低于敏感品種,充分體現(xiàn)了選育優(yōu)良品種的重要性。
有研究發(fā)現(xiàn),在逆境條件下,植物細胞內的活性氧大量積累,組織和器官受到氧化,會造成不可逆的損傷[11]。因此,為了清除體內的活性氧,植物進化了依靠保護酶的完整的清除活性氧的機制,細胞中產生SOD、POD、CAT等作為抗氧化系統(tǒng)的重要組成部分,能夠優(yōu)先清除生物體內多余的氧自由基,提升細胞的防御能力,防止細胞損傷,維持細胞內正常的生理生化反應[12]。本研究中,在低溫脅迫下兩個玉米品種體內的保護酶的含量都有明顯的上升,能夠有效地清除多余的活性氧,提高自身抵御低溫脅迫的能力。
有研究發(fā)現(xiàn),可溶性糖、脯氨酸等滲透調節(jié)物質也能夠穩(wěn)定植物滲透壓,提高植物的逆境調節(jié)能力,因此,滲透壓的調節(jié)的研究可以作為一種重要的研究作物抵御逆境脅迫的途徑[12]。植物體內的眾多轉錄因子及其調控的功能基因也都在其逆境脅迫的應答過程中發(fā)揮著不可替代的作用[14]。為了深入探究玉米抵御低溫脅迫的過程,除部分生理指標外,生化分子途徑也可以作為深入研究的方向。
[1]張海嬌,鄒原東,李志強,等.低溫脅迫對不同基因型玉米幼苗的影響[J].安徽農業(yè)科學,2021,49(20):48-50,127.
[2]李波,方志堅.耐低溫玉米自交系的篩選及其葉片生理特性和細胞結構變化[J].河南農業(yè)科學,2018,47(10):31-37.
[3]孫玉珺,秦東玲,伊凡,等.外源水楊酸對低溫脅迫下玉米幼苗生長及生理特性的影響[J].江蘇農業(yè)學報,2018,34(4):726-734.
[4]楊德光,馬月,劉永璽,等.低溫脅迫下外源CaCl2對玉米種子萌發(fā)及幼苗生長的影響[J].玉米科學,2018,26(3):83-88.
[5]楊德光,孫玉珺,劉昕萌,等.低溫脅迫對玉米發(fā)芽及幼苗生理特性的影響[J].東北農業(yè)大學學報,2018,49(5):1-8,44.
[6]蘇群,李晶.低溫脅迫下外源水楊酸對玉米幼苗保護酶的影響[J].現(xiàn)代化農業(yè),2017(8):46-48.
[7]于海瑞.低溫脅迫下玉米幼苗的幾種生理生化指標的變化[J].吉林農業(yè),2017(12):66.
[8]湯紹虎,羅充.植物生理學實驗教程[M].重慶:西南師范大學出版社,2012.
[9]趙娟,王芳,李永生,等.鈣對低溫脅迫下玉米種子萌發(fā)及幼苗生長的影響[J].甘肅農業(yè)大學學報,2016,51(6):30-35.
[10]扈光輝,張志武,楊德光.玉米耐低溫冷害研究進展[J].中國農學通報,2014,30(33):1-7.
[11]艾佳,溫萬里,楊德光,等.低溫脅迫及恢復對玉米光合特性的影響[J].玉米科學,2014,22(5):92-97.
[12]溫萬里,鄭穎坤,艾莉,等.玉米抗冷性研究進展[J].作物雜志,2014(4):16-21.
[13]陳梅,唐運來.低溫脅迫對玉米幼苗葉片葉綠素熒光參數(shù)的影響[J].內蒙古農業(yè)大學學報,2012,33(3):20-24.
[14]楊猛,魏玲,胡萌,等.低溫脅迫對玉米幼苗光合特性的影響[J].東北農業(yè)大學學報,2012,43(1):66-71.
10.3969/j.issn.2095-1205.2022.01.06
S513
A
2095-1205(2022)01-16-03
郭揚(1991- ),男,漢族,山東諸城人,碩士研究生,助教,研究方向為農學。

