晝夜溫差對三角褐指藻和赤潮異彎藻生長和葉綠素熒光特性的影響
李建安 王佳妤 梅熠輝 陳梅玲 周成旭 李亞鶴
(1. 寧波大學海洋學院, 寧波 315211; 2. 寧波大學食品與藥學學院, 寧波 315211)
作為一種微型的光合生物, 海洋微藻是海洋主要的初級生產者[1], 在海洋生態系統中起重要的作用, 可用作浮游動物、養殖生物的餌料, 也可產生較高含量的初生及次生代謝產物, 但也有一些種類如中肋骨條藻(Skeletonema costatum)和赤潮異彎藻(Heterosigma akashiwo)等暴發性生長形成赤潮, 給海水養殖和旅游業帶來一定的經濟損失。眾所周知, 微藻的生長受溫度、光照強度和鹽度等環境因素的影響, 并具有種間差異。有研究表明, 三角褐指藻(Phaeodactylum tricornutum)的最適生長溫度在15—20℃, 溫度升高至25℃ 顯著降低其平臺期的生物量[2], 海鏈藻(Thalassiosirasp.)在18—24℃內具有較高的生長速率, 溫度升高至27℃顯著抑制其生長[3], 而相比于22℃, 假微型海鏈藻(Thalassiosira pseudonana)在26℃時的生長速率顯著增加[4], 相比于15℃, 25℃顯著促進中肋骨條藻的生長[5], 也有研究顯示溫度從20℃升高至28℃, 威氏海鏈藻(Thalassiosira weissflogii)的生長不受影響, 但瑪氏骨條藻(Skeletonema marinoi)的生長速率逐漸降低[6],即微藻生長對溫度變化的響應不同。近岸海域的調查研究顯示, 溫度是影響近岸海域浮游植物群落結構的主要環境因子之一[7], 赤潮的暴發于海水溫度密切相關[8], 有害赤潮藻赤潮異彎藻生長的最適溫度為25℃[9]。
一般認為, 溫度是通過影響微藻中與光合作用相關的酶的活性及耐受性, 影響微藻的葉綠素含量和光合速率, 繼而影響微藻的生長、總脂和毒素含量等, 及影響浮游植物的群落結構。研究表明, 赤潮異彎藻的細胞體積隨著溫度的升高而逐漸減小,同時單位體積細胞的色素含量逐漸增加[9], 錐狀斯氏藻(Scrippsiella trochoidea)和塔瑪亞歷山大藻(Alexandrium tamarense)的光合放氧速率在20—22℃時達到最高值[10], 溫度由15℃升高至25℃, 三角褐指藻的光合固碳速率也顯著增加[11], 而當溫度由10℃逐漸升高至30℃, 三角褐指藻達到指數生長末期所需的時間降低, 其總脂肪酸含量先增加后降低, 且組成成分也受影響, 其中不飽和脂肪酸含量在15℃時含量最高[12]。三角褐指藻作為一種餌料微藻, 在研究溫度對其生長的影響的同時, 也需考慮其品質的變化。
然而, 盡管關于溫度對微藻生長、光合作用及生化組分等方面的研究較多, 但已有的研究多集中在探究不同溫度梯度的影響[2—6,9—12], 也有少量研究關注了低溫或高溫的前處理即溫度的誘導作用[13],但這些研究均忽略了晝夜溫差的效應, 而自然界中晝夜溫差是真實存在的, 雖然海水溫度的晝夜變化低于陸地溫度, 但海水溫度晝夜變化的影響也是不可忽視的。目前已有的關于晝夜溫差的研究多集中在對大型海藻的探究上[14,15], 本實驗室的研究也表明大型海藻滸苔(Ulva prolifera)在夜間黑暗狀態下能夠快速生長[16], 且一定程度的晝夜溫差可促進大型海藻滸苔的生長(未發表數據)。因此, 考慮到大部分微藻的細胞增殖主要是在暗周期進行, 我們推測微藻的生長在一定程度上會受到晝夜溫差的影響, 且具有種間差異。本實驗選擇常見的優良餌料藻三角褐指藻(Phaeodactylum tricornutum)和赤潮藻赤潮異彎藻(Heterosigma akashiwo)為材料, 探究晝夜溫度變化對其生長和光合作用的影響。
1 材料與方法
1.1 藻種
三角褐指藻由中國科學院水生生物研究所胡晗華教授提供, 赤潮異彎藻由寧波大學食品與藥學學院藻種庫提供。
1.2 微藻培養
分批培養P. tricornutum和H. akashiwo分別培養在鹽度為35和25的f/2加富的人工海水中, 培養期間光照強度為100 μmol/(m2·s)(早8:00到晚8:00為光周期時間)。溫度處理設置3個水平, 分別為22℃(光暗周期培養溫度均為22℃)、22—18℃(光、暗周期培養溫度分別為22℃和18℃)、18℃(光暗周期培養溫度均為18℃)。每個溫度處理組設4個重復, 分批培養時P. tricornutum和H. akashiwo的起始密度分別為3×105和5×104cell/mL。每天測定細胞密度, 繪制標準曲線, 在指數生長期進行葉綠素熒光參數、葉綠素a和類胡蘿卜素含量及光合固碳速率的測定。
半連續培養在分批培養的基礎上(明確指數生長期細胞濃度范圍), 取指數生長中期的藻細胞進行半連續培養實驗, 溫度處理和其他培養條件同分批培養。P. tricornutum和H. akashiwo的起始細胞密度分別設置為9×105和5×104cell/mL, 每隔1天進行細胞計數和按比例稀釋, 稀釋的后的細胞濃度等同于初始濃度, 并計算半連續培養時細胞的比生長速率。待比生長速率穩定后測定其葉綠素熒光參數、葉綠素a和類胡蘿卜素含量。
1.3 細胞密度的測定和比生長速率的計算
每天定時取樣用血球計數板和浮游植物計數框分別測定三角褐指藻和赤潮異彎藻的細胞密度。赤潮異彎藻在計數前需用盧戈氏液進行固定。而后, 用Logistic方程對分批培養下的生長速率(即生長曲線)進行擬合, 擬合公式為:y=a/{1+[(ay0)/y0]e-rx}(y0代表初始細胞密度,a代表環境承載量,r為內稟增長率)[17]。
半連續培養下的比生長速率的計算公式如下:μ=ln(N2/N1)/(t2-t1), 其中N1和N2分別為半連續培養時t1和t2對應的細胞密度。
1.4 葉綠素熒光參數的測定
采用AquaPen手持式水體熒光儀進行葉綠素熒光參數的測定。中午12點前后取樣, 黑暗條件下適應15min后進行葉綠素熒光誘導曲線的測定, 光化光設置為600 μmol/(m2·s)。獲得圍繞光系統Ⅱ的最大光化學效率(Fv/Fm)和相對高光600 μmol/(m2·s)條件下(大于半飽和光強)的有效光化學效率(ФPSⅡ)、光化學淬滅(Qp)和非光化學熒光淬滅(NPQ), 其中,ФPSⅡ=(Fm′-Fs)/Fm′, Qp=(Fm′-Fs)/(Fm′-F0′), NPQ=Fm/Fm′-1。
直接取培養狀態下的細胞進行快速光響應曲線(RLC)的測定, RLC用公式rETR=PAR/(a×PAR2+b×PAR+c) 進行擬合, 進而計算其圍繞光系統Ⅱ的最大相對電子傳遞速率(rETRmax)、表觀光能利用效率(α)和半飽和光強(Ek)[18]。
1.5 葉綠素a和類胡蘿卜素的提取與測定
在指數生長期和平臺期取一定體積的藻液, 過濾在GF/F膜上 (Φ25 mm, Whatman, 孔徑0.22 μm),放入15 mL 離心管中, 加入5 mL 甲醇, 4℃提取24 h,之后離心 (5000×g, 10 min), 取上清液于紫外-分光光度計(UV6100A, 上海元析儀器有限公司)中進行全光譜掃描(250—750 nm)。根據公式計算葉綠素a(Chl.a)和類胡蘿卜素 (Carotenoids, Car.) 的含量[19]:
Chl.a(μg/mL)=13.2654×(A665-A750)-2.6839×(A632-A750)
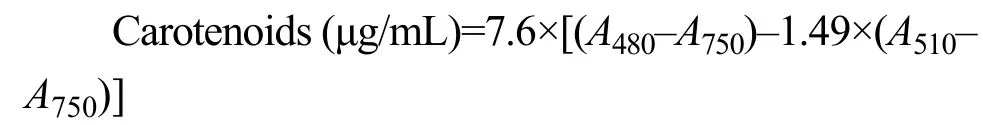
而后再根據細胞密度和藻液體積, 將Chl.a和Car.的單位換算為pg/cell。
1.6 光合固碳速率的測定
取指數生長期的藻液進行低壓過濾(壓力低于0.03 pa), 將過濾后的藻細胞沖洗入新鮮的預調溫的空氣飽和的培養基中, 測定藻液的初始pH和細胞濃度, 再分裝到4個定制玻璃管中, 放入相應的培養條件下密閉培養1h, 而后迅速測定其pH。根據pH和總堿度(TA, 固定值, 與海水鹽度有關[20]), 運用CO2sys軟件計算密閉培養前后培養基中溶解無機碳的濃度, 進而計算藻細胞的光合固碳速率[21]。計算公式如下: 固碳速率=ΔC×V/(N×h), ΔC為培養前后無機碳濃度的變化值,V為密閉培養的體積,N為細胞數,h為培養時間。
1.7 數據處理
所有數據表示為平均值±標準誤(n=4)。采用單因子方差分析的方法進行溫度效應的顯著分析, 事后采用Tukey法進行多重比較, 顯著水平設置為P<0.05。
2 結果
2.1 晝夜溫差對三角褐指藻和赤潮異彎藻生長的影響
分批培養的結果顯示三角褐指藻相比于18℃,22℃延長了藻細胞生長的延遲期, 平臺期時細胞濃度低于18℃, 而22—18℃處理組, 在培養的第1至第3天其生長趨勢幾乎與18℃處理組一致, 但顯著降低平臺期的藻細胞密度(圖1A), 然而對不同溫度條件下的生長曲線進行擬合發現, 培養溫度為22℃時, 藻細胞的內稟增長率較高, 但該溫度處理下初始藻細胞濃度較低(表1)。半連續培養的結果顯示相比于18℃, 22℃時細胞的比生長速率略有降低, 降幅為8.9%, 22—18℃顯著抑制了細胞的生長(P=0.012; 表2)。
和三角褐指藻不同, 盡管18℃和22℃處理下,平臺期的細胞密度相差不大, 但相比于22℃, 18℃和22—18℃均延長了赤潮異彎藻生長的延遲期(圖1B和表1)。且相比于恒溫處理, 無論是分批培養還是半連續培養, 晝夜溫差顯著降低了赤潮異彎藻的比生長速率(表1和表2), 尤其是半連續培養時, 相比于22℃, 22—18℃時細胞比生長速率的降幅高達36.4%(表2)。

表1 三角褐指藻和赤潮異彎藻分批培養時不同溫度處理下生長曲線的擬合參數Tab. 1 Fitting parameters of growth curve of P. tricornutum and H. akashiwo

表2 半連續培養條件下三角褐指藻和赤潮異彎藻在各溫度處理條件下的比生長速率Tab. 2 The specific growth rate (μ) of P. tricornutum and H.akashiwo
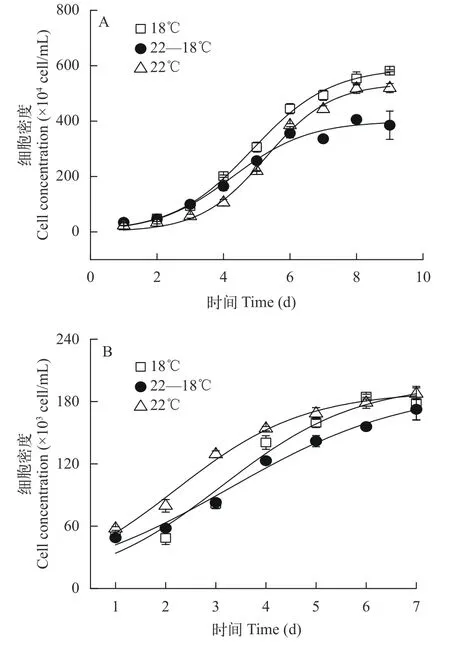
圖1 光暗周期不同溫度處理的三角褐指藻(A)和赤潮異彎藻(B)的細胞密度Fig. 1 Cell concentrations of P. tricornutum (A) and H. akashiwo(B) under different temperatures treatments
2.2 晝夜溫差對三角褐指藻和赤潮異彎藻葉綠素a和類胡蘿卜素含量的影響
在分批培養時, 相比于22℃, 18℃和22—18℃均顯著降低了三角褐指藻的葉綠素a(Chl.a; 18℃:P<0.001; 22—18℃:P<0.001)和類胡蘿卜素含量(Car.; 18℃:P<0.001; 22—18℃:P<0.001; 圖2A)。然而, 對于赤潮異彎藻而言, 22℃和22—18℃處理間的Chl.a和Car.的含量差異不顯著(Chl.a:P=0.503;Car.:P=0.501), 但相比于22℃, 18℃顯著降低其含量(Chl.a:P=0.002; Car.:P=0.004; 圖2C)。在半連續培養時, 溫度變化對2種藻Chl.a和Car.的影響均不顯著(圖2B和2D)。
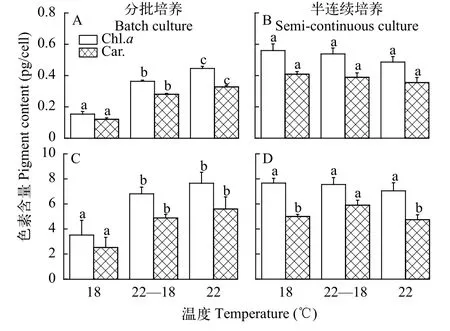
圖2 在不同溫度處理下三角褐指藻(A和B)及赤潮異彎藻(C和D)分別在分批培養指數期(A和C)和半連續培養(B和D)時的葉綠素a和類胡蘿卜素含量Fig. 2 Cellular pigments contents of P. tricornutum (A and B)and H. akashiwo (C and D) under different temperature treatments with batch (A and C) and semi-continuous cultures (B and D),respectively
2.3 晝夜溫差對三角褐指藻和赤潮異彎藻葉綠素熒光參數的影響
分批培養和半連續培養的結果顯示, 三角褐指藻光系統Ⅱ的最大光化學效率(Fv/Fm)和非光化學淬滅(NPQ)在不同溫度處理間無差異(圖3A和3B),但在600 μmol/(m2·s)條件下其有效光化學效率(ФPSⅡ)及光化學淬滅(Qp)在18℃處理下略高于其他2個溫度處理。溫度對赤潮異彎藻的Fv/Fm、ФPSⅡ和Qp的影響均不顯著(圖3C和3D), 然而分批實驗的結果顯示在22℃培養條件下的細胞的NPQ最大(圖3B),而半連續培養時NPQ在22℃條件下最小(圖3D)。
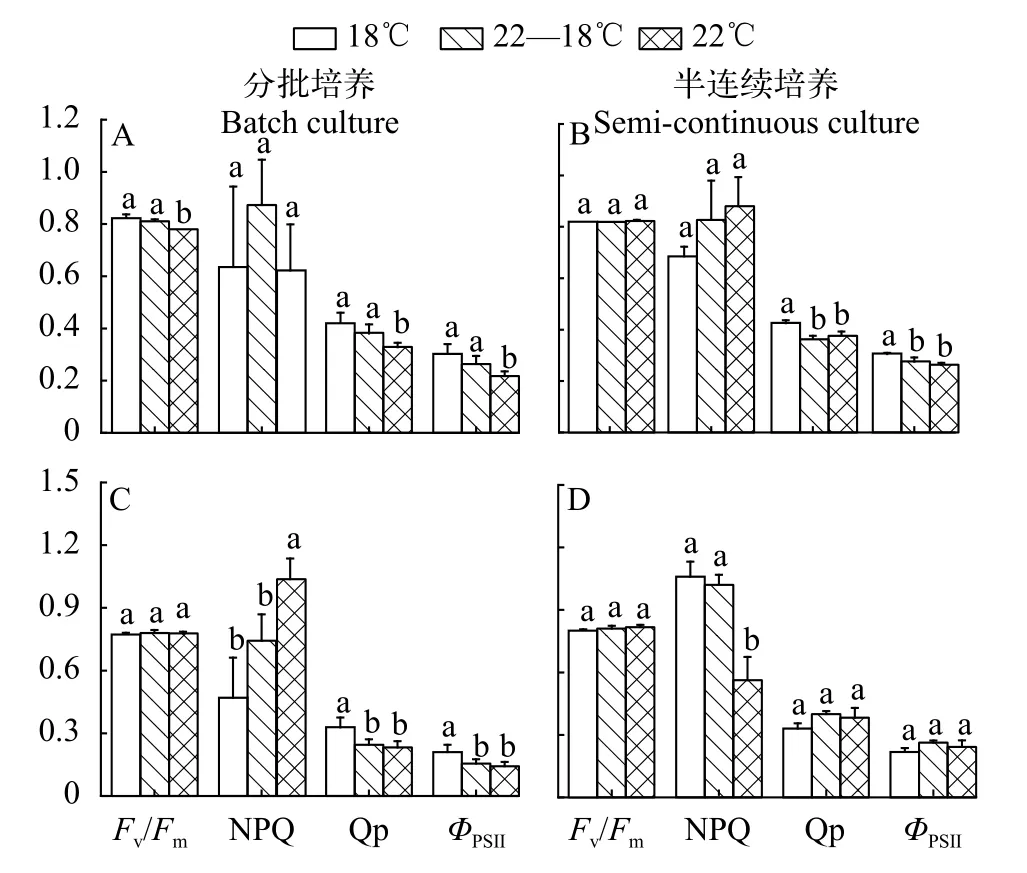
圖3 在不同溫度處理下三角褐指藻(A和B)及赤潮異彎藻(C和D)分別在分批培養指數期(A和C)和半連續培養時的葉綠素熒光參數Fig. 3 Chlorophyll fluorescence parameters of P. tricornutum (A and B) and H. akashiwo (C and D) under different temperature treatments with batch (A and C) and semi-continuous cultures (B and D), respectively
整體來說, 三角褐指藻和赤潮異彎藻的相對電子傳遞速率隨著光照強度的增加而增加, 且三角褐指藻的半飽和光強(Ek)和對高光的耐受能力顯著高于赤潮異彎藻(圖4和表3)。培養方式影響2種藻相對電子傳遞速率對溫度的響應, 在分批培養時, 三角褐指藻和赤潮異彎藻的最大相對電子傳遞速率(rETRmax)在18℃時最大(圖4A和4C、表3), 而在半連續培養時, 三角褐指藻的rETRmax在18℃時最小,溫度對赤潮異彎藻rETRmax的影響不顯著(F(2,9)=0.413,P=0.674), 22℃增大了赤潮異彎藻的Ek, 增加了該藻對高光的耐受能力(圖4C和4D、表3)。
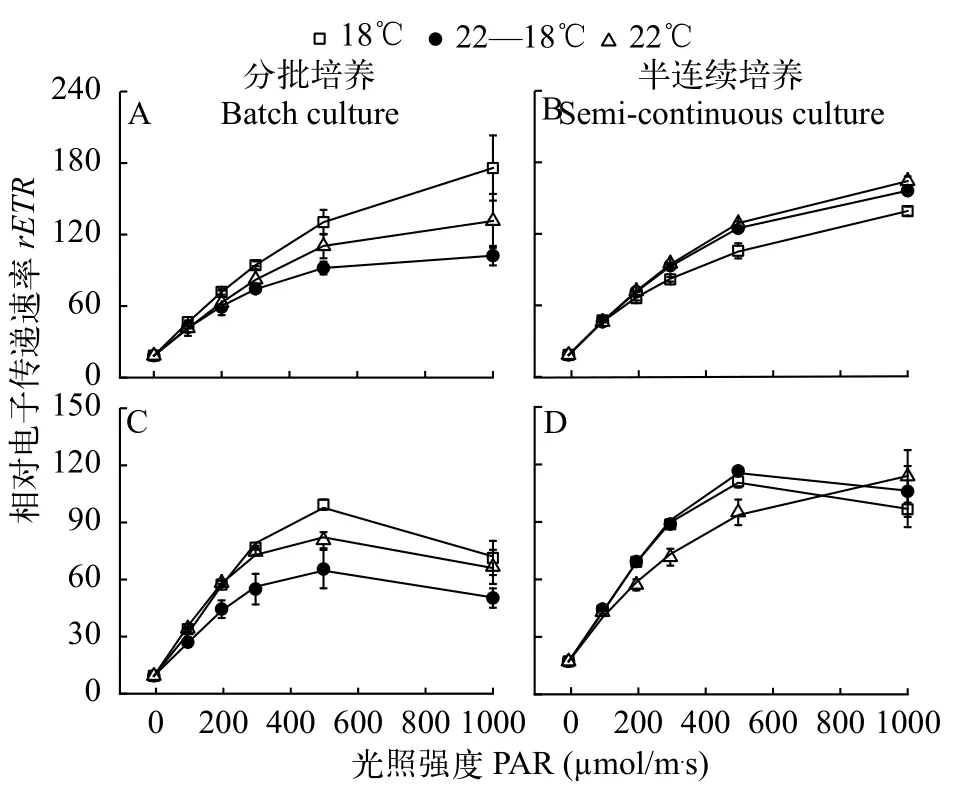
圖4 不同培養溫度下三角褐指藻(A和B)及赤潮異彎藻(C和D)分別在分批培養指數期(A和C)和半連續培養時的光響應曲線Fig. 4 Rapid light curves of P. tricornutum (A and B) and H. akashiwo (C and D) under different temperature treatments with batch(A and C) and semi-continuous cultures (B and D), respectively
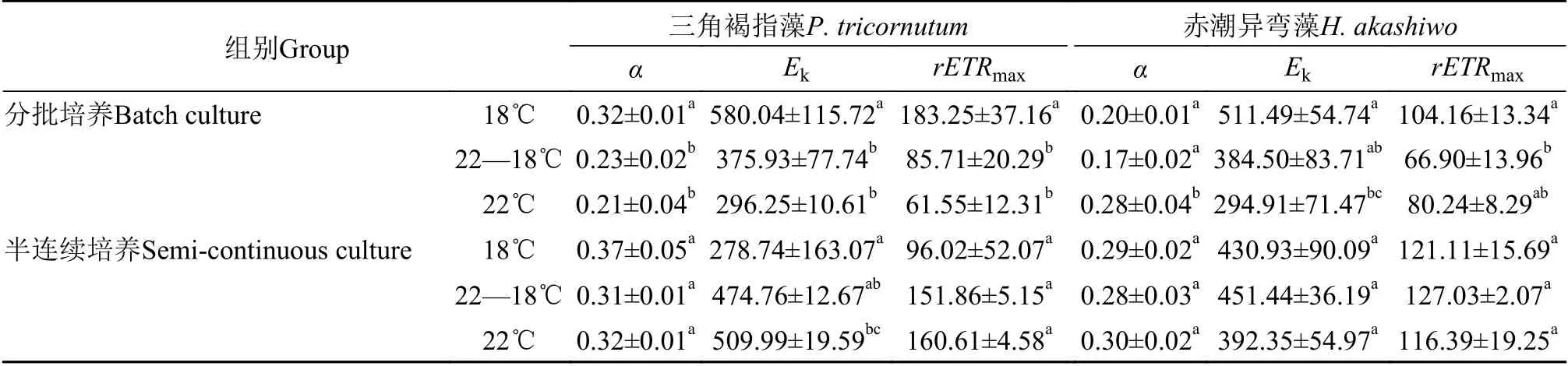
表3 在分批及半連續培養條件下三角褐指藻和赤潮異彎藻在各溫度處理下的表觀光能利用效率(α)、半飽和光強(Ek)和最大相對電子傳遞速率(rETRmax)Tab. 3 The table tourism efficiency (α), saturated intensity (Ek), and the maximum relative electron transfer rate (rETRmax) of P.tricornutum and H. akashiwo with batch culture
2.4 晝夜溫差對三角褐指藻和赤潮異彎藻光合固碳速率的影響
三角褐指藻和赤潮異彎藻的光合固碳速率均在22—18℃條件下顯著高于其他2個溫度處理, 但在18℃和22℃處理間幾乎無差異, 即晝夜溫差顯著影響微藻的光合作用(和22℃相比, 三角褐指藻:P<0.01; 赤潮異彎藻:P=0.02; 圖5)。
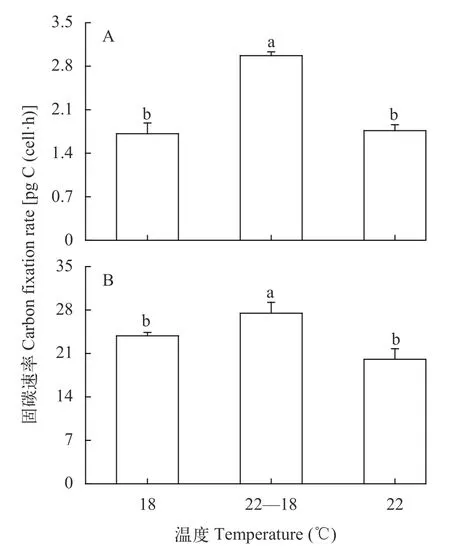
圖5 不同溫度處理的三角褐指藻(A)和赤潮異彎藻(B)的光合固碳速率Fig. 5 Carbon fixation rates of P. tricornutum (A) and H.akashiwo (B) at different temperature treatments
3 討論
溫度是影響微藻生長、光合作用、餌料品質及分布的主要因素, 不同微藻具有不同的最適溫度[2—7],溫度升高或降低將會抑制或促進微藻的生長及光合作用[2—6,9,10]。本研究發現, 溫度從18℃升高至22℃, 三角褐指藻的生長速率略有降低, 但差異不顯著, 即三角褐指藻的適溫范圍較廣[2], 而赤潮異彎藻的生長略有增加, 體現了微藻的不同最適生長溫度, 這與之前的研究一致, 即25℃是赤潮異彎藻的最適生長溫度[6]。
3.1 晝夜溫差對微藻生長的影響
盡管關于溫度對微藻生長、生化組成影響的研究較多[2—6,9—12,22], 然而對已有的文獻進行分析發現, 現有的研究多是探討恒定的溫度梯度的效應,缺少對晝夜溫差效應的探究, 僅有的關于溫度波動、晝夜溫差對藻類生長的研究顯示: 溫度波動10℃不影響蛋白核小球藻的生長, 但抑制銅綠微囊藻和梅尼小環藻的生長, 且對梅尼小環藻的抑制作用強于銅綠微囊藻[23]; 晝夜溫差促進了大型海藻壇紫菜的生長, 并強化了海水酸化對壇紫菜光合作用、硝酸還原酶活性、氨基酸含量等的促進作用[15],也有研究顯示相比于晝夜溫差10℃, 晝夜溫差5℃有利于梅尼小環藻的生長[24], 即相比于恒溫處理來說, 無論是溫度波動還是晝夜溫差, 對大型海藻、微藻的生長均具有一定的效應, 且該效應具有種間差異。本研究的結果顯示, 晝夜溫差4℃顯著降低了三角褐指藻和赤潮異彎藻的生長, 但具有種間差異, 具體體現在: 分批培養時晝夜溫差4℃處理顯著降低了三角褐指藻在平臺期的細胞密度, 而該處理下赤潮異彎藻在平臺期的細胞密度和其他2個溫度處理間的差異不顯著, 但降低了分批培養初期的細胞生長速率, 延長了達到平臺期所需的時間, 從生態學的角度來看, 晝夜溫差延長了赤潮異彎藻指數生長的延遲期, 在一定程度上也延遲了以赤潮異彎藻為優勢種的赤潮的暴發。但從不同溫度處理間平臺期細胞密度的變化這個角度來說, 赤潮異彎藻對晝夜溫差的耐受性高于三角褐指藻。然而半連續培養的結果顯示, 晝夜溫差4℃對赤潮異彎藻生長的抑制作用(和最適溫度相比, 抑制率為36.4%)遠高于三角褐指藻(11.4%), 從這個角度來看, 三角褐指藻對晝夜溫差的適應能力較強。這在一定程度上說明微藻培養方式的重要性, 因此, 晝夜溫差處理雖然降低了三角褐指藻的生長速率, 但其光合固碳速率顯著增加, 可通過優化培養條件、培養方式促進其生長并提高其餌料品質。同時本研究分批培養的結果也說明了溫度對三角褐指藻生長的影響很可能受到其他環境因素, 比如光照強度、營養鹽等的影響。柳清楊等[25]的研究顯示, 氮限制能夠降低三角褐指藻對光能的吸收利用效率, 在分批培養后期, 三角褐指藻細胞濃度較高, 其單細胞接受的光照強度和營養鹽均低于培養初期, 進一步導致晝夜溫差4℃處理的藻細胞密度顯著降低。
3.2 晝夜溫差對微藻光合作用能力的影響
適度的晝夜溫度變化可提高大型海藻的光合作用和氮同化, 有利于有機物的合成[15], 也有研究顯示, 夜間低溫可以促進滸苔在光周期時的生長[16],且滸苔在暗周期時也可以維持較高的生長[14]。本研究的結果顯示, 三角褐指藻和赤潮異彎藻的光合固碳速率均在晝夜溫差處理下較高, 即夜間溫度適度降低可以促進藻細胞在光周期時的光合作用, 結合以往的研究結果即溫度史影響藻細胞對溫度變化的響應[26], 推測適度的晝夜溫差可以促進微藻的生長, 但需要進一步的實驗驗證。同時, 目前海水升溫是一個不爭的事實, 而升溫也具有季節和區域差異[27], 晝夜溫差的變化幅度也會有差異, 微藻對晝夜溫差的不同響應, 會在一定程度上影響浮游植物的群落結構。此外, 溫度影響微藻的脂肪酸含量及組分且具有種間差異[11,12,28], 晝夜溫差對不同種類的餌料微藻品質的影響需進一步研究。
一般來說, 藻類光系統Ⅱ的最大光化學效率Fv/Fm反映了藻類進行光合作用的最大潛力[29], 當藻細胞受到溫度、光照等環境因素的脅迫時, 藻細胞的Fv/Fm會顯著降低[25]。本研究的結果顯示3個溫度處理下2種藻的Fv/Fm均在0.8左右, 不同溫度處理間的差異不顯著, 表明實驗所用的3個溫度均不是脅迫溫度。Qp是光系統Ⅱ吸收的能量用于進行光化學反應的比例, 開放態的光系統Ⅱ反應中心所占的比例, 反映了光合活性的高低[30]。在高光條件下, 低溫培養的三角褐指藻具有較高的光化學淬滅(Qp)和有效光化學效率(ФPSⅡ), 而溫度不影響赤潮異彎藻的Qp和ФPSⅡ, 進一步反映了微藻響應環境因素變化的種間差異。對于三角褐指藻來說, 溫度升高降低了藻細胞的Qp和ФPSⅡ, 表明溫度升高使得藻細胞對高光更加敏感。此外, 半飽和光強Ek的高低反映了藻細胞對高光的耐受能力[31], 三角褐指藻的Ek顯著高于赤潮異彎藻, 其對高光的耐受性也較高, 同時在分批培養后期對單個細胞接受的光照強度變化的敏感性也更高, 這或許是分批培養2種藻對晝夜溫差處理不同響應的可能原因。
在理論上, 藻類相對電子傳遞速率(rETR)和光合固碳/放氧速率均可以用來衡量藻細胞的光合作用, 尤其是基于熒光檢測的便捷性, 葉綠素熒光技術在藻類光合性能的研究中應用廣泛[32], 但實際上rETR和光合放氧/固碳速率并不是總是同步的, 尤其是在高光條件下, 也會出現藻細胞的rETR較高但光合放氧速率接近0的情況[33], 其主要原因是部分電子參與具有光保護作用的水-水循環, 從而降低高光的抑制作用[34]。在本研究中, 分批培養時, 和18℃、22℃處理相比, 22—18℃條件下藻細胞的rETR較低, 但光合固碳速率較高, 這在以往的研究中也有所發現[5,11]。可能的原因是升溫促進光合作用關鍵酶核酮糖-1,5-二磷酸羧化酶/加氧酶的羧化活性, 但也降低了該酶對CO2的親和力[35], 即光合作用對溫度的依賴性較高, 其響應策略也較復雜,22—18℃培養的藻細胞在光暗周期的交替中經歷著高溫-低溫的變換, 光周期時培養溫度較高, 此時較高的光合固碳速率是對升溫的一種應激現象。2個恒溫處理間的藻細胞的光合固碳速率無差異也說明實驗所選取的溫度均在2種藻的最適溫度范圍內。
三角褐指藻生長繁殖快, 富含多不飽和脂肪酸[12],是魚蝦貝的理想餌料藻, 在水產育苗中應用廣泛,同時也富含巖藻黃素[36], 經濟價值高, 如何提高三角褐指藻的生長速率獲得較高的細胞數量是關鍵。赤潮異彎藻是有害赤潮的優勢種, 實驗室內開展環境變化對赤潮藻優勢種生長等特性的影響對赤潮預測、治理有重要的意義。基于此, 本研究選取了餌料藻三角褐指藻和赤潮藻赤潮異彎藻為材料, 研究晝夜溫差這個自然現象對其生長、光合作用等的影響, 并分析其種間差異。其結果顯示晝夜溫差抑制二者的生長、相對電子傳遞速率, 但受其培養方式、光照強度和營養鹽等因素的調控。但本研究僅僅是對晝夜溫差效應的初步探討, 其作用機理、多環境因素的復合效應及微藻的種間、品系間的不同響應均需深入探究。

