RMI4評分、IOTA簡易標準和GI-RADS分類用于鑒別卵巢良惡性腫塊:一項對比分析*
劉春,胡紫玥,李媛,朱熠,何容,林靜,盧漫
610041 成都,四川省腫瘤醫院·研究所,四川省癌癥防治中心,電子科技大學醫學院 超聲醫學中心
卵巢癌發病率僅次于子宮體癌和宮頸癌,但死亡率一直高居女性生殖系統惡性腫瘤首位。超聲是評估卵巢病變最常用的成像技術[1],但超聲診斷卵巢腫瘤的準確率受超聲醫師的經驗影響比較大[2],故應用各客觀預測模型輔助低年資超聲醫師診斷卵巢腫瘤很有必要。多項研究證實[3-5],惡性風險指數4(risk of malignancy index 4,RMI4)、國際卵巢腫瘤分析組織(International Ovarian Tumor Analysis,IOTA)簡易標準和婦科影像報告與數據系統(gynecologic imaging reporting and data system,GI-RADS)均可客觀、高效地鑒別診斷附件良惡性腫塊,但目前有關三者診斷效能比較報道尚少。本研究旨在對比研究RMI4、IOTA簡易標準及GI-RADS在鑒別診斷卵巢腫塊良惡性中的臨床價值。
1 資料與方法
1.1 研究對象
收集2018年10月至2020年8月于我院接受婦科超聲檢查并獲得手術病理結果或最終臨床隨訪結果的卵巢腫瘤患者的資料,根據納入排除標準進行篩查。納入標準:1)術前1周內的腫瘤標記物資料完備;2)超聲圖像清晰。排除標準:1)既往接受雙附件手術或盆腔放化療的患者;2)妊娠或哺乳期婦女;3)超聲檢查后1周內未接受手術的患者。
1.2 儀器與方法
應用GE Logiq E9超聲診斷儀,配備陰道探頭(頻率5~9 MHz)和腹部探頭(頻率1~5 MHz)。所有患者均接受經陰道或腹部超聲檢查。重點觀察并記錄卵巢腫瘤的大小、形態、邊界、內部回聲、與周圍臟器的關系及血流情況,同時觀察子宮、腹盆腔有無轉移或積液等情況,保存圖像,規范超聲報告。第一作者(具有5年婦科超聲診斷經驗)在不知道臨床資料與病理結果的情況下對納入研究腫瘤的聲像圖特征進行分析總結,并分別采用RMI4、IOTA簡易標準和GI-RADS對其良惡性進行評估。其中,存在多發腫瘤時,納入超聲形態最復雜的腫瘤;如果兩個腫瘤的超聲特征相似,則選取最大的腫瘤或超聲容易探及的腫瘤[6]。
1.3 評價標準
1.3.1 RMI 本研究使用的RMI4結合超聲診斷(U)、絕經狀態(M)、腫瘤大小(S)和血清CA125來預測腫瘤良惡性[7]。評價公式:RMI4=U×M×S×CA125。超聲評價指標:實性成分、多囊結構、雙側附件腫瘤、腹腔積液和轉移病灶,每項陽性評1分;超聲評分≤1時,U=1,超聲評分≥2時,U=4。絕經狀態評分:絕經前M=1,絕經后M=4;將年齡≥50歲且子宮切除者、距離末次月經時間≥1年評價為絕經狀態,其余評價為絕經前狀態。腫瘤大小評分:腫瘤最大直徑<7 cm時,S=1,腫瘤最大直徑≥7時,S=2。RMI4>450診斷為惡性。
1.3.2 IOTA簡易標準 良性腫瘤特征(B):B1:單房囊腫;B2:實性部分(最大直徑<7 mm);B3:多房囊腫,分隔光滑、厚薄均勻,最大徑<100 mm;B4:無血流信號;B5:存在聲影。惡性腫瘤特征(M):M1:腹腔積液;M2:乳頭狀結節≥4個;M3:實性腫塊且形態不規則;M4:豐富血流;M5:囊實性腫塊且形態不規則(最大直徑>100 mm)。有良性腫瘤特征(≥1)且無惡性特征存在評價為良性腫瘤;有惡性腫瘤特征(≥1)且無良性特征存在評價為惡性腫瘤;良、惡性特征均具備,或均不具備評價為不確定類[8]。
1.3.3 GI-RADS GI-RADS 1類:良性,正常附件;GI-RADS 2類:很可能是良性,功能性組織;GI-RADS 3類:可能是良性,良性贅生性腫瘤;GI-RADS 4類:可能是惡性腫瘤,不包括2~3類病變,且有1~2個惡性特征者[9]:厚壁分隔(≥3 mm)、實性部分≥50%、乳頭狀結節突起(≥7 mm)、中心血流信號、最低阻力指數<0.5、腹腔積液;GI-RADS 5類:很可能是惡性腫瘤,腫瘤具有≥3個4類病變所述惡性征象者。將GI-RADS 1~3類評價為良性腫瘤,4~5類評價為惡性腫瘤。
1.4 統計學分析
采用SPSS 19.0軟件行統計分析,與術后病理結果或最終臨床隨訪結果對照。以χ2檢驗對卵巢良惡性腫瘤聲像圖特征進行比較,P<0.05為差異具有統計學意義。計算RMI4、IOTA簡易標準及GI-RADS鑒別卵巢良惡性腫瘤的效能并以χ2檢驗進行兩兩比較,依據比較次數調整檢驗水準,P<0.017為差異具有統計學意義。
2 結 果
2.1 病理學及超聲檢查結果
根據納入排除標準,本研究共獲得299例附件腫塊患者的病例資料,年齡25~89歲,平均(45.63±3.41)歲,其中絕經期前226例,絕經后73例。296例經術后病理證實,3例經最終臨床隨訪證實;其中良性腫瘤191例,交界性腫瘤19例,惡性腫瘤89例。本研究將19例交界性腫瘤納入惡性腫瘤。卵巢良性腫塊超聲表現多呈單房囊腫,多房囊性團塊囊壁光滑、囊內纖細分隔,乳頭狀結節最大直徑<7 mm,無血流信號,伴聲影;而惡性腫塊多表現為實性或囊實性、囊壁及分隔較厚且厚薄不均勻,乳頭狀結節≥4個,中心血流信號,最低阻力指數<0.5,合并腹腔積液;兩組差異均有統計學意義(P<0.05)(表1,圖1、2)。
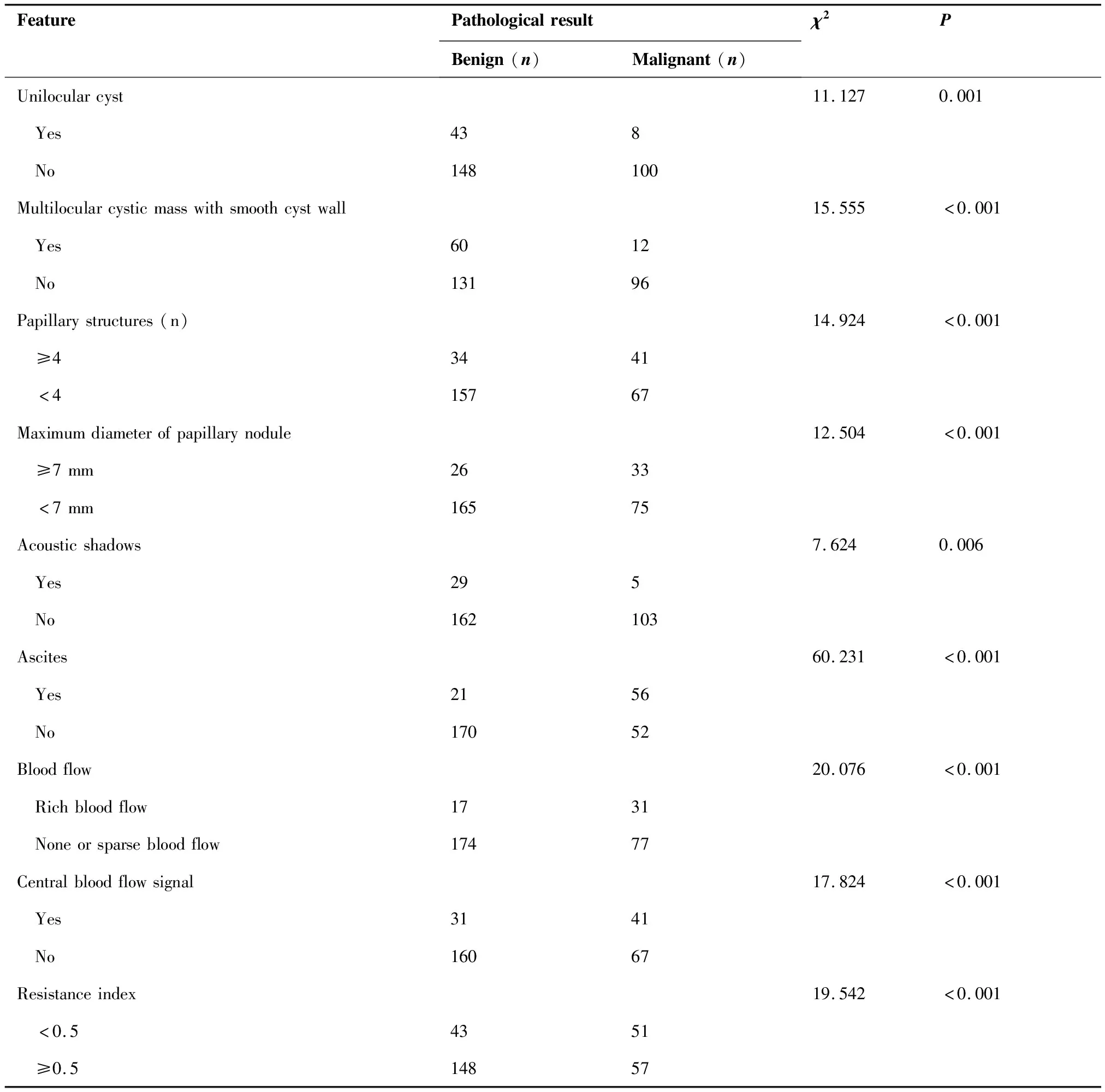
表1 卵巢良惡性腫瘤超聲聲像圖特征
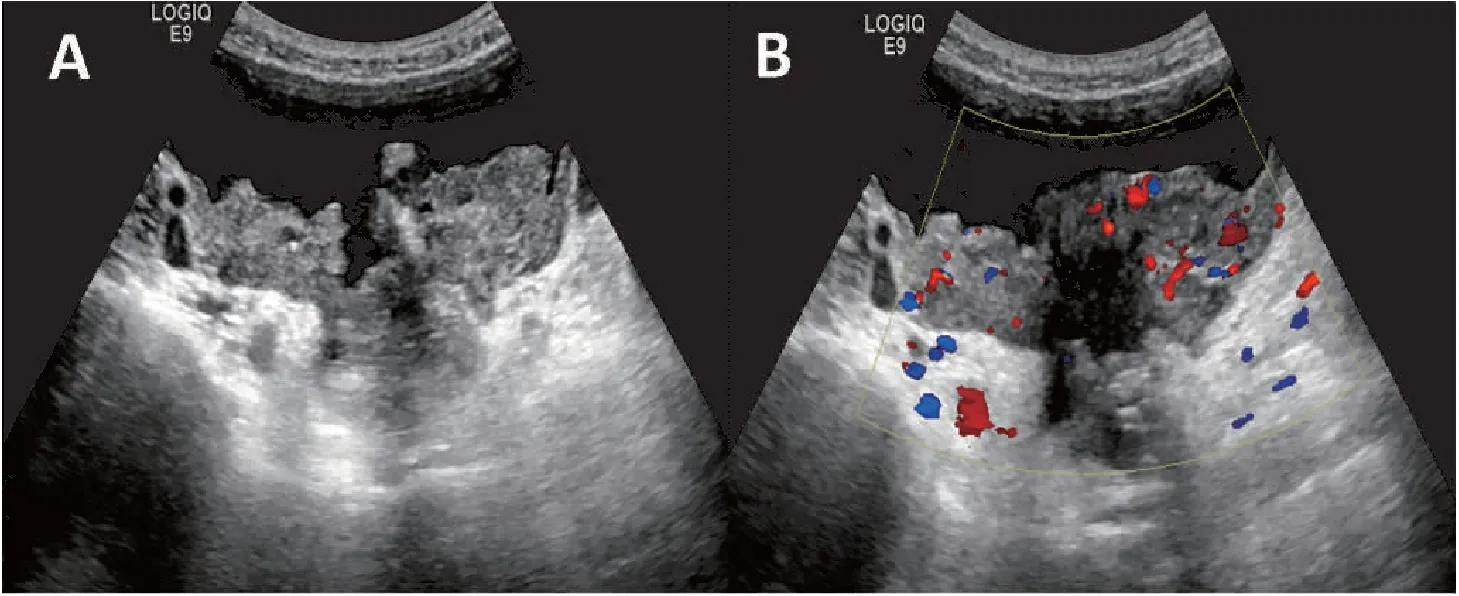
圖2 漿液性惡性腫瘤超聲聲像圖
2.2 IOTA簡易標準、GI-RADS及RMI4診斷效能
IOTA簡易標準診斷良性腫瘤176例,惡性腫瘤92例,不確定類31例,適用率89.63%。IOTA簡易標準、GI-RADS及RMI4預測卵巢良惡性腫塊的效能見表2。IOTA簡易標準的敏感度與準確度均高于GI-RADS,差異有統計學意義(χ2=5.860,P=0.015;χ2=7.650,P=0.006),特異度、陽性預測值及陰性預測值差異無統計學意義(χ2=2.276,P=0.131;χ2=2.599,P=0.107;χ2=5.465,P=0.019);IOTA簡易標準的敏感度、陽性預測值、陰性預測值及準確度均高于RMI4,差異有統計學意義(χ2=20.415,P<0.017;χ2=6.841,P<0.017;χ2=16.897,P<0.017;χ2=22.643,P<0.017),特異度差異無統計學意義(χ2=4.702,P=0.030);GI-RADS的敏感度高于RMI4,差異有統計學意義(χ2=5.939,P=0.015),特異度、陽性預測值、陰性預測值及準確度差異無統計學意義(χ2=0.517,P=0.472;χ2=1.220,P=0.269;χ2=4.336,P=0.037;χ2=5.050,P=0.025)。
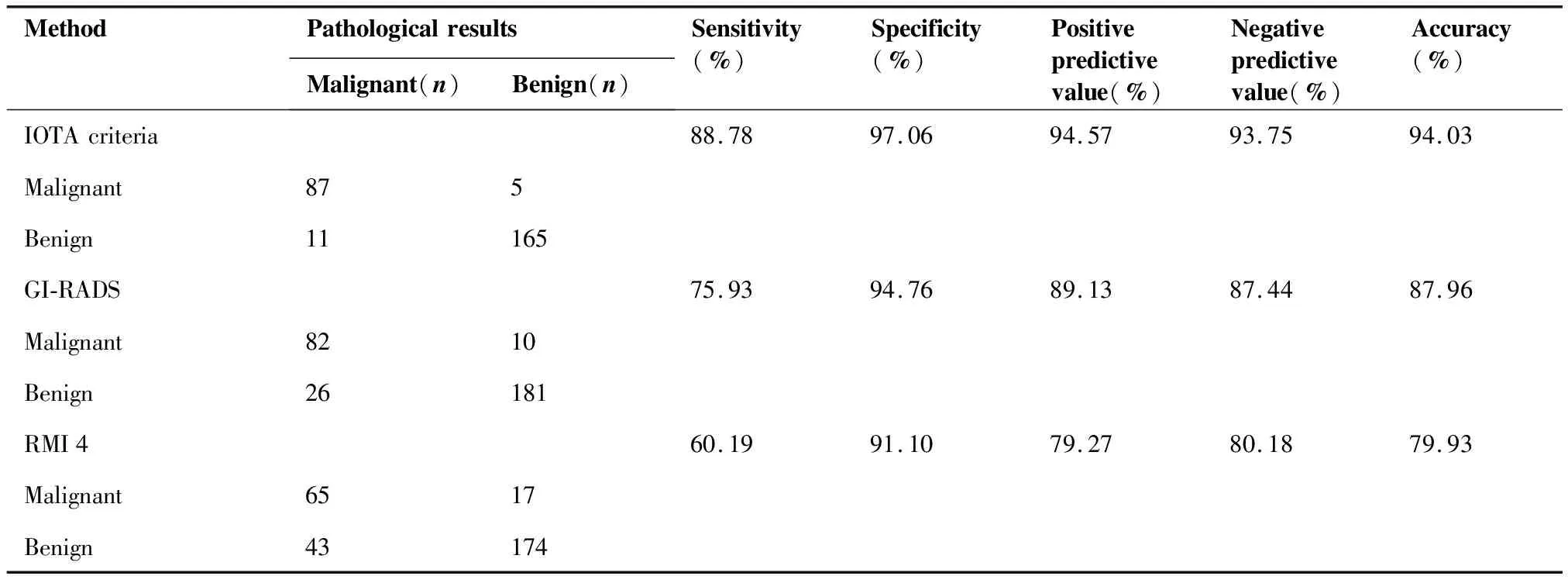
表2 IOTA簡易標準、GI-RADS與RMI4診斷卵巢腫瘤良惡性的效能(%)
3 討 論
卵巢癌早期癥狀不典型,大約70%~75%的患者發現時已為晚期,5年生存率僅約28%[10]。早期準確診斷卵巢腫瘤良惡性是保證患者獲得最優化治療方案以改善預后的關鍵。研究表明,超聲鑒別診斷卵巢腫瘤良惡性的最優方法是經驗豐富超聲醫師的主觀評估[11]。然而對于附件腫塊的評估,即使經驗豐富的超聲醫師也有誤判的可能,此時應用各客觀高效預測模型輔助鑒別診斷非常必要。目前,已經提出了多種預測模型用于附件腫塊鑒別診斷,主要有RMI評分、ADNEX模型、Logistic回歸模型、IOTA簡易標準及GI-RADS等。本研究旨在對比目前較常用的RMI4、IOTA簡易標準與GI-RADS三者鑒別診斷附件腫塊良惡性的臨床價值。
IOTA簡易標準是國際卵巢腫瘤研究組提出的基于超聲聲像圖特征的預測模型,其對超聲聲像圖定義明確,診斷客觀、高效簡便,即使低年資醫師也可依據腫塊的大小、血流、囊實性區等聲像圖信息進行評估[12]。本研究記錄分析了IOTA提出的診斷標準,卵巢良惡性組差異均有統計學意義(P<0.05)。本研究中IOTA簡易標準適用率為89.63%(268/299),與Fathallah等[13]研究結果一致,但高于孟璐等[14]報道的適用率(80.2%),這可能與因為本組研究惡性病例比例相對較高有關。Koneczny等[15]研究顯示,高年資超聲醫師預測卵巢腫瘤良惡性的敏感性85.9%,特異性96.9%,本研究IOTA簡易標準診斷了268例腫瘤,敏感性88.78%,特異性97.06%,與其結果類似,說明兩者診斷效能相當。陳念等[16]研究也提到了IOTA簡易標準與高年資醫師主觀評估診斷效能類似且均較高。但IOTA簡易標準局限性在于診斷結果中存在11%~24%不確定類[4,6],當無法做出良惡性診斷時,需結合高年資醫師主觀評估或GI-RADS與RMI4等其他客觀預測模型[15]。
借鑒乳腺影像報告與數據系統(breast imaging reporting and data system, BI-RADS),Amor等[17]學者提出的評估附件腫瘤的GI-RADS分類系統具有簡便易行、客觀高效及規范超聲報告等優點。但本研究結果顯示,相比于IOTA簡易標準,GI-RADS鑒別良惡性腫瘤效能相對較低,這與先前多項研究結果基本一致[15,18]。首先,這可能歸因于GI-RADS預測卵巢腫瘤良惡性對超聲醫師的經驗有一定的依賴性,而IOTA簡易標準不涉及超聲醫師主觀評估;劉婧等[19]研究結果顯示,GI-RADS在高年資組醫師的診斷效能優于低年資組醫師(P<0.05),IOTA簡易標準診斷效能在不同年資超聲醫師之間差異不明顯(P>0.05)。其次,GI-RADS存在較高的假陽性率,這一現象與GI-RADS 4類腫塊惡性風險(5%~20%)范圍較大、4類腫瘤分類困難有關,Amor等[20]研究報道了4類腫塊中高達近80%的假陽性結果;如本研究中部分實性或以實性為主的性索間質類腫瘤被誤診。因此,這在一定程度上限制了GI-RADS預測卵巢良惡性腫瘤的診斷效能。近年有學者提出的按惡性腫瘤風險程度將GI-RADS 4類腫塊分為4a、4b及4c類3個亞分類[21-22],以降低4類腫塊假陽性率并提高其特異性,但還需大樣本、多中心研究探索。
RMI4是一種基于絕經狀態、超聲特征、腫瘤大小和血清CA125水平的簡單評分方法,目前應用較廣泛,但其診斷效能有限[7]。本研究結果顯示,與GI-RADS、IOTA簡易標準相比,RMI4鑒別診斷卵巢良惡性腫塊的效能較低,與黃冰冰和Koneczny等[7,15]的研究結果一致。主要原因有:1)RMI4中的超聲評價指標實性區域、多房、雙側性及腹水等聲像圖特征也常見于良性腫瘤,如本研究中1例成熟型畸胎瘤表現為以實性為主的囊實混合回聲,3例纖維瘤合并有腹水;2)由于卵巢良惡性腫瘤組織病理學的差異,其兩組病變在血管數目、分布、走形及灌注狀態等方面存在顯著不同;有研究[16]顯示卵巢惡性病變血管分布常呈中心型、且走形不規則,血流豐富,多為低阻力指數動脈血,而良性腫瘤新生血管形成較緩慢,分布多周邊型,以靜脈血為主,血供稀疏,本研究卵巢良惡性病變超聲表現符合上述特征。因此,RMI4超聲評價指標未涉及病變血流信息,影響了其診斷效能;3)RMI4診斷主要依賴于CA125水平,但其往往缺乏特異性。CA125指標在交界性腫瘤、早期侵襲性卵巢癌和低度惡性腫瘤中通常正常[23],而在許多良性腫瘤或盆腔炎的情況下(例如子宮內膜異位癥、卵巢囊腫、早期妊娠和手術等)呈假陽性增高[24],這降低了其特異度。因此,RMI4診斷卵巢良惡性腫瘤的效能有限。
綜上,IOTA簡易標準、GI-RADS與RMI4對鑒別卵巢良惡性腫塊均有重要臨床價值,其中IOTA簡易標準診斷效能最優。但IOTA簡易標準不適用于所有卵巢腫瘤評估,當判斷結果不確定時,需結合GI-RADS、腫瘤標記物及臨床等進行綜合分析,以提高診斷效能。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

