共載吳茱萸堿及磷酸氯喹復方脂質體的制備及乳腺癌抗癌效果初步研究*
楊成莉,文志鵬,李明,鄭志昌
550000 貴陽,貴州醫科大學附屬醫院 藥劑科
2020年全球乳腺癌新發病例高達226萬例,已成為威脅女性健康的第一大癌[1]。化療仍然為其主要治療方法之一,但效果不盡理想,原因之一是缺乏適當的載體將化療藥物準確、高效地輸送至癌癥部位發揮殺死癌癥細胞的作用。因此,研究優良載體以包載化療藥物實現有效遞送,對提高化療藥物治療作用具有重要意義[2]。
吳茱萸堿(evodiamine,EVO)為色胺吲哚類生物堿,是中藥吳茱萸的主要活性成分[3-4]。現代藥理學研究結果表明,其可調控NF-κB、P53蛋白表達,具有抗癌作用[5]。Zhu等[6]研究發現EVO能用于抑制ER陽性/陰性乳腺癌細胞的增殖。磷酸氯喹(chloroquine,CQ)具有抑制細胞自噬的作用使它成為抗腫瘤的熱點,普遍認為其是通過阻斷自噬體與溶酶體融合過程發揮自噬抑制機制的;除此之外,CQ能調控抑瘤蛋白P53,增強化療藥物抗癌活性[7-8]。已有研究表明,在化學藥物治療晚期,基于細胞自我修復機制,腫瘤細胞過度激活自噬機制,進行受損細胞自體修復,降低化療效果[9]。因此,聯合使用自噬抑制劑,抑制腫瘤細胞晚期自噬上調,或可起到協同抗腫瘤的效果。
基于以上理論研究基礎,本研究擬將磷酸氯喹與吳茱萸堿用于聯合抗腫瘤。但是,EVO是脂溶性藥物,水溶性小,體內生物利用度低;而CQ為抗瘧疾藥物,對正常組織細胞也有較強的殺傷作用。因此,如何將EVO、CQ高效準確地遞送入腫瘤部位成為本研究所要解決的關鍵問題,而藥物載體的設計為其帶來契機。為了增加藥物在癌癥血管部位的累積,目前最常用的制劑學手段是設計納米給藥系統,實現化療藥物靶向遞送[9-10]。脂質體是由類脂雙分子層形成的微型泡囊體,可同時將親水及親油的物質包載于其中,故本研究擬將CQ及EVO共同包載于脂質體內,制備吳茱萸堿及磷酸氯喹復方脂質體,作用于乳腺癌細胞,利用兩者均具有抗癌活性藥理作用,協同殺死腫瘤細胞,使治療作用更加迅速、高效。
1 材 料
1.1 儀器
SW-CJ-2F超凈工作臺(蘇凈集團安泰公司),BB15細胞培養箱(美國Thermo 公司),IX73-U倒置熒光顯微鏡(日本Olympus公司),ELX800通用酶標儀(美國Bio-tek公司),RE-2000A旋轉蒸發儀(上海亞榮生化儀器廠),G16W高速離心機(長沙湘智離心機儀器有限公司),超聲波細胞破碎儀(寧波新芝生物科技股份有限公司),720型紫外分光光度計(北京普析通用儀器有限公司),超聲波細胞破碎儀(寧波新芝生物科技股份有限公司)。
1.2 試劑
膽固醇(cholesterol,CHOL;批號:111618-200301,美侖生物)、氫化大豆卵磷脂(lecithin hydrogenated,HSPC;批號:525600-2130493-01,美侖生物)、吳茱萸堿(批號:PS0075-0025,成都普思生物科技有限公司)、磷酸氯喹(批號:100421-200401,索萊寶生物試劑有限公司)、四甲基偶氮唑藍(MTT,批號:CO41004,美國Sigma公司),二甲基亞砜等常規試劑(DMSO,分析純,天津市科密歐化學試劑有限公司)。
1.3 細胞株
人體胚胎腎細胞HEK293由四川大學生物治療國家重點實驗室友情提供,人乳腺癌細胞MCF-7購自武漢普諾賽生命科技有限公司。
2 方 法
2.1 含量測定方法
2.1.1 測定波長 精密稱取干燥至恒重的EVO及CQ原料藥0.25 mg及5 mg,加1 mL甲醇溶解后,置于100 mL溶量瓶中,加蒸餾水稀釋至刻度,搖勻,制成質量濃度為2.5 μg/mL的EVO及2.5 μg/mL的CQ對照品溶液。以蒸餾水為空白溶劑對照,在200~600 nm范圍內進行波長掃描,結果表明在EVO在λ=225 nm,CQ在λ=343 nm處有最大吸收峰[11-12];分別取破乳后的空白脂質體溶液,破乳后EVO-CQ-Lips脂質體溶液同法掃描,結果表明樣品溶液同樣在225 nm及343 nm處分別有最大吸收,而空白脂質體溶液在該兩個波長處無吸收,說明輔料和溶劑對藥物測定沒有干擾。
2.1.2 標準曲線繪制 精密稱取一定質量的EVO并用容量瓶精密配置濃度為1.0、1.5、2.0、2.5、3.0 μg/mL。用720型紫外分光光度計在λ=225 nm測定其吸光度(A值),以吸光度A值對濃度(C)線性回歸,得回歸方程:A=0.1744C+0.0504(R2=0.9991),結果表明EVO質量濃度在1.0~3.0 μg/mL范圍內與吸光度線性擬合度較好。
精密稱取一定質量的CQ并用容量瓶精密配置濃度為10.0、15.0、20.0、25.0、30.0 μg/mL。用720型紫外分光光度計在λ=343 nm測定其吸光度,以吸光度A值對濃度C線性回歸,得回歸方程:A=0.0212C+0.0962(R2=0.9994),結果表明CQ質量濃度在1.0~3.0 μg/mL范圍內與吸光度線性擬合度較好。
2.1.3 精密度實驗 日內精密度:分別對EVO(1.0、2.0、3.0 μg/mL)及CQ(10.0、20.0、30.0 μg/mL)于一天內平行測定5組吸光度,計算吸光度的相對標準偏差(relative standard deviation,RSD)(%),EVO、CQ吸光度的日內精密度RSD<5.0%,結果表明EVO、CQ的日內精密度良好。
日間精密度:分別對EVO(1.0、2.0、3.0 μg/mL)及CQ(10.0、20.0、30.0 μg/mL)于1、2、3、4、5天內平行測定5組吸光度,計算RSD(%),EVO、CQ吸光度的日內精密度RSD<5.0%,結果表明EVO、CQ的日內精密度良好。
2.1.4 加樣回收率實驗 采用加樣回收試驗法進行回收率計算,具體操作方法如下:分別取不同濃度EVO(1.0、2.0、3.0 μg/mL)及CQ(10.0、20.0、30.0 μg/mL)各1.0 mL與已知含量樣品溶液濃度0.5 mL進行混合,進行回收率(%)的計算,加樣回收率(%)=(實測值-已知量)/理論加入量×100%。結果測得EVO、CQ的回收率(%)在95%~105%之間,本法測定EVO、CQ的包封率準確度良好。
2.2 EVO-CQ-Lips的制備
2.2.1 EVO-Lips的制備 采用乳化溶劑揮發法結合薄膜分散法制備EVO-Lips,按處方比例稱取EVO、HSPC、CHOL,用適量有機溶劑超聲溶解后加入20 mL圓底燒瓶中,在減壓旋轉蒸發儀上進行旋蒸除去有機溶劑氯仿使其形成穩定的脂質體膜。將制備好的脂質體膜加入1.5 mL的硫酸銨緩沖溶液進行水合1 h,水合1 h后轉移至4 mL EP管中,用超聲波細胞破碎儀超聲(變幅桿先用ddH2O超聲30 s,再通無水乙醇超聲30 s,超聲脂質體時按處方設置超聲功率、超聲時間、時間設置為超聲5 s停頓5 s)。
2.2.2 EVO-CQ-Lips的制備 硫酸銨梯度法[13]:超聲完成后加入到透析袋中用PBS溶液(pH 7.4)進行透析12 h,透析介質為0.01 mol PBS緩沖液1 L。透析12 h后加入200 μL CQ儲備液(濃度為50 mg/mL)65 ℃在恒溫水浴鍋上孵育30 min,即可得到EVO-CQ-Lips。
2.2.3 EVO-CQ-Lips處方篩選 按照上述方法,以脂質體中EVO、CQ粒徑、外觀形態、包封率載藥量為指標,對影響因素包括乳化有機溶劑、脂質配比、硫酸銨溶液濃度、超聲功率采用單因素結合正交設計進行處方篩選。
2.3 EVO-CQ-Lips表征
2.3.1 粒徑分布考察 利用馬爾文激光散射粒度儀測定EVO-CQ-Lips的粒徑、多分散系數(polydisperity index,PDI),取1 mg/mL的EVO-CQ-Lips的樣品溶液,加入粒徑比色皿及電位杯中進行檢測,25 ℃下,重復測定3次。并且重復3次平行實驗。
2.3.2 外觀形貌測定 采用磷鎢酸負染法[14]:按最優處方制備EVO-CQ-Lips,雙蒸水重懸后,滴至專用銅絲上,靜置風干后,再滴加2%(w/v)磷鎢酸負染2 min,于透射電子顯微鏡下觀察其外觀形態。
2.3.3 包封率測定 采用超速離心法測脂質體包封率,取制備好的脂質體混懸液,于0.8 μm濾頭過濾除去未包封于脂質體的EVO及CQ,將過濾后的脂質體溶液加入1.5 mL離心管中,以13 000 rpm離心90 min,收集脂質體,加入適量甲醇超聲破乳,用 PBS 稀釋定容至適當濃度后測定吸光度,計算脂質體中藥物含量為WEVO及WCQ,設總投藥量為MEVO,MCQ。按下式計算包封率:EE%=WEVO/CQ/MEVO/CQ×100%。用甲醇消解EVO-CQ-Lips,使其釋放出已經包封的EVO及CQ,采用紫外分光光度計在[λmax(EVO)=225 nm和λmax(CQ)=343 nm]分別測定EVO、CQ的包封率,根據測出的粒徑和包封率篩選出最優處方。超速離心法加樣回收率考察: 精密稱取EVO、CQ原料于量瓶中,甲醇溶解后,加蒸餾水稀釋成濃度EVO為1.0、2.0、3.0 μg/mL,CQ為10.0、20.0、30.0 μg/mL的溶液,分別取不同質量濃度藥物溶液 0.1 mL 與 0.2 mL 空白脂質體混勻,同上方法離心處理加入到超濾管中,離心超濾后收集濾液,稀釋后測定吸光度,計算回收率。
2.3.4 EVO-CQ-Lips穩定性及體外釋放研究 穩定性:按最優處方制備脂質體8份,均分為A、B兩組,A組靜置于4 ℃、B組靜置于室溫條件下,于制備好脂質體后的0、0.5、1、2、4、8、16、28、32日時用粒度儀測定其粒徑(nm)。體外釋放:最優處方制備脂質體在1 mL PBS溶液(A組用pH 4.0、B組用pH 7.4)重懸后放置于37 ℃、120 rpm的恒溫搖床中。在預設時間點(0 h、0.5 h、2 h、4 h、6 h、18 h、1 d、2 d、4 d、7 d、14 d、21 d、28 d)將釋放介質全部取出,并立即補以預熱的相同體積對應pH的新鮮釋放介質。采用UV-vis 法在225 nm、343 nm波長處測定樣品中的EVO及CQ的含量,計算各樣品累計釋放率并以釋放率及對應時間制作釋放曲線。
2.4 EVO-CQ-Lips體外毒性研究
以人腎胚細胞HEK293細胞為正常細胞研究模型,采用MTT法檢測EVO-CQ-Lips對正常細胞殺傷作用。具體來說,取對數生長期的HEK293細胞以每孔4 000個的密度接種于96孔細胞培養板中,放入CO2孵箱24 h后吸棄原有培養基,然后依次加入系列濃度藥EVO-CQ-Lips培養基溶液200 μL,同時加入全培養基作為空白對照組,繼續培養48 h后,加入20 μL MTT溶液(5 mg/mL),于4 h后從孵箱中取出96孔板中,將其液體吸出,加入150 μL的二甲基亞砜溶液后立即用酶標儀于570 nm測定其吸光值。
2.5 EVO-CQ-Lips細胞體外抗腫瘤活性研究
2.5.1 MTT檢測EVO-CQ-Lips對MCF-7細胞增殖抑制作用 采用MTT法測定EVO-CQ-Lips體外抗MCF-7增殖作用。取對數生長期的MCF-7細胞以3500個/孔接種于96孔板中,放入CO2孵箱24 h后吸棄原有培養基,然后依次加入系列濃度藥EVO-CQ-Lips以及其對應濃度的游離EVO和CQ,以及游離EVO聯合CQ藥物培養基溶液200 μL,同時加入全培養基作為空白對照組,繼續培養48 h后,加入20 μL MTT溶液(5 mg/mL),于4 h后從孵箱中取出96孔板中,將其液體吸出,加入150 μL的二甲基亞砜溶液后立即用酶標儀于570 nm測定其吸光值。
2.5.2 細胞活死染色對MCF-7細胞毒性作用考察 取對數期生長MCF-7細胞,以8×104/孔接種于24孔細胞培養板,24 h后加入終濃度梯度的EVO-CQ-Lips的納米粒細胞培養液0.05、5、100 μM。每個濃度設置三個復孔,同時加入全培養基作為空白對照組,24 h后加入配制好的Calcein-AM/PI染液。37℃孵育30 min,吸棄染色工作液,終止孵育,加入10 μL抗熒光淬滅封片液,復以細胞爬片,中性樹脂封片,于490 nm激發波長下觀察黃綠色活細胞,并于545 nm處激發波長下觀察紅色的死細胞。
3 結 果
3.1 EVO-CQ-Lips最優處方確定
3.1.1 乳化溶劑篩選 采用乳化溶劑揮發法結合薄膜分散法制備脂質體,首先對乳化溶劑進行篩選,選擇成膜較好且均勻,真空減壓旋蒸不起泡的溶劑作為處方溶劑,乳化溶劑篩選結果見表1。結果表明,以氯仿作為成膜溶劑為最優選項。
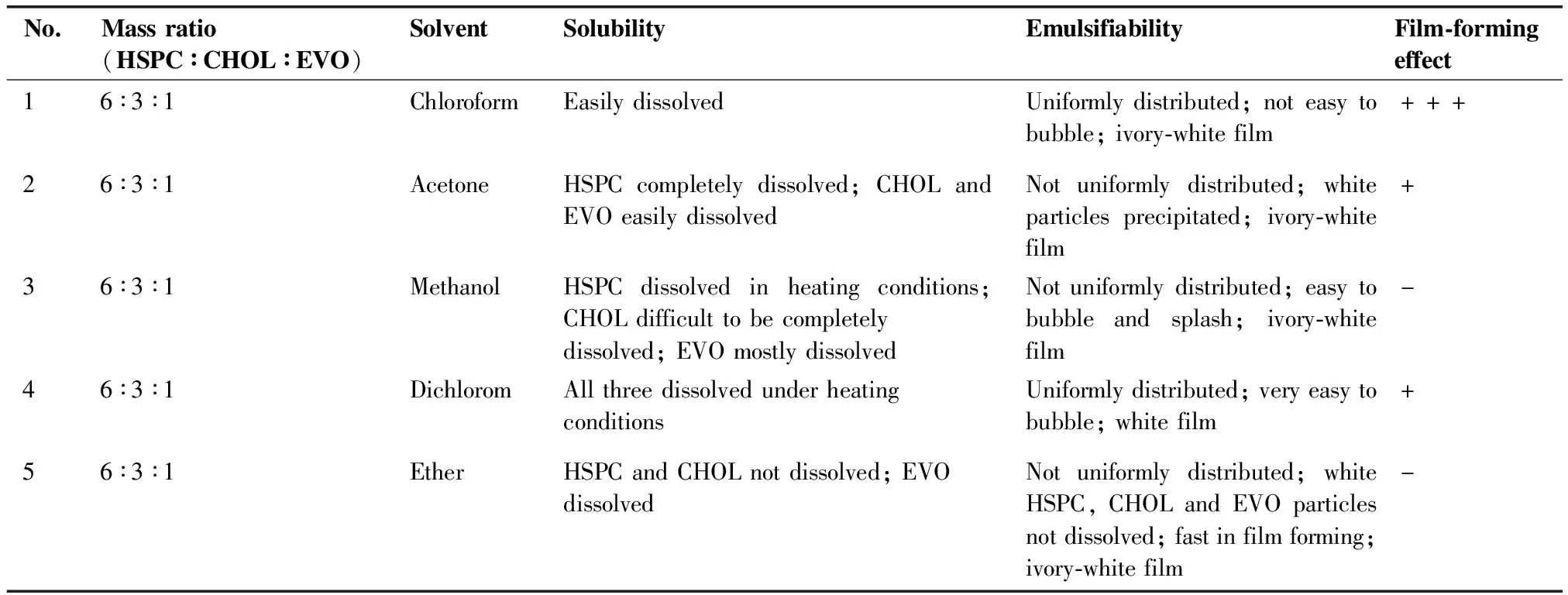
表1 處方溶劑篩選
3.1.2 最優處方比例篩選及結果 通過單因素處方篩選方法,以氫化大豆卵磷脂∶膽固醇∶吳茱萸堿(HSPC∶CHOL∶EVO)比例、超聲功率(%)、硫酸銨濃度(pH 4.5)為影響因素,探討其對膽固醇和氫化大豆卵磷脂影響粒徑(nm)、包封率(%)的影響。以基本處方HSPC∶CHOL∶EVO取6∶3∶1、硫酸銨濃度(pH 4.5)3 M、超聲功率40%為基準,孵育溫度65 ℃、超聲時間3 min為固定值,結果如表2所示。
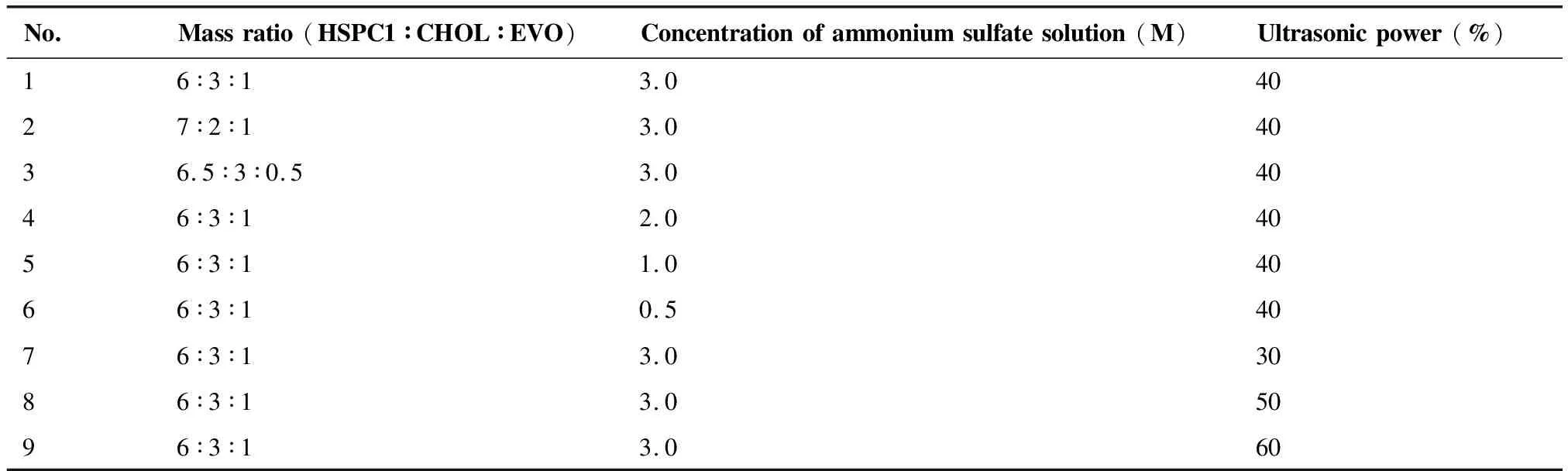
表2 處方篩選指標
以氯仿為處方溶劑、按處方比例制備了1~9個處方的EVO-CQ-Lips,測定其粒徑(nm)、PDI、EVO包封率(EE%)、CQ包封率(EE%),結果如表3所示。
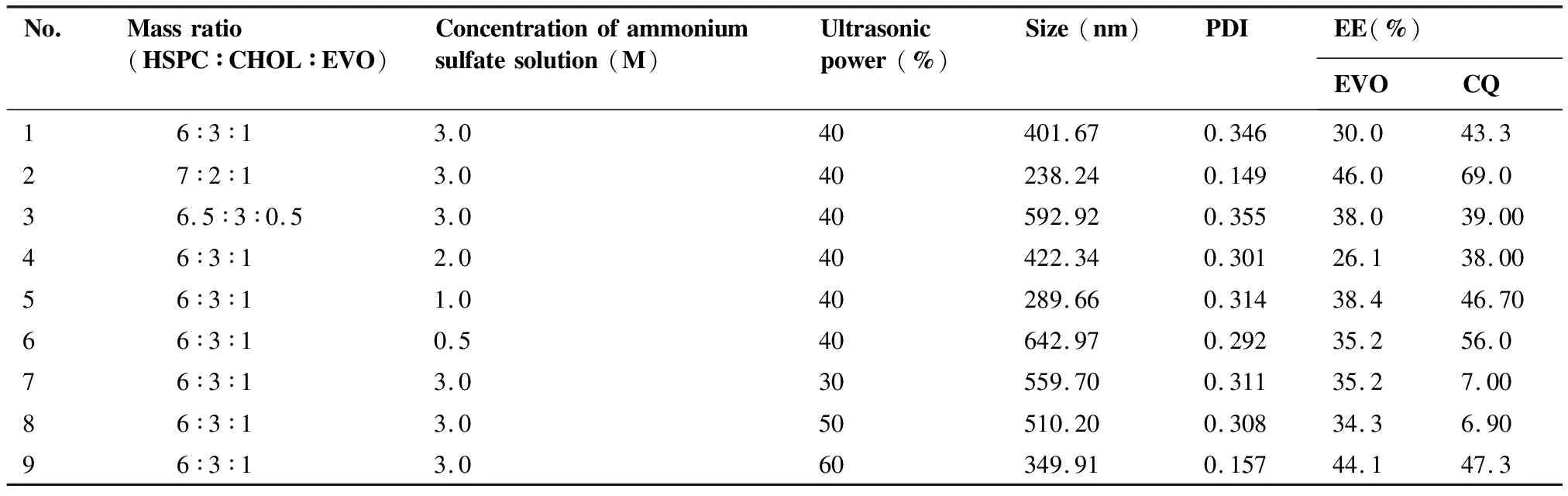
表3 處方篩選
綜合以上9個處方的結果可見,我們選擇了HSPC∶CHOL∶EVO為7∶2∶1、硫酸銨濃度(pH)為1 M、超聲功率為40 %為最優處方配比,所制備最優處方制備納米粒,粒徑、電位及包封率如表4。

表4 最優處方納米粒特征
3.2 EVO-CQ-Lips表征
3.2.1 EVO-CQ-Lips的形態粒徑及分布測定 粒徑分布:采用粒度儀測定其粒徑(nm)及分布,粒度分布如圖1所示。由結果可見,最優處方所制備EVO-CQ-Lips粒徑在(170±6.24)nm,其粒度分布較為均勻,PDI為0.21±0.05。TEM形態考察:透射電子顯微鏡下觀察其外觀形態。結果如圖2所示。
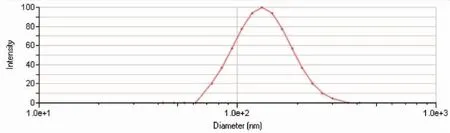
圖1 最優處方的粒徑(nm)
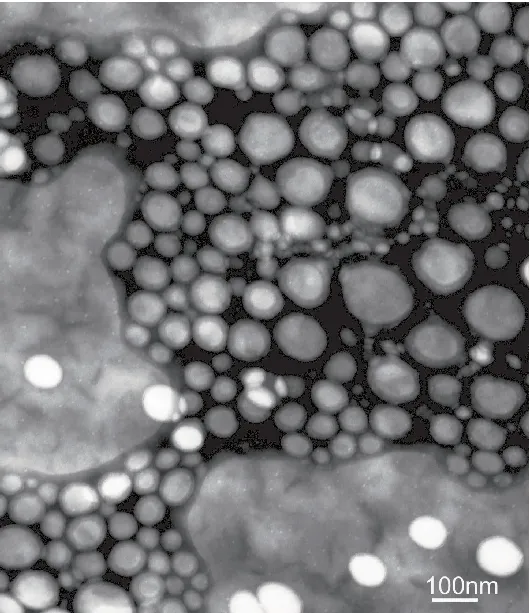
圖2 EVO-CQ-Lips的TEM
由圖可見,EVO-CQ-Lips呈光滑類球形且分散較不均勻,EVO-CQ-Lips由于包裹了一層膽固醇和大豆磷脂酰膽堿成分,故呈不規則類球形;由于外殼連接一層CQ親水層,可見一層顏色較深的陰影層,因膽固醇含量較高,形態較穩定。
3.2.2 EVO-CQ-Lips中EVO、CQ包封率測定 EVO的超濾離心法平均回收率可達97.4%,CQ可達98.1%,且RSD<5%,因此包封率的測定可采用超速離心法。所測得包封率為EE(EVO)%=60.03%,EE(CQ)%=76.31%。
3.3 EVO-CQ-Lips穩定性及體外釋放研究
3.3.1 穩定性考察 按最優處方制備脂質體8份,均分為A、B兩組,A組靜置于4 ℃、B組靜置于室溫條件下,于制備好脂質體后的0、0.5、1、2、4、8、16、28、32日時用粒度儀測定其粒徑(nm)。粒徑(nm)的穩定性結果如圖3所示。
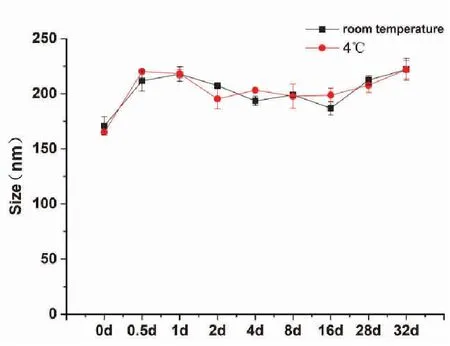
圖3 EVO-CQ-Lips 儲存穩定性考察(N=3)
最優處方脂質體在4 ℃和25 ℃條件下0~2 d時粒徑(nm)較為穩定,在2~8 d時有所波動但粒徑(nm)變化并不大,可能是因為90 plus PALS粒度儀趨于穩定,因而EVO-CQ-Lips在4℃和室溫儲存0~32 d穩定性都較為良好。
3.3.2 體外釋放結果考察 最優處方制備脂質體在1 mL磷酸鹽緩沖鹽溶液(A組:pH 4.0;B組:pH 7.4)重懸后放置于37 ℃、120 rpm的恒溫搖床中。在預設時間點(0 h、0.5 h、2 h、4 h、6 h、18 h、1 d、2 d、4 d、7 d、14 d、21 d、28 d)。釋放率曲線結果如圖4所示。
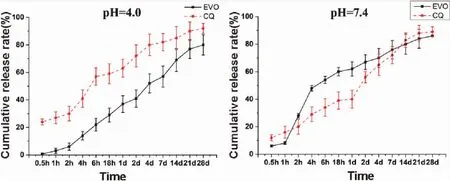
圖4 EVO及CQ在不同pH條件下釋放率比較(N=3)
體外釋放結果顯示在低pH時,CQ較EVO釋放快,而pH接近中性時兩者釋放速率相當,釋放率均能達到80%以上。
3.4 EVO-CQ-Lips體外毒性研究
納米粒細胞毒性檢測結果見圖5。由圖可見,隨著納米粒濃度增大,對HEK293細胞的抑制率升高,但是直到濃度增大到50 μM,細胞抑制率仍然低于20%,細胞存活率高于80%。因而,納米粒對正常細胞毒性較低,可較為安全地應用。
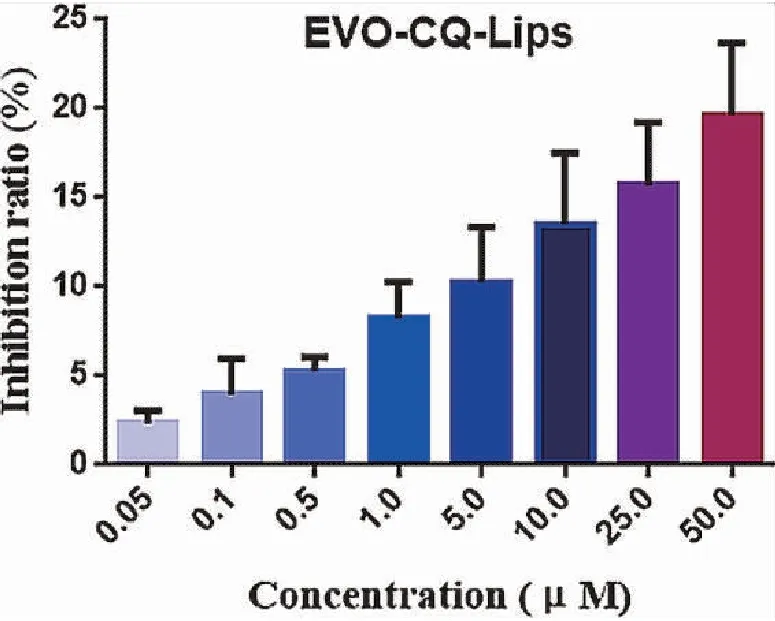
圖5 EVO-CQ-Lips毒性考察
3.5 EVO-CQ-Lips細胞體外抗腫瘤活性研究
結果如圖6所示,圖A顯示游離EVO對MCF-7細胞的生長有抑制作用,且當EVO濃度達到100 μM時,抑制率達到68%作用,由圖B顯示了游離CQ通過增強自噬對MCF-7細胞的生長也有一定抑制作用,且濃度在92 μM時,抑制率接近30%。圖C將聯合EVO以及EVO-CQ-Lips對應濃度CQ對MCF-7的抑制作用進行考察,結果顯示盡管在高濃度時聯合CQ對EVO的抑制作用沒有顯著影響,但是在較低濃度時,抑制作用較EVO單藥有顯著提高。圖D顯示EVO-CQ-Lips對MCF-7細胞的生長抑制作用顯著高于游離CQ聯合EVO組,差異具有統計學意義(P<0.05),并且在EVO為50 μM時,抑制作用即達到80%以上,并且EVO-CQ-Lips能達到EVO及CQ的協同遞送,更有利于體內應用,結果如表5所示。

圖6. MCF-7細胞長抑制率圖(N=6)
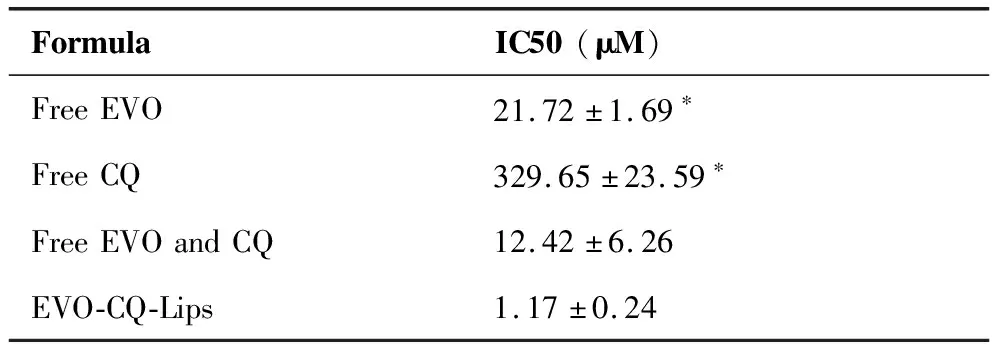
表5 游離EVO、游離CQ及EVO-CQ-Lips對乳腺癌細胞的IC50值(N=5)
結果表明,EVO-CQ-Lips較游離EVO及CQ具有更強的體外乳腺癌增殖抑制作用,可能與脂質體包載后顯著提高藥物溶解性有顯著關系。
3.6 細胞活死染色結果
由圖7可見,隨著納米粒藥物濃度增加,鈣黃綠素著色細胞量顯著減少,表明活細胞急劇減少,而PI著色的凋亡細胞核熒光逐漸增強,表明死細胞數量顯著增加。因而表明納米粒對MCF-7細胞具有顯著的殺傷作用。
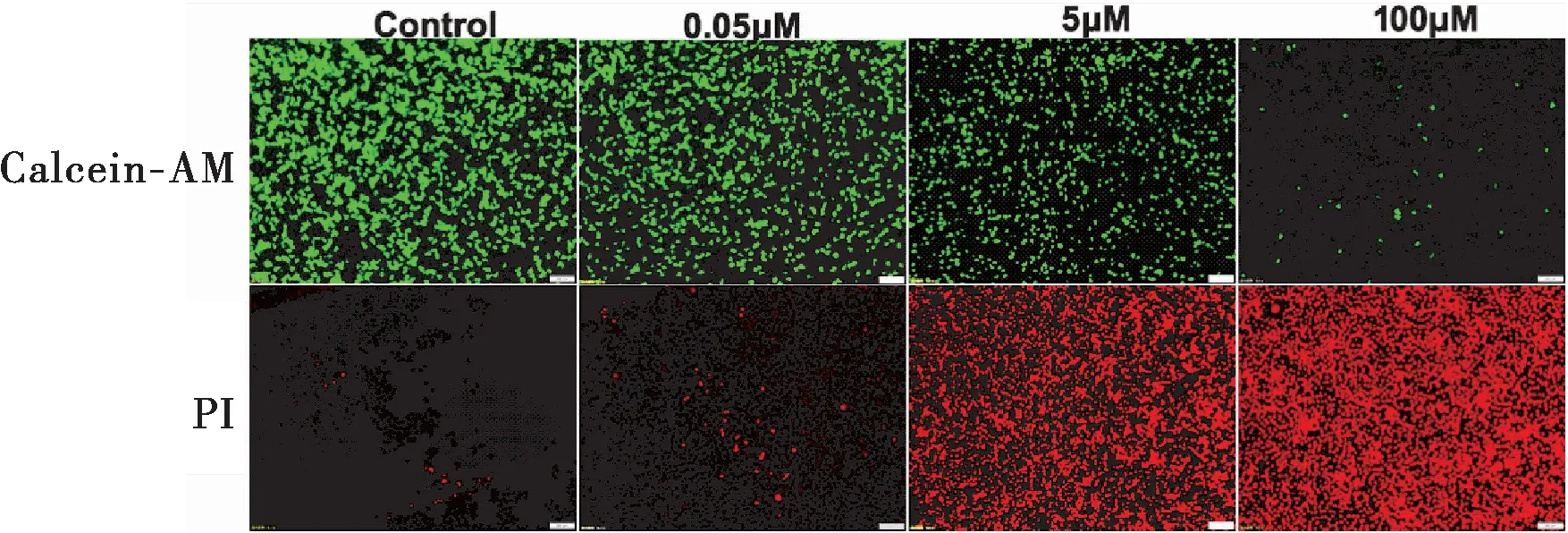
圖7 不同濃度EVO-CQ-Lips對MCF-7細胞活死染色結果
4 討 論
吳茱萸堿EVO具有保護心臟、抗炎、鎮痛、抗老年癡呆等藥理活性[15-16],現代藥理學研究結果則表明EVO具有抗癌作用[17]。現在普遍認為自噬在腫瘤發生發展中起促進和抑制的雙重作用,在晚期腫瘤細胞中自噬過度激活,抑制氧化應激,啟動細胞損傷修復作用,影響抗癌效果[18-19]。磷酸氯喹具有抑制細胞自噬的作用使它成為抗腫瘤治療研究的熱點[20-21]。
由于吳茱萸堿是難溶性藥物,水溶性低,體內生物利用度低,磷酸氯喹為水溶性藥物,但是其對正常細胞有一定損傷作用。故將其制備成脂質體利用其被動靶向修飾作用可以顯著提高吳茱萸堿生物利用度及降低磷酸氯喹毒性。
本研究采用薄膜分散法制備載吳茱萸堿脂質體,再通過硫酸銨梯度法將酸性磷酸氯喹主動包載于載吳茱萸堿脂質體內,制備共載吳茱萸堿及磷酸氯喹的復方脂質體。通過處方優化所制備最優處方粒徑為(170±6.24)nm,EVO的包封率為59.22%±4.52%、載藥量6.59%±1.38%,CQ的包封率為76.29%±1.02%、載藥量10.03%±0.31%;外觀形態由于脂質體囊泡而非實體納米球,故為不光滑類球形,體外穩定性及釋放性能良好;乳腺癌細胞體外增殖抑制試驗顯示該復方脂質體較單獨使用同濃度游離藥物對腫瘤細胞具有良好的殺傷效果。并且由人腎胚細胞HEK293毒性研究結果顯示,納米粒對正常細胞毒性較低,可在體內實現安全遞送。因此本研究成功制備載吳茱萸堿及磷酸氯喹脂質體,并獲得良好的體外抑瘤效果。該脂質體可共同包載CQ及EVO,提高兩者生物利用度,并且由于其粒徑<200 nm,可通過腫瘤高通透滯留效應,將EVO及CQ被動靶向遞送于腫瘤部位,有望在體內進一步獲得優異的治療效果,值得進一步研究。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

