一維TiO2銳鈦礦/金紅石異相結的制備及光催化降解甲醛性能
查鳳娟 劉 慶 王建友 林雨寒 王傳義 李英宣*,
(1陜西科技大學環(huán)境科學與工程學院,西安 710021)
(2榆林市榆神工業(yè)區(qū)能源科技發(fā)展有限公司,榆林 719302)
甲醛(HCHO)已被世界衛(wèi)生組織認定為致癌和致畸性物質,是現(xiàn)代室內空氣主要的氣體污染物之一。某些室內裝飾材料、家具、地毯等會持續(xù)釋放HCHO氣體,長期影響室內環(huán)境和人體健康[1-2]。因此,如何在室溫下高效去除空氣中的HCHO是解決HCHO污染問題的關鍵,也一直是當前氣體凈化研究領域關注的焦點。雖然金屬鉑(Pt)納米粒子可在室溫下活化空氣中的O2分子,快速將HCHO氣體轉變?yōu)闊o毒的二氧化碳(CO2)[3-5],但是Pt在自然界中的豐度較低、價格昂貴,限制了其規(guī)模化應用。
半導體光催化是以成本低廉、安全綠色的半導體為催化劑,直接利用自然光或人工光源在溫和條件下催化氧化還原反應的過程,在空氣及水體污染物處理、分解水制氫、CO2還原等環(huán)境和能源領域具有明顯的競爭優(yōu)勢[6-13],而利用光催化技術將空氣中的HCHO降解為無毒的CO2更是引發(fā)了人們的廣泛關注[14]。迄今為止,有超過100種光催化材料被報道[15],其中,二氧化鈦(TiO2)由于具有光催化活性強、化學穩(wěn)定性好、環(huán)境友好和成本廉價等優(yōu)點而成為光催化領域的研究焦點,也被廣泛地用于HCHO的光催化降解的研究中[16]。但是,傳統(tǒng)的TiO2制備方法仍然存在著反應溫度過高、合成中加入腐蝕性或有毒試劑、可控制備難以實現(xiàn)等問題,嚴重限制了TiO2光催化活性的進一步提高和大規(guī)模應用[17-19]。因此,低溫、可控、“綠色”制備TiO2仍然是一個挑戰(zhàn)。
TiO2主要有銳鈦礦、金紅石、板鈦礦3種晶型[20],其中銳鈦礦和金紅石均為四方結構,在光催化反應中應用最為廣泛[21]。研究發(fā)現(xiàn)純相TiO2電荷分離的效率低,光催化活性不能夠滿足實際應用的需求[22]。目前通常采用金屬摻雜[23]、半導體復合[24]、金屬負載[25]、形貌與晶面調控[26]、異相結構建[27]等手段提高TiO2的光催化活性。其中異相結的構建被認為是一種低成本、簡單、有效地提高TiO2光催化活性的方法[28-30],其原理是將同一種半導體的2種物相進行復合,當2種不同的物相緊密接觸時就會形成異相結。由于2種物相能帶結構的差異會在異相結的兩側形成空間電勢差和內建電場,從而加速光生電子-空穴對的分離,進而提高半導體的光催化活性。李燦等通過將銳鈦礦相TiO2沉積到金紅石相表面構建了銳鈦礦/金紅石異相結,并發(fā)現(xiàn)其光催化分解水制氫的效果得到顯著提高[31]。張曉東等通過高溫(600℃)煅燒合成的銳鈦礦/金紅石異相結TiO2在光催化降解氣態(tài)甲苯和液相四環(huán)素的過程中表現(xiàn)出較好的活性[32]。
除了構建異相結外,合理調控TiO2的形貌也被認為是一種提高其光催化活性的有效方法,其中一維(1D)納米結構的TiO2因具有高的比表面積、可控的結構和快速的電子傳遞速率等優(yōu)點,在光催化領域引起了研究者的廣泛關注[33]。目前,通過簡單、方便的方法構建一維納米TiO2異相結材料的報道還十分有限[34]。我們采用一步水熱法,在較低溫度下(180℃)成功制備出了一維TiO2銳鈦礦/金紅石異相結,并通過調節(jié)水熱時間實現(xiàn)了異相結中銳鈦礦和金紅石含量的調控。實驗結果表明,180℃下水熱24 h制備的TiO2在光催化氧化HCHO方面表現(xiàn)出了最佳的性能:在光強為12.26 mW·cm-2的365 nm LED燈照射下,120 mg·L-1HCHO氣體25 min內的降解率為92%。這種簡單、溫和制備一維TiO2異相結的方法為開發(fā)基于TiO2的廉價、高效光催化材料提供了新思路。
1 實驗部分
1.1 試劑與儀器
1.1.1 實驗試劑
實驗所用化學藥品均為分析純。二(2-羥基丙酸)二氫氧化二銨合鈦(C6H18N2O8Ti)購自成都化夏化學試劑有限公司,無水乙醇購自天津市天力化學試劑有限公司,HCHO購自阿達瑪斯試劑有限公司。
1.1.2 實驗儀器
主要儀器:在線光聲紅外多氣體監(jiān)測儀(INNOVA Air Tech Instruments model 1412);X 射線衍射儀(XRD,德國Bruker,D8-advance,Cu Kα射線,λ=0.154 18 nm,工作電流為30 mA,工作電壓為40 kV,掃描角度為20°~80°);掃描電子顯微鏡(SEM,日本Hitachi公司,S4800,電子槍為冷場發(fā)射電子源,加速電壓為0.5~30 kV);透射電子顯微鏡(TEM,日本電子公司出產(chǎn)的JEOLJEM-2100F,加速電壓為200 kV);物理吸附儀(美國麥克默瑞提克儀器有限公司,ASAP 2460);紫外可見漫反射(日本島津公司,UV-2600);電化學工作站(上海辰華公司,CHI660E);光催化反應釜。
1.2 催化劑的制備
室溫下,在100 mL聚四氟乙烯內襯中加入70 mL去離子水,再加入2 mL C6H18N2O8Ti,攪拌30 min,接著將該內襯裝入水熱反應釜內,放入烘箱中,于180 ℃下分別水熱反應10、14、24、36 h,然后取出冷卻至室溫后倒去上清液,樣品用無水乙醇和去離子水各洗滌3次,最后置于60℃恒溫干燥箱中烘干,即可得到一維TiO2異相結催化劑。不同時間制備的催化劑分別記為TiO2-10、TiO2-14、TiO2-24和TiO2-36。
1.3 電化學測試及光催化降解HCHO性能測試
采用典型的三電極體系(飽和甘汞電極、鉑網(wǎng)以及涂有催化劑的導電玻璃分別作為參比電極、對電極和工作電極,0.5 mol·L-1Na2SO4溶液為電解液),在帶有石英窗口的電解池中測量光電流響應值(以波長為365 nm的LED燈作為光源)和電化學阻抗譜。
光催化降解HCHO實驗是在密閉的不銹鋼反應器(帶有石英窗口)中進行,反應器體積約為300 mL,光源為100 W的365 nm LED燈。將0.25 mg樣品與5 mL超純水充分混合后,均勻旋涂在玻璃片上,再在60℃的烘箱中干燥后置于反應器中。用微量進樣器向反應器中注入氣態(tài)HCHO和O2的氣體混合物(氣態(tài)HCHO是由固體HCHO在120℃下進行揮發(fā)得到的),然后在磁力攪拌器的不斷攪拌下進行HCHO氧化的性能測試。在循環(huán)實驗之前將反應后的TiO2粉末在100℃下加熱60 min,去除吸附的HCHO分子,再重復進行HCHO催化氧化實驗。HCHO的起始濃度為120 mg·L-1左右,暗吸附30 min達到吸附-脫附平衡,然后開燈反應50 min。通過在線光聲紅外多氣體監(jiān)測儀測定HCHO濃度的變化。HCHO的降解率(η)用下式計算:

其中,c0為初始濃度,ct為實時濃度。
2 結果與討論
2.1 催化劑形貌結構分析
采用XRD對不同水熱反應時間制備的TiO2晶體結構進行了測定,結果如圖1所示,水熱不同時間得到的TiO2的XRD峰分別與標準卡片PDF No.21-1272(銳鈦礦相TiO2)和PDF No.21-1276(金紅石相TiO2)的位置相匹配,其中 2θ=25.3°、37.8°、48.1°、53.9°和62.7°的衍射峰分別對應銳鈦礦相TiO2的(101)、(004)、(200)、(105)和(204)晶面。而 2θ=27.4°、36.1°、41.2°、44.1°、54.2°、56.6°、64.0°和69.8°的衍射峰則分別對應金紅石相 TiO2的(110)、(101)、(111)、(210)、(211)、(220)、(310)和(112)晶面。XRD測試證明制備的TiO2是由銳鈦礦和金紅石兩相組成的混合相。對于制備的不同TiO2的異相結中不同相的含量可通過公式2進行計算[35-36]:

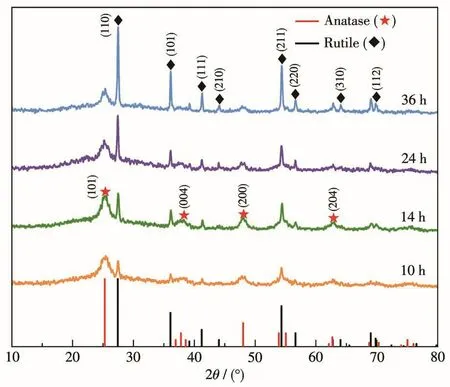
圖1 不同水熱時間下制備的TiO2的XRD圖Fig.1 XRD patterns of TiO2prepared at different hydrothermal times
其中 I1和 I2分別為 27.4°(金紅石相)和 25.3°(銳鈦礦相)的XRD峰強度,w1和w2分別為金紅石相TiO2和銳鈦礦相TiO2的質量分數(shù)。通過計算可知,在水熱反應 10、14、24和36 h的條件下,銳鈦礦相TiO2在TiO2-10、TiO2-14、TiO2-24和TiO2-36中的占比分別為51%、49%、33%和23%。如圖1所示,歸屬為金紅石相TiO2的衍射峰峰形尖銳,而歸屬為銳鈦礦相TiO2的衍射峰較寬,說明銳鈦礦相TiO2在異相結中的粒徑較小,其粒徑尺寸可以根據(jù)謝樂公式3計算:

其中,D為粒徑尺寸,λ為X射線波長(通常取0.154 nm),β為半峰寬(弧度),θ為相應的衍射角。計算得到銳鈦礦相TiO2納米粒子的平均粒徑為(9.5±0.5)nm。
為了研究TiO2催化劑的形貌和微觀結構,對TiO2-24進行了TEM測試。從圖2a的低倍TEM照片可以看出,制備的TiO2樣品是由整體分布比較均勻、表面略顯粗糙的一維納米棒構成,納米棒的長度為(400±50)nm,直徑為(60±5)nm。從放大后的TEM照片(圖2b)可以清楚地發(fā)現(xiàn)納米棒的表面均勻、高密度地負載了大量的納米顆粒,納米顆粒粒徑分布均一(約10 nm)。TiO2-24的高分辨透射電鏡(HRTEM)照片如圖2c所示,可以清楚地看到存在2組不同的晶格條紋,表面納米粒子的(紅色圈示意)晶格條紋間距為0.35 nm,對應銳鈦礦相TiO2的(101)晶面,說明納米粒子為銳鈦礦相TiO2,這一結果與XRD結果相符合。黃色矩形標記的晶格條紋間距為0.32 nm,對應金紅石相TiO2的(110)晶面[37],結合XRD的結果證明納米棒的主體為金紅石相TiO2,表面納米粒子的結構主要為銳鈦礦相TiO2,進一步證明了一維銳鈦礦/金紅石異相結的成功構建。通過圖2c還可以發(fā)現(xiàn),銳鈦礦相與金紅石相TiO2之間形成了緊密接觸界面,這為載流子的轉移提供了方便。此外,負載在一維納米棒上的銳鈦礦相納米粒子會增加材料表面的粗糙度,有利于入射光的散射,使材料對光的吸收增強,進而提高其光催化活性[38]。

圖2 TiO2-24的(a)低倍照片、(b)高倍TEM照片和(c)HRTEM照片F(xiàn)ig.2 (a)Low-magnification TEM image,(b)high-magnification TEM image,and(c)HRTEM image of TiO2-24
2.2 紫外可見漫反射吸收光譜
樣品的光吸收特性是影響光催化活性的一個重要因素,通過紫外可見漫反射吸收光譜研究了不同水熱時間制備的異相結TiO2光催化劑對光的吸收性能。從圖3中可以觀察到,所有異相結TiO2樣品在400 nm以內的紫外光區(qū)都有良好的響應。TiO2樣品的禁帶寬度通過經(jīng)驗公式4計算獲得[39]:

其中α是吸收系數(shù),hν是光子能量,A為常數(shù),Eg為半導體禁帶寬度。如圖3中插圖所示,通過外推切線,TiO2-10、TiO2-14、TiO2-24、TiO2-36曲線的橫截距(即樣品的帶隙值)分別為 2.79、2.75、2.75、2.78 eV,均低于文獻報道的塊狀TiO2(銳鈦礦為3.2 eV,金紅石為3.0 eV)[40]的帶隙值,這可能是因為一維TiO2銳鈦礦和金紅石異相結的成功構建,使樣品的能帶結構變窄[32]。該結果表明構建的一維TiO2銳鈦礦/金紅石異相結明顯提高了電子-空穴對的分離效率,使光激發(fā)產(chǎn)生的電子-空穴對更容易到達催化劑的表面。
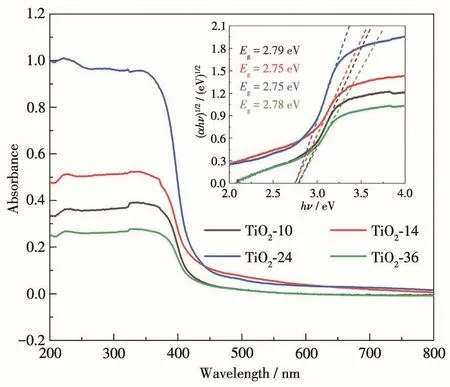
圖3 TiO2樣品的紫外可見漫反射吸收光譜及(αhν)1/2-hν曲線Fig.3 UV-Vis diffuse reflectance absorption spectra of TiO2samples and(αhν)1/2-hν curves(Inset)
2.3 TiO2光催化降解HCHO性能測試
通過測試不同TiO2樣品的光催化降解HCHO性能,來評價其光催化活性。不同樣品降解HCHO過程中,HCHO濃度的降低和相應CO2濃度的增加情況分別如圖4a和4b所示。在光催化劑作用下,反應系統(tǒng)中的HCHO濃度不斷降低(圖4a),同時CO2濃度不斷增加(圖4b),表明所制備的TiO2催化劑均能在室溫下將HCHO氧化為CO2。圖4a和4b表明不同的催化劑在室溫下的光催化氧化HCHO性能明顯不同,25 min后在 TiO2-10、TiO2-14、TiO2-24和TiO2-36催化劑作用下HCHO濃度從120.0 mg·L-1分別下降到了 47.0、38.0、10.0及 61.5 mg·L-1,ΔcCO2(實驗過程中CO2濃度相對實驗前濃度的差值)也相應地增加至69.0、80.5、105.0及52.0 mg·L-1。可見催化劑TiO2-24對HCHO的降解率最高,25 min后達到了92%。
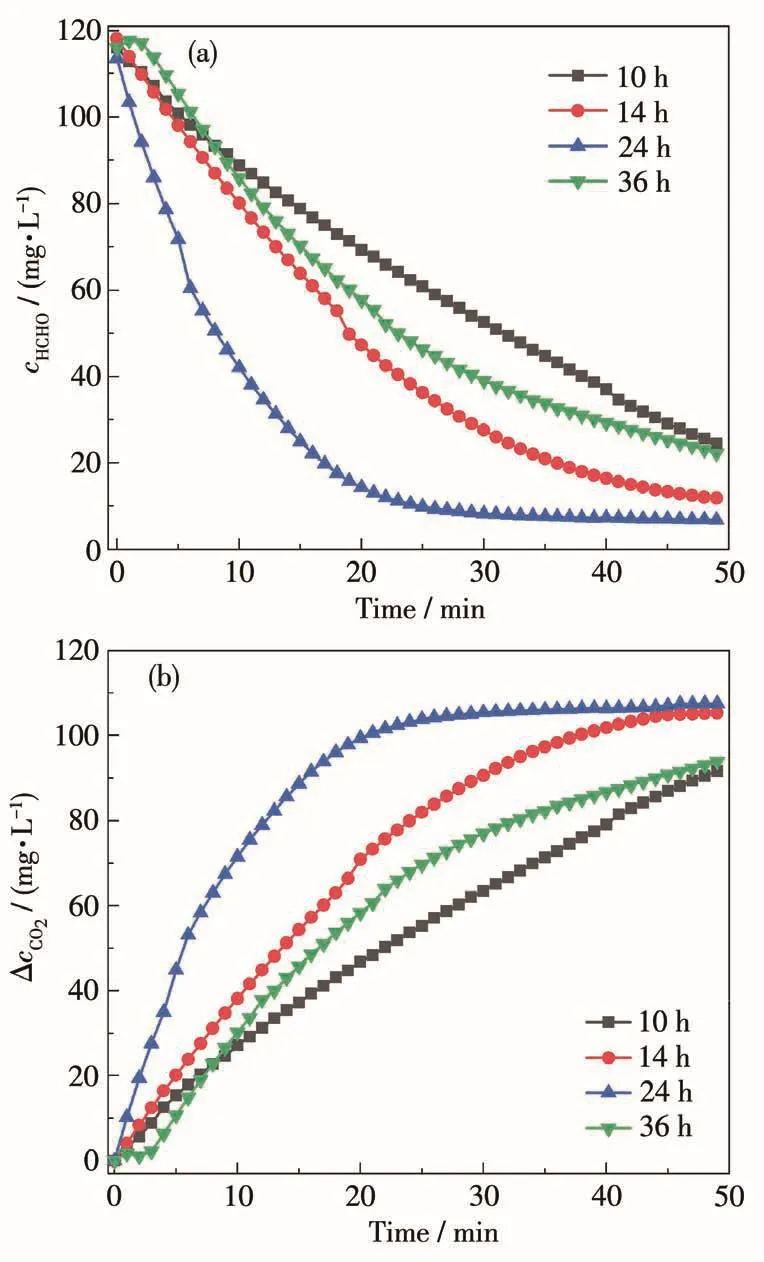
圖4 TiO2樣品在催化氧化HCHO實驗過程中HCHO濃度(a)與ΔcCO2(b)隨反應時間的變化曲線Fig.4 Changes of HCHO concentration(a)andΔcCO2(b)as a function of reaction time on TiO2samples
為了探究該系列材料光催化性能提高的影響因素,測試了TiO2-10、TiO2-14、TiO2-24和TiO2-36的N2吸附-脫附等溫線(圖5)。根據(jù)BDDT(Brunauer-Deming-Deming-Teller)分類[41],所有樣品的吸附-脫附曲線都是典型的Ⅳ型吸附等溫線,具有H3型回滯環(huán),表明介孔結構的存在。根據(jù)吸附等溫線,TiO2-10、TiO2-14、TiO2-24和TiO2-36的BET(Brunauer-Emmett-Teller)比表面積(SBET)分別為45、42、30和29 m2·g-1。樣品的SBET隨著水熱時間延長逐漸降低,這可能與材料發(fā)生團聚有關。結合圖4的催化活性結果,可以證實比表面積不是影響TiO2異相結降解HCHO性能的主要因素。因此,異相結中不同相的比例應該是導致該類材料性能差異的主要原因。
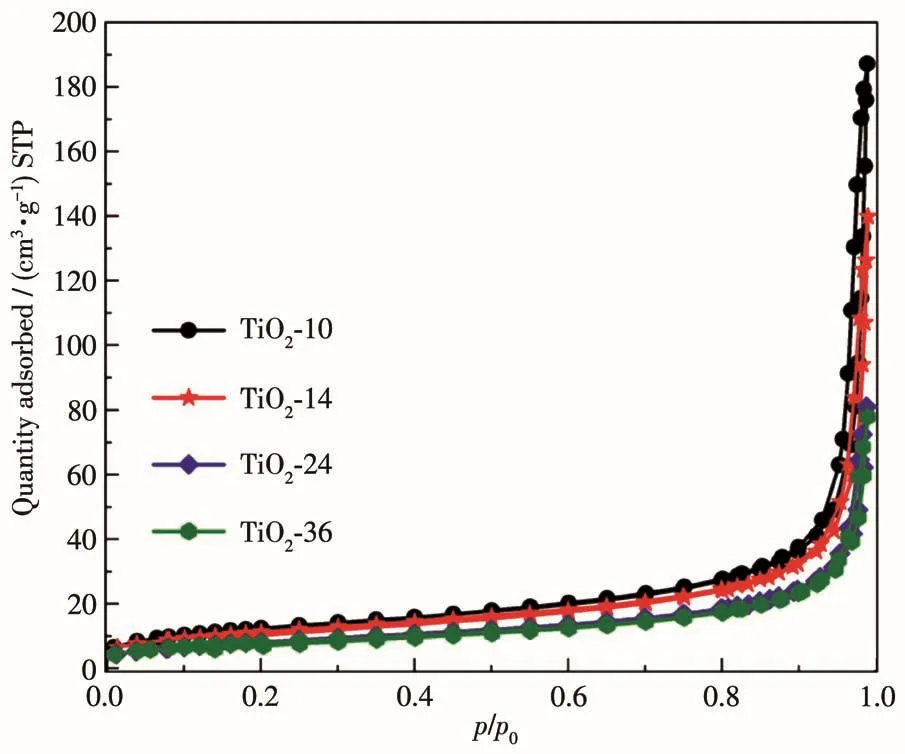
圖5 TiO2-10、TiO2-14、TiO2-24和TiO2-36的N2吸附-脫附等溫線Fig.5 N2adsorption-desorption isotherms of TiO2-10,TiO2-14,TiO2-24,and TiO2-36
催化劑的穩(wěn)定性和循環(huán)性在實際應用中至關重要。圖6為TiO2-24光催化劑在室溫下光催化氧化HCHO的循環(huán)性能。從圖中可以觀察到TiO2-24光催化劑在5次循環(huán)實驗后,HCHO的減少量和相應的CO2增加量均沒有明顯的變化,即該樣品對HCHO的降解率仍然維持在92%左右,這表明TiO2-24催化劑具有良好的光催化活性和化學穩(wěn)定性,在室溫光催化降解室內空氣中HCHO方面具有一定的應用前景。
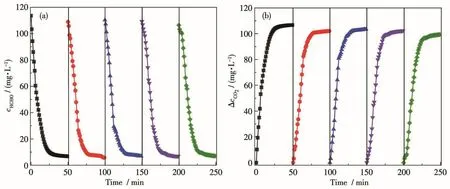
圖6 TiO2-24在5次循環(huán)試驗中HCHO濃度(a)和ΔcCO2(b)隨時間的變化曲線Fig.6 Changes of HCHO concentration(a)andΔcCO2(b)as a function of reaction time for TiO2-24 in five repeated tests
2.4 光催化反應機理
為了研究TiO2催化劑在受到光激發(fā)后產(chǎn)生的光生電荷的遷移和復合情況,在室溫下測試了TiO2-10、TiO2-14、TiO2-24和TiO2-36的穩(wěn)態(tài)熒光和時間分辨熒光光譜。圖7a為所有TiO2催化劑在激發(fā)波長為325 nm時的穩(wěn)態(tài)熒光譜圖,其中,TiO2-24的熒光強度最低,說明TiO2-24的光生電荷復合率最低,熒光譜圖的強度順序為TiO2-36>TiO2-10>TiO2-14>TiO2-24,該順序與催化劑光催化活性的順序一致。圖7b為銳鈦礦/金紅石異相結TiO2的熒光壽命光譜圖,根據(jù)公式5可得到熒光壽命:
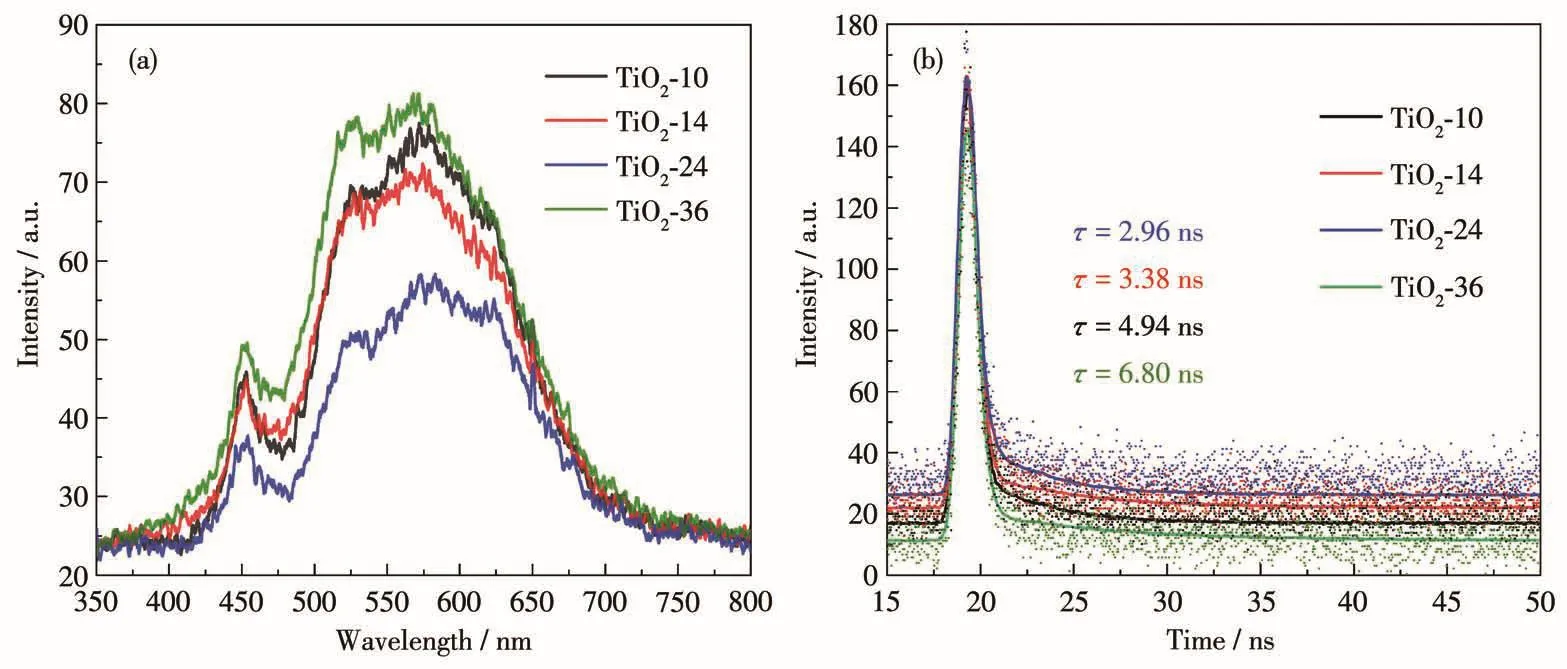
圖7 TiO2樣品的(a)穩(wěn)態(tài)熒光光譜圖和(b)時間分辨熒光光譜圖Fig.7 (a)Steady-state fluorescence spectra and(b)time-resolved fluorescence decay spectra of TiO2samples
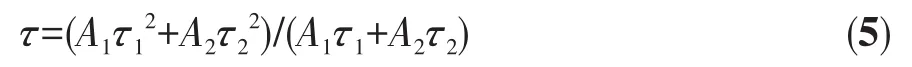
其中,τi(i=1、2)為壽命,Ai為指數(shù)衰減擬合的振幅。計算得到 TiO2-24 的平均壽命(τ)為 2.96 ns,短于TiO2-10(4.94 ns)、TiO2-14(3.38 ns)和 TiO2-36(6.80 ns)的壽命。這是由于TiO2-24的光誘導電荷可以從金紅石相TiO2上通過緊密接觸的界面快速有效地轉移到銳鈦礦相TiO2表面[42],這表明制備的異相結TiO2-24具有較高的載流子分離和遷移效率。
為進一步探究TiO2的光電化學性質,分別對不同TiO2樣品進行了光電流和電化學阻抗測試,結果如圖8a和8b所示。從圖8a中可以看出,TiO2-24(6.1μA·cm-2)的光電流強度明顯高于TiO2-10(4.6μA·cm-2)、TiO2-14(5.8 μA·cm-2)和 TiO2-36(3.8 μA·cm-2),這表明異相結TiO2-24對光生電子-空穴對的分離效果最好。此外,Nynquist曲線如圖8b所示,異相結TiO2-24的弧半徑小于TiO2-10、TiO2-14和TiO2-36的半徑,同樣表明異相結TiO2-24具有最優(yōu)的電荷分離效率。以上(光)電化學性能測試結果與光催化降解HCHO活性測試結果一致,說明光生電荷的高效分離和快速轉移是TiO2異相結光催化降解HCHO性能提高的關鍵因素。
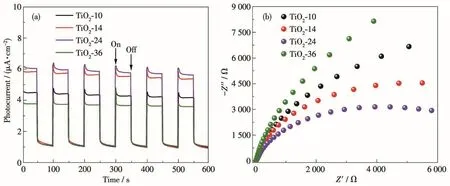
圖8 TiO2樣品的(a)瞬態(tài)光電流響應圖和(b)Nyquist曲線Fig.8 (a)Transient photocurrent responses and(b)Nyquist plots of TiO2samples
自2018年余家國教授提出了梯型(S-scheme)異質結光催化機制以來,該機制受到了廣泛關注。我們推測本研究中一維TiO2銳鈦礦/金紅石異相結的光催化氧化HCHO的機理也符合梯型異質結機制[43]。一維TiO2銳鈦礦/金紅石異相結光催化降解HCHO的可能反應機理如圖9所示(圖中Ef表示的是費米能級)。銳鈦礦和金紅石的禁帶寬度分別為3.2和3.0 eV[41],金紅石和銳鈦礦相TiO2的價帶(VB)和導帶(CB)相對位置如圖9a所示[44],該異相結銳鈦礦相TiO2具有更高的VB電位,屬于氧化型半導體光催化劑,而金紅石結構的TiO2具有更低的CB電位,可作為還原型半導體光催化劑。當2種不同結構的TiO2發(fā)生緊密接觸(圖9b)形成異相結后,電子從費米能級高的金紅石結構的TiO2流入費米能級低的銳鈦礦相TiO2,使金紅石相TiO2的能帶向上彎曲,形成正電荷聚集區(qū)域,與此同時,銳鈦礦相TiO2得到電子,使其帶邊向下彎,形成負電荷聚集區(qū)域,進而在2種不同結構TiO2界面處形成一個內建電場,有利于形成電子傳輸通道。如圖9c所示,在紫外光照射下,銳鈦礦和金紅石均被激發(fā)產(chǎn)生光生電子(e-)-空穴(h+)對。由于內建電場的存在,銳鈦礦相TiO2的光生電子穿過界面遷移至金紅石相TiO2的VB,使電子和空穴分別聚集于金紅石相TiO2和銳鈦礦相TiO2氧化還原活性位點,大幅提高光生電荷的利用率。空穴在銳鈦礦相TiO2表面與吸附的HCHO分子發(fā)生反應,最終將HCHO氧化成無毒無害的CO2,電子聚集在金紅石相TiO2與吸附的O2發(fā)生還原反應生成·O2-,隨后可能還會繼續(xù)與H+反應生成HO2·等。HCHO光催化降解過程中可能發(fā)生的氧化還原反應可以用下列方程式表示[45-46]:
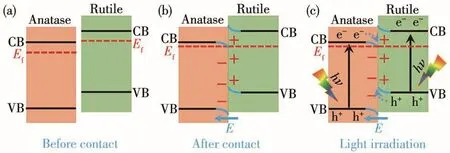
圖9 異相結TiO2光催化降解HCHO機理示意圖Fig.9 Mechanism diagram of photocatalytic degradation of formaldehyde by TiO2heterophase junction

氧化反應:
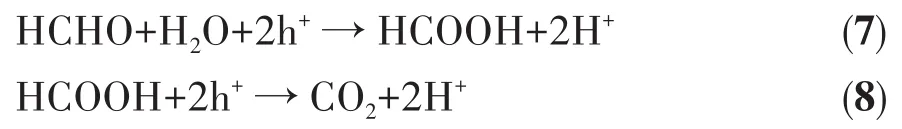
還原反應:

3 結論
采用簡單、可控的一步水熱法在較低溫度下成功合成了一維的含量可控、界面緊密接觸的銳鈦礦/金紅石異相結TiO2,其中水熱時間為24 h、銳鈦礦相含量為33%的催化劑TiO2-24在HCHO的光催化降解HCHO中表現(xiàn)出最優(yōu)的性能。在波長為365 nm,光強為12.26 mW·cm-2的LED燈照射下,濃度約為120 mg·L-1的HCHO氣體在反應器內反應25 min后,HCHO礦化為CO2的降解率達到了92%。TiO2-24催化劑的高活性被認為與以下兩方面有關:(1)通過形貌調控,粒徑分布均勻的銳鈦礦相TiO2納米粒子高密度、單分散地負載在金紅石相TiO2納米棒上,這種界面結構增加了反應的活性位點,增強了光吸收能力,同時異相結之間的緊密接觸也有利于光生電荷的傳輸;(2)異相結結構對電荷的分離具有定向驅動作用,使催化劑具有更高效的光生電荷分離和傳輸效率。本實驗采用的簡單、可控、溫和的異相結制備方法為TiO2光催化劑的廣泛應用奠定了基礎,為光催化氧化HCHO提供了一種可行的解決方案。
- 無機化學學報的其它文章
- Barium Complex In Situ Synthesized from 1,4,5,8?Naphthalene Tetracarboxylic Acid:Structure,Detection of Aromatic Amines,and Use as a Precursor of Nano BaCO3
- Two?Dimensional Coordination Polymer[Tb(1,4?bdc)1.5(phen)(H2O)]n:Synthesis,Crystal Structure and Luminescent Detection of Fe3+
- Synthesis,Crystal Structure and Magnetic Properties of Dinuclear Dy(Ⅲ)Complex Based on Multidentate Schiff Base
- 石墨烯吸附TiCl4分子的條件控制及光電性能的理論研究
- 亞鐵金屬有機層的合成、結構及其超快仿生催化性能
- 源于鉍玻璃的富氧空位BiOCl光催化材料的原位合成及性能

