基于神經-血管單元空間構筑探討針刺治療缺血性腦卒中的研究進展
李夢醒,王 玉,李 真,劉 箐,唐 巍*
1 安徽中醫藥大學針灸推拿學院,安徽 合肥 230012;
2 安慶師范大學體育學院,安徽 安慶 246133;
3 安徽中醫藥大學研究生院,安徽 合肥 230012
缺血性腦卒中(ischemic stroke,IS)屬中醫學“中風”范疇,系由多種原因所致的局部腦組織缺血、缺氧性病變壞死,產生不同程度的神經功能缺損癥狀。此涉及多種細胞相互作用的級聯反應過程,可破壞神經-血管單元(nerve-vascular unit,NVU)[1]整體結構功能,導致腦損傷進行性加重。《中國腦卒中防治報告2019》顯示,我國40~74 歲居民首次腦卒中標化發病率平均每年增長8.3%[2],其發病率、病死率及致殘率逐年上升[3]。探尋并闡明缺血性腦損傷恢復的生物學機制,為IS 的治療提供新的靶點,具有積極的現實意義和重要的理論意義。
NVU 概念的提出,為中樞神經系統(central ner?vous system,CNS)損傷與修復的病理、生理研究提供新的平臺。NVU 是由神經元、血腦屏障(blood brain barrier,BBB)、膠質細胞和細胞外基質(extracellular matrix,ECM)構成的功能單位,其核心為神經元、星型膠質細胞(astrocytes,As)、腦微血管內皮細胞(brain micro-vascular endothelial cell,BMEC),各組分相互關聯,共同維持中樞穩態。當腦組織缺血缺氧時,引起神經元-膠質細胞解耦聯,血管內皮細胞結構改變,BBB 完整性破壞等一系列動態變化,加重缺血性損傷反應[4]。因此,NVU 作為IS 的整體救治模型,旨在將腦缺血的治療從單一靶點逐步轉變為對各組分的多靶點治療,調節腦內動態平衡,神經元-膠質細胞-血管內皮細胞-細胞外基質協同治療,可為本病神經修復機制研究開拓新的視野。
針刺是腦缺血的有效防治手段[5],具有整體調節和綜合治療的特點。NVU 強調在腦卒中機制研究和靶點治療中的整體性與中醫整體觀念相吻合。因此,重視NVU 各成分的相互作用,并作為功能性整體,在諸多靶點中選擇相應干預方法,可為闡明針刺減輕腦缺血損傷的可能物質基礎與有效作用靶點提供方向。本文結合國內外在NVU 和針灸學領域的研究成果,探討基于NVU 空間構筑的針刺治療IS作用機制的研究進展。
1 NVU的結構功能和在IS的空間構筑變化
NVU 各組成部分在中樞微環境中并非孤立存在,其通過正負反饋機制維持大腦的正常功能[6]。腦缺血作為一種炎癥刺激,可打破神經元及其他成分間的相對平衡,對腦缺血做出相關關聯反應。
神經元在NVU 中居主導地位,主要接受刺激、整合信息、傳導沖動,是CNS 發揮信號傳導和神經傳遞功能的關鍵。諸多研究顯示,神經元死亡是IS預后不良的主要原因[7]。具有高耗氧、高代謝特性的神經元,對缺血、缺氧環境極其敏感。神經元血供遭到阻斷后,隨即繼發一系列諸如氧化應激、神經炎癥、神經毒性損傷等損害,導致大量神經元變性或凋亡[8]。腦卒中后,除神經元損傷外,NVU中其他結構的破壞亦可引起腦組織功能障礙。BBB 是中樞與外周組織的關鍵連接口,精密調控腦血管與CNS之間的體液和細胞物質轉運,當其被破壞時,可直接導致CNS微環境失衡。BMEC是BBB的關鍵結構,能滋養鄰近神經元,誘導軸突形成,促進神經干細胞(neural stem cells,NSCs)增殖、發育等,形成的內皮細胞作為NVU 各組件間的門控屏障,參與調節BBB 變化與微環境穩態[9]。但受氧自由基、炎癥因子等影響,易出現微血管痙攣及繼發的血管通透性增高,加劇腦損傷[10]。作為BBB 的第二道屏障,As構成了腦微血管與神經元突觸之間的銜接,在調節局部腦血流量、轉運神經活動中O2和葡萄糖、調節突觸功能中扮演重要角色。BMEC 和As 間的互相影響,可誘導和調節BBB結構和功能,增加BMEC緊密連接,減少縫隙連接。被腦缺血早期逐層放大效應所累及,As 大量增殖,分泌多種興奮性神經遞質和炎癥因子,阻礙神經網絡重建。腦缺血后期,異常活化的As形成膠質瘢痕,加重神經元對病理因素的易損性和敏感性[11]。除神經元和膠質細胞外,由膠質細胞和BMEC 分泌的ECM 是一種高度動態的結構,可不斷變化調控組織穩態[12]。當腦缺血發生時,在基質金屬蛋白酶(matrix metalloproteinases,MMPs)作用下,出現基質-細胞信號聯系紊亂,腦微血管滲透性增高,破壞BBB 完整性,導致神經元損害[13]。見圖1。
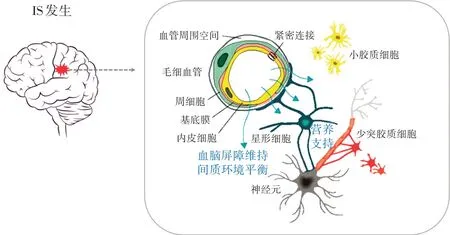
圖1 NVU的結構功能及在IS的空間構筑變化Figure 1 Structure and function of NVU and its spatial structure changes in ischemic stroke
作為一個復雜的動態復合體,NVU 中各組成單位間在生理上相互作用,組成血腦屏障,維護機體內微環境穩定;病理上相互關聯,在能量代謝障礙、鈣超載、自由基連鎖反應、細胞凋亡等多個環節均有參與[14],且各病理過程相互重疊、加強,加重缺血狀況,如此形成惡性循環[15]。因此,僅局限于單純的神經元保護顯得過于片面,應深入研究神經元、ECM 及As 之間的相互作用對缺血性腦損傷后神經恢復的影響,展開多方位、多途徑的全面保護。
2 基于NVU的針刺治療IS研究思路
多項研究證實,針刺治療腦缺血作用機制與NVU關系密切,通過調整NVU 各組分功能結構的穩定性,雙向調控NVU 空間構筑變化,發揮協同神經保護作用,可成為促進腦缺血后功能恢復的關鍵[16-17]。
2.1 以神經元為單維靶點的針刺研究
神經元凋亡是腦缺血后神經元丟失的一種重要形式。與發生于腦缺血中心區的細胞壞死不同,細胞凋亡主要出現在缺血半暗帶且常較梗死灶中心延遲數小時。研究提示,神經元凋亡呈可調節狀態,即激活生存基因可抑制其凋亡,激活死亡基因則可誘導其凋亡[18]。因此,在基因調控水平上實施針刺,挽救腦缺血半暗帶區神經元,可成為一條保護缺血腦組織的新途徑。
有研究證實,針刺大椎穴可減輕急性期缺氧缺血性腦損傷,可能是通過抑制促凋亡蛋白半胱氨酸蛋白酶-3(caspase-3)的表達實現的[19]。顧亞會等[20]進一步研究發現,針刺可抑制腦缺血大鼠聚腺苷二磷酸核糖聚合酶1[poly(ADP-ribose)polymerase-1,PARP1]的過度表達,降低大鼠腦缺血再灌注后大腦皮層異常升高的白細胞介素-1 受體Ⅰ(IL-1RI)、腫瘤壞死因子受體-Ⅰ(TNFR-Ⅰ)mRNA的表達,顯著改善神經元超微結構。在此基礎上聯合溶栓治療,可延長溶栓時間窗,提高溶栓治療的效果和安全性,推測可能與抑制缺血腦組織中凋亡誘導因子、PARP1 和核酸內切酶G(Endo G)的表達,從而抑制神經元凋亡有關。林亞平等[21]發現針刺聯合亞低溫可減少腦梗死面積及細胞凋亡,其機制可能與降低磷酸化絲氨酸/蘇氨酸蛋白激酶-1(Raf-1)、酪氨酸激酶受體-2(MEK-2)、絲裂原活化蛋白激酶(ERK1/2)的表達水平有關。
神經元損傷后的修復受多種營養因子、神經遞質的調節,其中神經生長因子(nerve growth factor,NGF)、腦源性神經營養因子(brain-derived neuro?trophic factor,BDNF)、纖維細胞生長因子(fibroblast growth factor,FGF)在保護損傷神經元、提高神經可塑性方面均體現出重要調控價值[22]。腦缺血再灌注后24 h 內NGF、BDNF 出現代償性增高,可能是一種內源性保護機制,至再灌注72 h 時表達水平下降,可能與神經元死亡數量進一步增多有關[23]。針刺水溝、合谷、三陰交穴可促進腦缺血大鼠缺血側NGF、bFGF的表達[24],同時,電針能及早長時程促進內源性NSCs 分化為功能性神經元[25]。細胞生長因子表達水平的提升,還可增加突觸可塑性,腦缺血3 d 后介入針刺治療,透射電鏡下觀察到突觸數密度、突觸面密度有所提高,突觸超微結構的缺損程度得到有效改善[26]。與神經發育、軸突再生和突觸重塑密切相關的生長相關蛋白-43(growth associated protein 43,GAP-43)和突觸素(synaptophysin,SYP)表達與神經生長、修復再生密切相關,雙側電針法可提高GAP-43 和SYP 在海馬區的表達,促進腦缺血后損傷區域突觸重建,實現神經網絡重塑,加速神經功能修復[27]。
抑制神經元凋亡,調節突觸可塑性,活化休眠的神經結構,在以神經元為單維關鍵靶點的研究中,針刺在保護神經元方面發揮重要作用。作為一種適宜的外周干預,通過針刺特殊的外周感覺傳入方式,調節神經反射環路中神經興奮性,亦可實現大腦功能網絡的重組及補償[28]。
2.2 以神經元、BMEC為二維靶點的針刺研究
腦缺血發生后,受內毒素及細胞因子等刺激,腦血管血流和組織代謝發生改變,同時,內皮細胞與白細胞結合發生急性炎癥反應,導致BBB 通透性增加。盡早重構局部腦微血管循環系統,可促進NVU 的協調和優化,并為大腦神經元的生存及功能提供關鍵的神經血管底物。
血管內皮生長因子(vascular endothelial growth factor,VEGF)是腦內重要的血管神經素[29],參與多種狀態下的血管生成。針刺能促進缺血灶皮質VEGF表達,促進血管內皮細胞增殖,增強腦微血管功能恢復[30]。在缺氧、炎性反應等條件下,bFGF、血管生長素-1 和血管生長素-2(Angiopoietin-1/Angiopoi?etin-2,Ang-1/Ang-2)、血小板源性生長因子-b(plate?let-derived growth factor-b,PDGF-b)通過自分泌或旁分泌的方式激活內皮細胞,啟動血管新生過程,電針水溝穴可顯著提高以上因子表達水平,誘導腦部微血管的生長[31]。炎性因子是腦缺血后瀑布樣級聯式反應的始動因素,電針百會、足三里穴可降低缺血側腦基底核區微毛細血管細胞間黏附分子-1(intercellular adhesion molecule-1,ICAM-1)和MMP-9表達水平,上調損傷-修復網絡功能,抑制腦缺血區炎性反應[32]。
針刺干預下,誘導大量新生血管形成,推動側支循環建立[33],減輕腦區炎性反應,緩解微血管痙攣[34],改善局部腦血流量,保障腦動脈結構、功能完整性,將腦損傷降至最低。
腦缺血發生時,微血管對缺血的反應與神經元受損發生的時相、區域趨于一致,提示兩者聯系緊密。針刺正向調控促進血管發生和代償,調節腦部血流量,放大缺血后腦組織再次獲得血氧的自然保護效應,在以神經元、BMEC 為二維靶點的研究中,針刺在協同神經和血管間的耦合中發揮穩定作用。
2.3 以神經元、BMEC、膠質細胞為多維靶點的針刺研究
As 釋放神經營養因子,是神經元賴以存活、血管再生的基礎,也是神經保護和神經調節的極好備用資源[34]。在腦缺血早期逐層放大效應下,過度增殖的As通過釋放谷氨酸和炎性因子、降低縫隙連接等影響突觸重塑[35]。活化的As于缺血灶大量聚集,形成的膠質瘢痕可阻礙神經修復。以As 為靶點可有效加強神經元與微血管血流間調節功能耦聯的介導,改善缺血環境。
研究表明,針刺內關能調控大腦中動脈缺血大鼠腦組織中As 谷氨酸代謝通路,清除過多谷氨酸,減輕神經興奮性毒性[36]。另有研究報道,電針預處理上調缺血半暗帶區域興奮性谷氨酸轉運體2(ex?citatory amino acid transporter 2,EAAT2)表達,誘導腦缺血耐受[37]。電針亦可抑制As活化,減輕缺血周圍海馬和皮質神經炎癥反應[38]。縫隙連接蛋白(connexin,CX)構成的縫隙連接是電突觸的基礎結構,其中縫隙連接蛋白43(Cx43)構成了As 間的半通道及縫隙連接,參與誘導神經纖維遷移,促進突觸重建[39]。李得浩等[40]發現,與針刺穴位旁相比,針刺穴位處能獲得更高的Cx43表達,可能與針刺穴位處激活了間隙連接通道,促進Ca2+、cAMP、IP3 或其他小分子物質快速傳遞至相應臟器有關。膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)作為As 活化的標志物,可通過GFAP 表達量判斷As損傷程度[41]。針刺可增強卒中后抑郁大鼠海馬、皮質和杏仁核中As ATP的釋放,改善神經元損傷[42]。
腦缺血中,膠質細胞在NVU 各成分間信號傳遞和介導神經損傷過程中居核心地位。針刺效應的發揮,正是因勢利導,抑制興奮性毒性和炎癥反應,參與突觸結構功能重塑,調控As 能量代謝,強化其保護作用,抑制其損傷途徑。在以神經元、BMEC、膠質細胞為多維靶點的研究中,是針刺雙向調節效應的體現。
3 結 語
缺血性腦卒中的理想治療方案是在溶栓時間窗內同時盡快恢復灌注和建立腦保護。基于對腦缺血后NVU 空間構筑變化的審視,依據NVU 各組分及整體變化展開針刺治療IS 的機制探討,符合中醫辨證論治的思想。加強血管-神經耦聯,雙向調控相關因子,選擇抗細胞凋亡、抗炎、促血管生成、突觸重塑等策略,對減輕腦損傷與促進腦修復具有重要指導價值。
針刺具有多組分、多靶點、多環節的作用及整體調節特點,與IS 的治療理念契合。但研究中尚存在部分問題亟待解決:①目前臨床缺乏以NVU 空間構筑為切入點的系統治療方案,大多停留在對神經元或血管生成調控機制的研究,作用靶點單一,較少涉及對NVU 的整體及各組分間相互作用的研究;②多數研究局限于動物實驗,臨床報道甚少;③關于針刺刺激量、留針時間、取穴等治療要素尚需進一步規范,應探討最佳量效關系,發揮最優治療作用;④目前針刺對ECM 的相關報道僅見于對椎間盤、肝臟等局部筋膜組織、相應臟器或組織成纖維細胞研究,較少涉及IS;⑤針刺穴位對大腦神經環路上的物質能量、信息變化及對腦損傷級聯反應的影響機制研究較少,未來可從此方面進行深入研究。

