響應面法優化三葉青總黃酮提取工藝及不同產地三葉青的質量評價
徐志杰,黃子洳,馬方芳,張善華,程汝濱,黃 真,鐘曉明,
(1.浙江中醫藥大學,浙江杭州 310053;2.遂昌縣農業農村局,浙江麗水 323300)
三葉青(Tetrastigma hemsleyanumDiels et Gilg)學名三葉崖爬藤,為葡萄科崖爬藤屬植物,又名蛇附子、石抱子、金線吊葫蘆,是我國特有瀕危珍稀藥用植物,主產于我國浙江、江西、福建和廣西等地[1]。三葉青以塊根入藥為主,味微苦、性平,具有清熱解毒、消腫止痛、化痰散結等功效[2]。三葉青除藥用外,也常作為藥膳食材,目前市面已有三葉青茶類產品,開水沖泡即可飲用,是西藥無法替代的“植物抗生素”[3]。
三葉青的品種因地區不同而存在一定的區別,福建、湖南、云南、廣東、廣西等地的三葉青為青藤三葉青,浙江、江西一帶的三葉青則為紫藤三葉青[4-5]。青藤三葉青分布地域較廣,適應能力強,產量較高;而紫藤三葉青產量不高,且生長年限長,但其藥用功效更佳[6]。由于受地理因素及氣候環境等影響,不同產地的三葉青化學成分的含量和組成表現出明顯的差異性。不同產地的三葉青質量參差不齊,缺乏科學有效的質量評價方法,不利于三葉青產業的規模擴大和后續健康產品的開發。
黃酮類成分作為三葉青的主要藥效成分和質控指標[7-8],在抗癌[9]、抗氧化[10]、提升免疫力[11]、抗病毒[12]、神經保護[13]和抗炎[14]等方面均顯示出廣泛的生理活性。然而三葉青總黃酮提取工藝落后,提取得率較低[15],不利于三葉青黃酮的大規模開發應用。同時,雖然目前已有不少關于三葉青指紋圖譜的研究,如李士敏等[16]、張曉芹等[17]、金曉懷[18]均對三葉青HPLC指紋圖譜有一定的研究,但所采集的三葉青樣品產地較為局限,難以反映和區分全國各產地三葉青的整體質量。故本研究收集了全國9個不同產地的18批三葉青樣品,采用Box-Behnken法優化三葉青中總黃酮的提取工藝,測定不同產地三葉青的總黃酮得率,并建立不同產地三葉青HPLC指紋圖譜,結合相似度分析、聚類分析和主成分分析來評價不同產地三葉青的質量,以期為規范三葉青銷售市場以及三葉青資源的開發利用提供參考。
1 材料與方法
1.1 材料與儀器
三葉青干燥塊根 樣品來源信息詳見表1,各產地均采集2批樣品,共9個產地18批三葉青樣品,其中廣西南寧、云南楚雄產三葉青為原產地采集,其他產地三葉青樣品分別購于全國各地的藥材市場,三葉青樣品經浙江中醫藥大學藥學院中藥資源研究所陳孔榮副教授鑒定為葡萄科崖爬藤屬植物三葉青Tetrastigma hemsleyanumDiels et Gilg的干燥塊根;蘆丁、槲皮素、山柰酚 批號分別為T27F10Z81699、C01J10Y91727、G11A11L110978,純度均>98%,上海源葉生物科技有限公司;乙腈 色譜純,美國Tedia公司;乙醇、磷酸、甲醇、氫氧化鈉、亞硝酸鈉分析純,國藥集團化學試劑有限公司;硝酸鋁 分析純,上海麥克林生化科技有限公司;超純水 Milli-Q超純水系統制備。

表1 各產地三葉青信息Table 1 Information of Tetrastigma hemsleyanum Diels et Gilg
DZF數顯鼓風干燥箱 上海博訊實業有限公司;AL104電子天平 上海梅特勒-托利多儀器有限公司;RE-52AA旋轉蒸發儀 上海榮亞生化儀器廠;恒溫水浴鍋 上海宜昌儀器廠;紫外分光光度計日本島津公司;Waters高效液相色譜儀 美國Waters公司。
1.2 實驗方法
1.2.1 三葉青總黃酮的提取工藝優化
1.2.1.1 三葉青總黃酮的提取 選取道地產地浙江臺州的三葉青為供試品,將其粉碎后過50目篩,真空干燥至恒重,得到樣品粉末。精密稱取粉末1.0 g,在一定提取時間、提取溫度、液料比、乙醇濃度下于恒溫水浴鍋中進行冷凝回流提取,將濾液抽濾,轉移至50 mL量瓶中定容,備用。
1.2.1.2 蘆丁標準曲線的繪制 參考文獻[15,19]并加以修改,精密稱取蘆丁對照品10.0 mg,用60%乙醇定容至 10 mL,搖勻,即得1 mg·mL-1對照品溶液。精密吸取 0.2、0.4、0.6、0.8、1.0 mL的蘆丁1.0 mg·mL-1對照品儲備液于25 mL容量瓶中,加入1 mL 5%亞硝酸鈉溶液,搖勻,靜置6 min。再加入1 mL 10%硝酸鋁溶液,搖勻,靜置6 min。最后加入10 mL 4%氫氧化鈉溶液,加水定容至25 mL,搖勻,靜置15 min。以加純水的試劑作為空白,測定樣品在510 nm處的吸光度A,以蘆丁質量濃度X為橫坐標,吸光度A為縱坐標進行回歸,得到回歸方程:A=0.4705X-0.0035(R2=0.9999)。
1.2.1.3 三葉青總黃酮的測定 準確吸取三葉青樣品溶液2.0 mL于25 mL容量瓶中,按照“1.2.1.2”中所述方法進行操作并計算三葉青總黃酮得率[20],計算公式如下:

式中,Y 為三葉青總黃酮得率(mg·g-1);C 為總黃酮的質量濃度(mg·mL-1);V為測量總黃酮提取液體積(mL);N為稀釋倍數;M為稱量的三葉青樣品質量(mg)。
1.2.1.4 單因素實驗 以三葉青總黃酮得率為指標,固定提取時間90 min、提取溫度 70 ℃、料液比1:30 g·mL-1、乙醇濃度70%時,分別考察不同提取時間(30、60、90、120、150 min)、提取溫度(50、60、70、80、90 ℃)、料液比(1:10、1:20、1:30、1:40、1:50 g·mL-1)、乙醇濃度(50%、60%、70%、80%、90%)對三葉青總黃酮得率的影響,各實驗均平行重復3次。
1.2.1.5 Box-Behnken 響應面法優化提取工藝 根據單因素實驗結果,以提取時間(A)、提取溫度(B)、料液比(C)、乙醇濃度(D)作為影響因素,總黃酮得率為評價指標(Y),應用 Box-Behnken 中心組合進行4因素3水平的實驗設計,因素水平如表2所示。

表2 響應面實驗因素水平設計Table 2 Factors and levels used in response surface analysis
1.2.2 三葉青指紋圖譜的建立
1.2.2.1 混合對照品溶液制備 取蘆丁、槲皮素、山柰酚對照品,加甲醇制成每1 mL含蘆丁10.1 μg、槲皮素9.7 μg、山柰酚8.8 μg的混合對照品溶液,備用。
1.2.2.2 供試品溶液制備 精密稱取各產地三葉青粉末1.0 g,以最佳提取工藝進行提取,抽濾1次,濾液轉移至50 mL量瓶中,定容至刻度。后置于蒸發皿中,蒸干,殘渣加甲醇超聲至溶解,轉移至5 mL容量瓶中,定容至刻度,用0.22 μm微孔濾膜濾過,得到供試品溶液,備用。
1.2.2.3 色譜條件 色譜柱為Waters Sunfire C18柱(4.6 mm×250 mm,5 μm),流動相為 0.2% 磷酸水-乙腈,梯度洗脫(0~30 min,15%~20% 乙腈;30~35 min,20%~33% 乙腈;35~50 min,33% 乙腈;50~60 min,33%~60%乙腈);流速為 1.0 mL/min;檢測波長為360 nm;柱溫為 40 ℃;進樣量為 10 μL。
1.2.3 指紋圖譜方法學考察
1.2.3.1 精密度實驗 取S1樣品,按“1.2.2.2”項下方法制備供試品溶液,在“1.2.2.3”項條件下連續進樣6次[21],以槲皮素峰為參考峰,計算得出各共有峰相對保留時間和相對峰面積的RSD值。
1.2.3.2 穩定性實驗 取S1樣品,按“1.2.2.2”項下方法制備供試品溶液,在“1.2.2.3”項條件下,分別在0、2、4、8、12、24 h 進樣測定[21],計算得出各共有峰相對保留時間和相對峰面積的RSD值。
1.2.3.3 重復性實驗 取6份S1樣品,按“1.2.2.2”項下方法分別制備供試品溶液,在“1.2.2.3”項條件下進樣測定[21],計算得出各共有峰相對保留時間和相對峰面積的RSD值。
1.2.4 指紋圖譜分析
1.2.4.1 相似度評價 將18批各產地三葉青液相色譜圖數據導入“中藥色譜指紋圖譜相似度評價系統(2012版)”進行分析,以S1樣品色譜圖為參照圖譜,采用中位數法生成對照圖譜,時間窗寬度設置為0.1 min,進行多點校正和自動峰匹配,生成指紋疊加圖譜,確定共有峰。以對照圖譜為參照,進行相似度評價。
1.2.4.2 聚類分析 采用SPSS20.0軟件以18批三葉青樣品的共有峰面積為變量,采用組間連接聚類方法,以平方Euclidean距離為度量標準進行系統聚類分析。
1.2.4.3 主成分分析 采用SPSS20.0軟件對18批三葉青樣品的指紋圖譜數據進行主成分分析,采用降維、因子分析,計算相關系數矩陣,主成分特征值、累積貢獻率及主成分綜合得分等。
2 結果與分析
2.1 三葉青總黃酮的提取工藝優化研究
2.1.1 單因素實驗 提取時間、溫度、料液比、乙醇濃度各單因素對三葉青總黃酮得率影響如圖1所示。由圖1A可知,三葉青總黃酮得率隨著時間的增加先升后下降,并在提取時間60 min時得率達到最大值。提取時間較短時,黃酮類成分尚未完全溶出,而提取時間過長時,可能會使三葉青黃酮中熱不穩定成分在長時間提取中遭到破壞降解,使得總黃酮得率下降[22]。由圖1B可知,總黃酮得率隨著溫度的升高先上升再下降,在80 ℃時得率達到最大值。當溫度升高,分子運動加劇,黃酮類物質溶出增加,故總黃酮得率上升。而當溫度過高時,可能導致黃酮類化合物氧化變性,使得總黃酮得率下降[23]。由圖1C可知,當料液比從 1:10 g·mL-1增加到 1:30 g·mL-1的過程中,總黃酮得率增加,并在料液比1:30 g·mL-1時得率達到最大值;但當繼續提高料液比時,得率下降,可能是高料液比時溶出的黃酮類物質被稀釋,伴隨著非黃酮類雜質增多,使得黃酮得率下降[24]。由圖1D可知,當乙醇濃度為60%時,總黃酮得率達到最大值。當乙醇濃度繼續增大時,總黃酮得率下降,推測當乙醇濃度高于60%時,溶劑的極性相對降低,導致其他非黃酮類物質溶出,使得總黃酮得率下降[25]。綜合上述因素,確定響應面分析的各因素考察水平分別為時間30、60、90 min,溫度70、80、90 ℃,料液比1:20、1:30、1:40 g·mL-1,乙醇濃度 50%、60%、70%。經單因素實驗優選的三葉青總黃酮的最佳提取條件為時間 60 min,料液比 1:30 g·mL-1,乙醇濃度 60%,溫度80 ℃,該條件下總黃酮得率為37.27 mg·g-1。
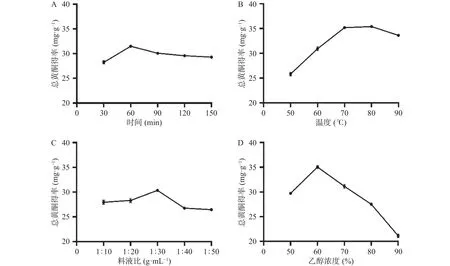
圖1 單因素實驗結果Fig.1 Single factor test results
2.1.2 Box-Behnken響應面優化試驗 在單因素實驗基礎上,以提取時間(A)、提取溫度(B)、料液比(C)、乙醇濃度(D)為自變量,以總黃酮得率為響應值,采用 Design-Expert 8.0.6 軟件設計4因素 3水平共29個實驗,如表3所示。得到總黃酮得率關于以提取時間(A)、提取溫度(B)、料液比(C)、乙醇濃度(D)的回歸方程:

表3 響應面試驗設計及結果Table 3 Design and results of response surface tests
Y=37.73+0.30A+1.86B+0.079C-0.44D+1.18AB-0.80AC+0.43AD-0.059BC+104BD+0.24CD-1.96A2-3.83B2-3.41C2-4.70D2。
由表4 ANOVA方差分析可知,實驗所選模型的決定系數R2=0.9836,調整決定系數R2adj=0.9672,模型F=60.00,P<0.0001,表明該模型具有極顯著性意義;失擬項P>0.05,沒有顯著差異,表明該模型與實驗數據擬合程度良好。B、D、AB、AC、BD、A2、B2、C2、D2的P值均小于0.05,表明其對總黃酮得率具有顯著性影響。變異系數CV值為1.84%,說明模型的重現性很好,該模型可用于三葉青總黃酮的提取工藝優化。各因素的影響程度通過F值反映,F值越大代表該因素的影響程度越大,故各因素對總黃酮得率的影響次序為:提取溫度>乙醇濃度>提取時間>料液比。

表4 ANOVA方差分析Table 4 ANOVA for Response Surface Quadratic model
由回歸方程繪制不同因子的響應面圖,以評價兩兩交互作用對總黃酮得率的影響并確定各因素的最佳水平范圍,如圖2所示。在響應面圖中,曲面越陡峭,則該因素對響應值的影響越顯著。在保持兩個自變量之外的因素固定的前提下,兩個交互的自變量對響應值的影響也可以從響應面圖的曲面反映[24]。由圖2可知,提取時間和提取溫度(圖2A),提取時間和料液比(圖2B)以及提取溫度和乙醇濃度(圖2E)兩者交互作用對響應值的影響顯著,其表現為響應面曲線走勢陡峭。

圖2 各因素對總黃酮得率的3D響應面圖Fig.2 3D response surface diagram of each factor on total flavonoids yield
通過軟件 Design-Expert 10.0 軟件分析得三葉青總黃酮的最佳提取條件:當提取時間為64.69 min,溫度為82.65 ℃,料液比為1:29.9 g·mL-1,乙醇濃度為59.90%時,預測可達三葉青總黃酮得率38.01 mg·g-1。考慮到實際操作,最終確定最佳提取工藝為提取時間 65 min,溫度 83 ℃,料液比 1:30 g·mL-1,乙醇濃度60%。此條件下對建立的模型進行驗證實驗,重復3 次,三葉青總黃酮得率為(37.89±0.07) mg·g-1,預測值為 38.01 mg·g-1,誤差為 0.32%,小于 3%,表明該響應面法得到的預測值準確可靠。該提取工藝總黃酮得率較高,相比朱良輝等[15]在正交工藝優化下的總黃酮得率26.04 mg·g-1,有較大的提升,可為進一步研究、開發三葉青藥用資源開發利用提供參考。
2.2 不同產區三葉青總黃酮得率的比較分析
以最佳提取工藝對不同產區三葉青樣品進行總黃酮提取,平行3次,測得各產地三葉青總黃酮得率,如圖3所示。其中以云南楚雄、福建福州、貴州黔西南產三葉青的總黃酮得率量較高,分別為51.19、51.75和49.84 mg·g-1;湖南永州、廣東清遠產三葉青的總黃酮得率較低,均低于25 mg·g-1。各產地三葉青中總黃酮得率差異較大,其原因可能是由于品種差異、地域氣候、生長年限等因素影響而產生的結果。

圖3 各產地三葉青總黃酮得率Fig.3 Yield of total flavonoids of Tetrastigma hemsleyanum Diels et Gilg
2.3 不同產地三葉青總黃酮HPLC指紋圖譜建立
將18批各產地三葉青液相色譜圖數據導入“中藥色譜指紋圖譜相似度評價系統(2012版)”進行分析,共標定11個共有峰,如圖4所示。其中3號峰、7號峰在湖南永州和廣東清遠兩地產三葉青樣品中有缺失;同時通過與對照品比對,指認其中3個成分,確認5號峰為蘆丁,10號峰為槲皮素,11號峰為山柰酚。其中5號峰在江西上饒產三葉青中占比最高,于湖南永州和廣東清遠兩地產三葉青中占比較低;10(槲皮素)、11(山柰酚)號峰在云南楚雄產三葉青中占比較高,在江西上饒產三葉青中占比較少。表明該結果顯示的指紋圖譜中11個共有峰,可作為三葉青HPLC指紋圖譜特征鑒定指標。各樣品色譜圖中均存在5(蘆丁)號峰,其與鄰峰的分離度較好,峰形較佳,且峰面積較大,故選擇該峰作為參考峰(S),計算得出18批三葉青共有峰相對保留時間的RSD為 0%~0.21%,但相對峰面積的 RSD為 23.89%~194.54%,如表5所示。各產地三葉青樣品共有峰相對保留時間的RSD值差異較小,但相對峰面積的RSD值差異較大,表明不同產地三葉青樣品其化學成分近似,但同一化學成分含量差異較大[26]。由指紋圖譜可知浙江臺州產三葉青各化學成分最為豐富,且各成分含量也較高;貴州黔西南產三葉青次之;其中以湖南永州與廣東清遠產三葉青的化學成分種類與含量最低。同時由三葉青樣品相似度評價表6可知,不同產地三葉青相似度不高,18批三葉青樣品與對照指紋圖譜相似度為0.770~0.961。

表6 三葉青樣品相似度評價表Table 6 Similarity evaluation table of Tetrastigma hemsleyanum Diels et Gilg

圖4 三葉青樣品HPLC指紋圖譜Fig.4 HPLC fingerprint of Tetrastigma hemsleyanum Diels et Gilg

表5 三葉青樣品共有峰相對保留時間及相對峰面積Table 5 Relative retention time and relative peak area of the common peaks of Tetrastigma hemsleyanum Diels et Gilg
2.4 指紋圖譜方法學考察
2.4.1 精密度實驗 取S1供試品,連續進樣6次,以槲皮素峰為參考峰,計算得出各共有峰相對保留時間和相對峰面積的RSD值分別小于0.4%、1.3%,表明該儀器的精密度良好。
2.4.2 穩定性實驗 取S1供試品,分別在0、2、4、8、12、24 h進樣測定,計算得出各共有峰相對保留時間和相對峰面積的RSD值分別小于1.2%、1.8%,表明供試品在24 h內的穩定性良好。
2.4.3 重復性實驗 取6份S1供試品,分別進樣,計算得出各共有峰相對保留時間和相對峰面積的RSD值分別小于0.9%、2.1%,表明該方法的重復性良好。
2.5 化學模式識別
2.5.1 不同產地三葉青總黃酮指紋圖譜聚類分析以各產地三葉青11個共有峰的面積為變量,導入SPSS20.0軟件,采用組間連接聚類方法,以平方Euclidean距離為度量標準進行系統聚類分析[27-28],結果如圖5所示。當歐氏距離>10時,不同產地三葉青可分為 4 類,浙江臺州(S1,S2)、貴州黔西南(S13,S14)樣品聚為第 1 類,浙江麗水(S3,S4)、云南楚雄(S9,S10)、福建福州(S11,S12)、廣西南寧(S17,S18)樣品聚為第 2 類,湖南永州(S7,S8)、廣東清遠(S15,S16)樣品聚為第 3 類,江西上饒(S5,S6)單獨聚為第4類。

圖5 三葉青樣品聚類分析圖Fig.5 Cluster analysis of Tetrastigma hemsleyanum Diels et Gilg
2.5.2 不同產地三葉青總黃酮指紋圖譜主成分分析和綜合評價 以各產地三葉青11個共有峰的面積為變量,導入SPSS20.0軟件,得到主成分因子載荷矩陣,結果如表7所示。主成分特征值和方差貢獻率是選擇主成分的依據,載荷矩陣反映了各變量對主成分的重要程度[29-31]。以特征值>1為標準,得到3個主成分,其中主成分F1、F2、F3的貢獻率分別為49.37%、21.30%、14.26%,累計貢獻率為84.92%,表明可以反映樣品大部分的信息,可作為各產地三葉青成分的評價指標。主成分因子荷載矩陣表中,峰1、2、3、5(蘆丁)、6、7、8、9在主成分 1上有較高載荷,說明主成分1主要反映這8個成分指標信息;同理,主成分2主要反映峰10(槲皮素)、11(山柰酚)這2個成分指標的信息;主成分3主要反映峰4、11(山柰酚)這2個成分指標的信息。以3個主要成分建立坐標系,繪制18批三葉青樣品的得分圖,如圖6所示,表明不同產地三葉青的質量存在一定的差異,可將18批三葉青樣品分為4類,其分析結果與聚類分析結果一致。

表7 三葉青樣品主成分因子荷載矩陣Table 7 Principal component factor load matrix of Tetrastigma hemsleyanum Diels et Gilg

圖6 三葉青樣品主成分分析得分圖Fig.6 Principal component analysis scores of Tetrastigma hemsleyanum Diels et Gilg
采用3個主成分得分情況,以各主成分對應的方差貢獻率為權重,按照公式F=0.4937F1+0.213F2+0.1426F3,計算綜合得分及排名,如表8所示。結果表明浙江臺州樣品中 6、7、9、10(槲皮素)、11(山柰酚)等含量較高,且在各產地樣品綜合得分為31.545,位居第1位,表明浙江臺州產三葉青質量最好。而湖南永州及廣東清遠樣品不僅各成分含量低,且綜合得分墊底,表明湖南永州和廣東清遠產三葉青質量較差。這3個產地三葉青樣品主成分得分之間的差異顯著,表明這些成分與三葉青質量存在著一定相關性可以反映各產地三葉青的整體性、差異性,為三葉青藥材的質量控制提供更有力的參考依據。

表8 三葉青樣品主成分得分、綜合得分表Table 8 Principal component scores and comprehensive scores of Tetrastigma hemsleyanum Diels et Gilg
3 結論
本研究優化了三葉青總黃酮的提取工藝,以比較各產地三葉青總黃酮得率的差異,并運用指紋圖譜結合化學模式識別對不同產地三葉青進行相似度、聚類、主成分分析及綜合評價,可更科學、全面地評價三葉青的質量。實驗結果表明,三葉青總黃酮的最佳提取工藝為:提取時間65 min,溫度83 ℃,料液比1:30 g·mL-1,乙醇濃度60%,此條件下總黃酮得率為37.89 mg·g-1。應用上述最佳提取工藝對不同產地三葉青總黃酮進行提取,結果顯示不同產地三葉青總黃酮得率差異較大,其中以福建福州、云南楚雄與貴州黔西南的總黃酮得率較高,而湖南永州以及廣東清遠的三葉青總黃酮得率較低。同時本研究優化液相色譜條件,建立各產地三葉青HPLC指紋圖譜,共標定11個共有峰,并指認出5號峰為蘆丁,10號峰為槲皮素,11號峰為山柰酚。相似度分析結果表明,18批三葉青樣品的相似度范圍為0.770~0.961,說明不同產地之間三葉青樣品具有一定的差異性。聚類分析與主成分分析結果一致顯示,18批三葉青樣品可聚為4類。綜合評價結果得出,9個產地三葉青中,以浙江臺州質量最佳,其次是云南楚雄、福建福州,廣東清遠質量最差。由以上結果可知,總黃酮得率較高的福建福州、云南楚雄的綜合評價排名靠前,而總黃酮得率較低的湖南永州、廣東清遠的綜合排名墊底,表明綜合評價的結果與各產地三葉青總黃酮的得率有一定的相關性。在后續研究中,將進一步增加總黃酮、多糖等其他成分測定,并通過功效、口感風味等對三葉青進行更全面的評價,以期為三葉青的優良品種選育、總體品質提升與資源開發利用提供一定的參考。

