扶正化瘀方通過改變急性肝損傷小鼠模型肝臟CD8+T淋巴細胞表型功能預防肝纖維化的價值分析
黃 輝, 徐列明,3, 平 鍵, 周 揚
1 上海中醫藥大學附屬曙光醫院, 上海 201203; 2 上海中醫藥大學肝病研究所, 上海 201203;3 肝腎疾病病證教育部重點實驗室, 上海 201203;4 上海中醫藥大學附屬曙光醫院腦科學研究所, 上海 201203 5 上海中醫藥大學附屬岳陽中西醫結合醫院 治未病中心, 上海 200437
肝纖維化是許多慢性肝病,包括慢性乙型肝炎和丙型肝炎、酒精濫用、膽道梗阻、自身免疫性疾病、遺傳性血液色素沉著癥和非酒精性脂肪性肝病等[1]伴隨的病理變化。肝纖維化最終可導致肝硬化、肝功能衰竭和肝癌。為了降低肝硬化和肝癌的病死率, 逆轉肝纖維化是十分必要的[2]。對肝纖維化的治療與研究在現階段仍處于十分重要的地位。
肝星狀細胞(HSC)的激活是肝纖維化產生的中心事件。肝纖維化是傷口愈合過程異常的原因,導致HSC不斷活化,肝臟瘢痕組織形成。而免疫系統特別是T淋巴細胞、NK細胞通過細胞因子參與了HSC的活化和凋亡的調控。其中T淋巴細胞介導的免疫應答涉及CD8細胞毒性T淋巴細胞, 主要通過主要組織相容性復合體Ⅰ類分子識別感染細胞上的病毒抗原[3-4]。許多針對HBV的治療性疫苗和免疫治療策略, 主要集中于如何誘導適應性免疫應答,尤其是涉及特定T淋巴細胞的適應性免疫應答,因此,確定HBV特異性效應CD8+T淋巴細胞對HBV感染控制的影響至關重要。為了更確切地揭示扶正化瘀方抗肝纖維化的免疫調節機制,本文研究經扶正化瘀方干預后小鼠肝臟CD8+T淋巴細胞對HSC的調節作用。
1 材料與方法
1.1 實驗動物 7周齡SPF級雄性C57BL/6NCrl Vr小鼠,購自北京維通利華動物有限公司[生產許可證:SCXK(京)2016-0011],飼養于上海中醫藥大學實驗動物中心,實驗動物使用許可證號:SYXK(滬)2014-0008。予以普通飲食飲水。
1.2 藥物與試劑 四氯化碳(CCl4)和橄欖油均購自國藥集團化學試劑有限公司。扶正化瘀方干粉,批號:180308,由上海現代中醫藥股份有限公司提供。將分析純級別的CCl4與橄欖油按照1∶9比例混合,配制成濃度為10%的CCl4混合溶液。RPMI-1640,Hyclone;高糖DMEM培養基(1×),Corning;胎牛血清(FBS),Corning;PercollTM,GE Healthcare公司;Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc BlockTM)、FITC Hamster Anti-Mouse CD3e、BV421 Rat Anti-Mouse CD45、PerCP-CyTM5.5 Rat Anti-Mouse CD4、APC Rat Anti-Mouse CD8a、PE-CF594 Hamster Anti-Mouse CD28,均購自BD公司;Cell to cDNA Kit PLUS、2×SYBR Green qPCR Mix,EZ Bioscience公司。BSA,上海碧云天生物技術有限公司。根據相關文獻[5]制備扶正化瘀方藥物血清。
1.3 主要儀器 生物安全柜,青島海爾特種電器有限公司;細胞培養箱,Thermo Fisher Scientific公司;小型高速冷凍離心機,德國Eppendorf公司;低溫高速離心機,JOUAN公司;全自動細胞計數儀、細胞計數板、cDNA逆轉錄儀,BIO-RAD公司;PCR擴增儀,ABI公司;流式細胞分選儀(型號:BD FACSAriaTM Cell Sorter),BD公司。
1.4 造模 參照文獻報道,對模型小鼠給予10%的CCl4腹腔注射12 h,制備急性肝損傷模型。
1.5 分組及干預 動物實驗:將18只C57雄性小鼠隨機分為正常組、模型組、扶正化瘀方組,每組6只。適應性喂養1 周。扶正化瘀方組提前給予扶正化瘀方灌胃5 d。實驗開始前1天晚上給予模型組和扶正化瘀方組小鼠濃度為10%的CCl4,以2 mL/kg體質量的劑量腹腔注射。染毒12 h后,2%戊巴比妥麻醉,腹主靜脈取血,無菌條件下,摘取肝臟用于病理觀察和淋巴細胞分選。之后行流式細胞分選術。小鼠肝星狀細胞株(JS 1)以10%血清培養,之后與CD8+T淋巴細胞以2∶1比例培養于96孔板中,重復3批。
1.6 檢測指標及方法 (1)使用微板法檢測小鼠血清中ALT、AST含量。(2)將小鼠肝組織在10%中性甲醛中浸泡固定48 h后逐級酒精脫水,二甲苯透明,56 ℃石蠟包埋,4 μm厚切片,用于HE染色,光鏡下觀察。(3)qPCR檢測JS 1中纖維狀膠原蛋白Ⅰ(Collagen type Ⅰ,Col.Ⅰ) mRNA和α-平滑肌肌動蛋白 (α-SMA) mRNA的表達(表1)。按照EZ BioscienceTMqPCR SYBR Green Master Mix Protocol試劑盒進行qPCR檢測實驗。(4)使用美國BD公司流式細胞儀(BD FACSAriaTMCell Sorter)無菌分選小鼠肝臟中CD8+T淋巴細胞。

表1 qPCR引物列表
1.7 倫理學審查 本研究方案經由上海中醫藥大學實驗動物倫理委員會審批,倫理審查號:PZSHUTCM190301014,符合實驗室動物管理與使用準則。
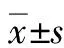
2 結果
2.1 CCl4急性造模后各組小鼠肝臟病理觀察 HE染色顯示,正常組小鼠肝小葉結構完整,肝竇無充血、出血,肝細胞排列整齊、形成肝板,門靜脈周圍及匯管區無明顯炎癥細胞浸潤和肝細胞變性壞死。模型組小鼠肝組織結構紊亂,肝細胞多胞漿疏松、水樣變性,散在氣球樣變,見灶性壞死。扶正化瘀方組小鼠肝細胞變性、壞死程度較模型組有所減輕(圖1)。

圖1 各組小鼠肝臟病理光鏡觀察(HE染色)
2.2 CCl4急性造模后各組小鼠血清ALT和AST水平變化 模型組的ALT和AST水平均顯著高于正常組(P值均<0.000 1),經扶正化瘀方預防用藥5 d的扶正化瘀方組ALT升高的幅度明顯小于模型組(P<0.001)(圖2)。
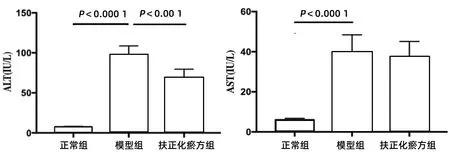
圖2 各組小鼠血清ALT和AST水平變化
2.3 各組肝臟相關細胞占總淋巴細胞比例 3組間總淋巴細胞、CD45、CD4-CD8+T、CD8+CD28-T比較差異均有統計學意義(P值均<0.01)(表2)。

表2 各組肝臟相關細胞占總淋巴細胞比例
2.4 JS 1與CCl4急性肝損傷小鼠肝臟CD8+T淋巴細胞共培養24 h及48 h后α-SMA mRNA、Col.ⅠmRNA的表達變化
2.4.1 α-SMA mRNA 對照組(JS 1單培養)、正常組(JS 1與正常小鼠肝臟的CD8+T淋巴細胞共培養)、模型組(JS 1與CCl4急性肝損傷小鼠肝臟的CD8+T淋巴細胞共培養)、扶正化瘀方組(經扶正化瘀方治療的CCl4急性肝損傷小鼠肝臟分離的CD8+T淋巴細胞與JS 1共培養)在24 h時JS 1表達α-SMA mRNA相似,各組間差異均無統計學意義(P值均>0.05)。但是共培養到48 h時,與對照組和正常組相比,模型組α-SMA mRNA的表達均明顯升高(P值均<0.01)。扶正化瘀方組的α-SMA mRNA表達升高則不明顯,與模型組間的差異具有統計學意義(P<0.01)(圖3)。
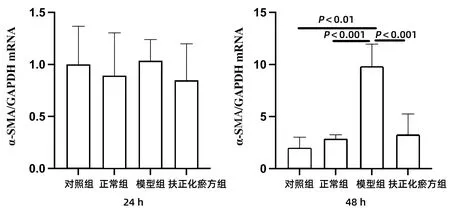
圖3 JS 1與各組小鼠肝臟CD8+ T淋巴細胞共培養后表達α-SMA mRNA的變化
2.4.2 Col.Ⅰ mRNA 在共培養24 h時間點,與模型組相比,扶正化瘀方組的JS 1表達Col.ⅠmRNA明顯下降(P<0.01)。在共培養到48 h時,與對照組和正常組相比,模型組JS 1表達Col.ⅠmRNA上升明顯(P值均<0.001);扶正化瘀方組JS 1表達Col.ⅠmRNA明顯低于模型組和正常組(P值均<0.001)(圖4)。

圖4 JS 1與各組小鼠肝臟CD8+ T淋巴細胞共培養后表達Col.ⅠmRNA的變化
3 討論
肝纖維化的發生機制相當復雜,其中HSC活化和凋亡受到免疫系統的調控,而細胞介導的免疫反應在造成肝損害方面尤為重要。肝臟富含先天免疫細胞,包括巨噬細胞、樹突狀細胞、中性粒細胞、炎癥性單核細胞、NK細胞和自然殺傷T淋巴細胞, 參與炎癥反應[6-7]。肝內淋巴細胞、NK細胞、自然殺傷T淋巴細胞和黏膜相關的不變T淋巴細胞被確定為肝臟先天免疫系統中的重要淋巴細胞[8-10]。
活化的HSC以表達α-SMA為標志,同時產生大量的細胞外基質。細胞外基質的主要成分是膠原蛋白, 與肝纖維化相關的主要是Ⅰ、Ⅲ、Ⅳ型膠原。Ⅰ型和Ⅲ型膠原蛋白在纖維化肝中明顯增多。Col.Ⅰ的沉積是肝纖維化發病機制的一個關鍵特征[11]。
扶正化瘀復方是以中醫理論為指導,根據“虛損生積”,即“正虛血瘀”的病機特點,由丹參、發酵蟲草菌粉、桃仁、松花粉、絞股藍、五味子(制)6味中藥配伍而成。具有“益精養肝,活血祛瘀”的作用。研究[12-14]發現,扶正化瘀方可以通過降低炎癥因子的表達,直接或間接調節機體免疫功能,從而發揮抗肝纖維化作用,利于肝臟功能的恢復。有研究[15]使用流式細胞術對荷瘤昆明小鼠T淋巴細胞亞群及腫瘤細胞凋亡開展研究,發現經扶正化瘀方中中藥成分桃仁的重要化學組成成分桃仁總蛋白治療后,明顯改善荷瘤小鼠CD4+/CD8+的細胞失衡狀態, 恢復機體正常的免疫狀態, 從而發揮抗腫瘤的作用。這些資料均提示,扶正化瘀方可能通過調節機體的免疫狀態來抗肝纖維化。
本實驗對扶正化瘀方進行研究發現:與對照組相比,在24 h及48 h時間點,正常組α-SMA、Col.Ⅰ的mRNA表達變化均不太明顯,這與課題組以往以健康者外周血CD8+T淋巴細胞與LX-2共培養和LX-2單培養24 h后的研究結果趨勢一致[16],說明正常CD8+T淋巴細胞并不刺激HSC的活化。
發生炎癥反應的慢性肝炎患者由于肝臟內CD8+T淋巴細胞過度存在,不能清除抗原,致使炎癥反應持續存在,促使CD8+T淋巴細胞活化,導致HSC的活化,最終導致纖維化的發生[17]。但是一項Meta分析[18]發現,CD8+T淋巴細胞或顆粒酶B產生的增加、CD4+T淋巴細胞的減少對濾泡性腫瘤預后十分有利,且CD8+T淋巴細胞可能是濾泡性腫瘤良好預后的標志性指標。Klametha等[19]對140例病毒感染和外周T淋巴細胞瘤患者外周血行流式細胞術后發現,其CD3+、CD8-、CD7-T淋巴細胞會反應性增加。而在HCV患者經過直接抗病毒藥物治療后,CD8+T淋巴細胞衰老及功能指標有所改善,利于肝纖維化治療[20]。是否因為不同疾病中CD8+T淋巴細胞表型發生改變,故而其持續增加在不同疾病中所發生的作用也不盡相同?那么CD8+T淋巴細胞在小鼠CCl4急性肝損傷模型中是產生何種作用值得思考。
本實驗對C57小鼠預防給藥扶正化瘀方5 d后再造模,獲得成功。病理觀察提示:經扶正化瘀方預先用藥后,扶正化瘀方組小鼠肝細胞變性、壞死程度較模型組均有所減輕;對小鼠血清檢測發現:扶正化瘀方組小鼠AST水平變化與模型組相似,但是ALT升高的幅度明顯小于模型組,T淋巴細胞比例降低。以上結果提示,扶正化瘀方用藥5 d,已顯示保護肝細胞的藥效。
將CD8+T淋巴細胞與JS 1共培養24 h,模型組的CD8+T淋巴細胞尚未顯示出對JS 1的明顯影響,但共培養到48 h,其促進JS 1活化的作用十分明顯,該組JS 1表達α-SMA mRNA和Col.Ⅰ mRNA遠高于對照組和正常組。說明扶正化瘀方預先給藥5 d能顯著減輕CCl4所致的小鼠急性肝損傷,扶正化瘀方能夠轉變肝臟的CD8+T淋巴細胞,使之由激活HSC促進肝纖維化,轉變為抑制HSC活化,并且隨著共培養時間的延長,抑制HSC活化的作用更加顯著,進而減緩纖維化進程,甚至有可能逆轉纖維化。這一結果與課題組以往研究[21]中,扶正化瘀方有效組患者外周血CD8+T淋巴細胞能顯著減少共培養的LX-2中α-SMA mRNA的表達(P<0.05),而扶正化瘀方無效組患者外周血CD8+T淋巴細胞這種作用不明顯的結果相一致。扶正化瘀方經治小鼠肝臟的CD8+T淋巴細胞與JS 1共培養48 h,抑制了JS 1的活化,可能是CD8+T淋巴細胞與共培養的JS 1直接接觸的結果。此結果與臨床扶正化瘀方治療有效患者外周血CD8+T淋巴細胞及其亞群通過調節細胞因子的分泌,抑制共培養的HSC活化的觀察結果不一致[16]。
以上研究結果均提示扶正化瘀方藥物血清可能通過誘導小鼠肝臟CD8+T淋巴細胞抑制共培養的JS 1活化,這種抑制作用可能主要不是通過細胞因子調控的,但尚不能明確區分藥物對HSC的直接或間接的調控作用。
囿于現階段分選技術的限制,如采用流式技術分選耗時長、對細胞損傷較大,影響活率和得率;目前市場上無快捷分離的CD28磁珠試劑盒可在小鼠應用,故動物實驗暫時無法進一步研究CD8+T淋巴細胞亞群對HSC的調節作用,期待以后能在人肝臟中開展后續研究。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:徐列明、周揚、平鍵負責課題設計,擬定寫作思路;黃輝參與收集數據,資料分析,撰寫論文;徐列明、周揚負責修改論文,指導撰寫文章并最后定稿。

