線粒體靶向抗氧化劑SS-31對膿毒癥小鼠模型急性肝損傷的影響
滿明銀, 李娜娜, 卜 月,于凱江
哈爾濱醫科大學附屬第一醫院 重癥醫學科, 哈爾濱 150000
膿毒癥是嚴重感染引起的宿主反應失調導致的致命性器官功能障礙[1]。2016年的一項薈萃分析[2]顯示,每年可能有530萬人因膿毒癥而死亡。導致膿毒癥患者死亡的主要原因是多器官衰竭。肝臟具有解毒、代謝、合成、分泌等重要功能,對于維持人體生理穩態具有重要作用[3]。肝臟也是人體重要的免疫器官[4],是膿毒癥最易損傷的器官之一[5]。研究[6]表明,膿毒癥相關肝損傷發病率為34.7%。相關研究[7]認為,肝臟的損傷常發生在膿毒癥早期。膿毒癥相關肝損傷按照發病機制可分為原發性和繼發性,繼發性肝損傷為促炎因子及活性氧自由基(ROS)等所致損傷[8]。
SS-31(在文獻中也被稱為Elamipretide, MTP-131, BendaviaTM)是一種水溶性、芳香陽離子線粒體靶向四肽。近年來在不同病因引起的線粒體功能障礙的相關研究[9-12]中,SS-31被證明可在包括腎臟、腦、心臟和骨骼肌在內的多個器官中改善線粒體功能,抑制線粒體ROS 的產生、降低促炎介質水平。但目前尚未有SS-31在膿毒癥相關急性肝損傷中的研究,尚不清楚其能否減輕膿毒癥相關肝損傷。
本實驗通過觀察SS-31能否減少膿毒癥小鼠氧自由基的釋放及促炎因子的產生,從而對膿毒癥相關急性肝損傷起到抗炎、抗氧化的保護作用,進而為膿毒癥肝損傷的防治提供新的治療靶點及靶向治療藥物。
1 材料與方法
1.1 材料
1.1.1 實驗動物 選用6~8周齡SPF級C57BL/6J 雄性小鼠(北京維通利華實驗動物技術有限公司),體質量19~23 g。實驗動物生產許可證號:SCXK(京)2016-0011;實驗動物使用許可證號:SYXK(黑)2021-004。
1.1.2 主要儀器和試劑 微量冷凍離心機(美國Thermo公司),高速冷凍離心機(美國Thermo公司),-80 ℃冰箱(美國Thermo公司),實驗室純水凈化器(美國Thermo公司),精密電子天平(瑞士Mettler Devices公司),多功能酶標儀(美國MD SpectraMax M5),小動物麻醉機(美國 Surgivet 公司);ELISA試劑盒(江蘇酶免實業有限公司),PBS 1×(500 mL)(美國SIGMA公司),SS-31(杭州專肽生物技術有限公司)。
1.2 模型制備
1.2.1 實驗動物分組 24只實驗小鼠隨機分為對照組(control組) 、治療藥物組(control+SS-31組)、膿毒癥肝損傷組(LPS組) 、膿毒癥肝損傷 +治療藥物組(LPS+SS-31組) ,每組均為 6 只。
1.2.2 模型建立 實驗小鼠在實驗前12 h 開始禁食,實驗前4 h 禁水。造模前各小鼠稱重,control組、control+SS-31組小鼠按體質量給予10 mL/kg的PBS液腹腔注射,LPS 組、LPS+SS-31組小鼠按體質量給予10 mL/kg 的LPS( PBS液稀釋至1 mg/mL) 腹腔注射。繼之control組、LPS組小鼠按體質量給予生理鹽水10 mL/kg腹腔注射,control+SS-31組、LPS+SS-31組小鼠給予SS-31(生理鹽水溶解至1 mg/mL) 10 mg/kg腹腔注射。注射器為胰島素針 30號5/16(0.3 mm×8 mm)。
1.3 取材
1.3.1 動物麻醉及取材準備 4組小鼠于模型建立12 h后使用小動物麻醉機在小鼠活體狀態下給予異氟烷實行吸入麻醉。麻醉滿意后,固定于仰臥位,于腹正中線行1.5~2.0 cm 的縱行切口,充分暴露胸腹部,取心腔血及肝組織。
1.3.2 血標本采集 充分暴露胸部后,以 1 mL注射器緩慢抽血,收集血液試管為EP管(每管內預先加入10 μL肝素抗凝),血液收集完畢后混勻,置于冰盒中靜置15 min后,4 ℃條件下離心(4000 r/min) 5 min,取上清液,分裝做好標記,-80 ℃冰箱保存,待行血清肝功能檢測。
1.3.3 組織標本采集 小鼠處死后,打開腹腔,游離并取出肝臟,每只小鼠取出肝臟的左外側葉置入4%多聚甲醛溶液中固定48 h,然后進行石蠟包埋、切片,并行HE染色,觀察病理組織學改變;剩余肝臟組織保存于-80 ℃冰箱。
1.4 檢測方法
1.4.1 小鼠血清指標檢測 取上清液,采用ELISA試劑盒檢測小鼠血清中ALT、AST的濃度值。依次將5組不同濃度的標準品加入室溫平衡20 min后酶標板中,將解凍后的10 μL待檢樣品和40 μL樣品稀釋液先后加入預先設計的待檢樣品孔中,除空白孔外,每孔加入由過氧化物酶(HRP)標記的抗體 100 μL,用封板膜封住反應孔,37 ℃恒溫箱中孵育 60 min。倒掉上層液體,拍干,用稀釋后的洗滌液反復洗板 5 次,在所有孔中先后加入底物A、B各 50 μL,37 ℃避光孵育15 min。加入終止液 50 μL,通過多功能酶標儀測定 450 nm 處吸光度值,再根據計算公式得出實際樣品濃度。操作嚴格按照ELISA試劑盒說明書進行。
1.4.2 小鼠肝臟病理切片 小鼠肝臟組織浸泡于甲醛溶液中固定48 h后,將肝臟組織進行修型,放置于石蠟包埋盒中經過脫水、透明、浸蠟等過程,進行包埋。包埋后進行組織切片,厚度為 4 μm,將載有石蠟切片的載玻片置于60 ℃烤箱中烘烤2 h,置于室溫過夜。石蠟切片經脫蠟、組織軟化、蘇木精染色、鹽酸乙醇分化、伊紅染色、脫水、透明后封片。HE染色后切片于顯微鏡下觀察其病理變化。
1.4.3 ELISA 法測定小鼠肝組織ROS、超氧化物歧化酶(SOD)、IL-1β、IL-6、TNFα 水平 取0.1 g 肝組織,置于冰上剪碎后置于EP管中,加入 PBS 液900 μL,充分研磨至組織勻漿,4 ℃條件下離心(3000 r/min)20 min,取上清液并做好標記,并使用ELISA試劑盒進行檢測。檢測過程嚴格按照ELISA試劑盒檢測方法及說明書進行。
1.5 倫理學審查 本研究方案經由哈爾濱醫科大學實驗動物倫理委員會審批,批號:2021037,符合實驗室動物管理與使用準則。

2 結果
2.1 各組小鼠表現 各組小鼠模型制備完成后12 h觀察各組小鼠狀態。4組小鼠均無死亡,control組及control+SS-31組小鼠較造模前未見明顯異常表現;LPS組及LPS+SS-31組小鼠出現不同程度的精神萎靡、少動、蜷縮、毛發豎起、大便不成形等情況,其中LPS+SS-31組小鼠上述異常表現程度較LPS組輕。各組間小鼠體質量比較,差異無統計學意義(表1)。
2.2 各組小鼠血清指標比較 為檢測SS-31能否減輕膿毒癥肝損傷,比較4組小鼠血清中 ALT、AST水平。與control組比較,LPS組小鼠血清中 ALT、AST水平均顯著升高(P值均<0.05);與LPS組小鼠比較,LPS+SS-31組小鼠血清中 ALT、AST水平均顯著降低(P值均<0.05)(表1)。
2.3 各組小鼠氧化應激指標比較 為檢測SS-31能否減輕膿毒癥小鼠氧化應激,比較4組小鼠肝組織勻漿上清液中ROS、SOD水平。與control組比較,LPS組小鼠中ROS、SOD水平顯著改變(P值均<0.05);與LPS組小鼠比較,LPS+SS-31組小鼠中ROS水平顯著降低(P<0.05)(表1)。
2.4 各組小鼠炎性指標水平比較 為檢測SS-31能否改變膿毒癥小鼠肝組織中炎癥介質水平,比較4組小鼠肝組織勻漿上清液中TNFα、IL-1β、IL-6水平。與control組比較,LPS組小鼠中TNFα、IL-1β、IL-6水平均顯著升高(P值均<0.05);與LPS組小鼠比較,LPS+SS-31組小鼠中TNFα、IL-1β、IL-6水平顯著降低(P值均<0.05)(表1)。
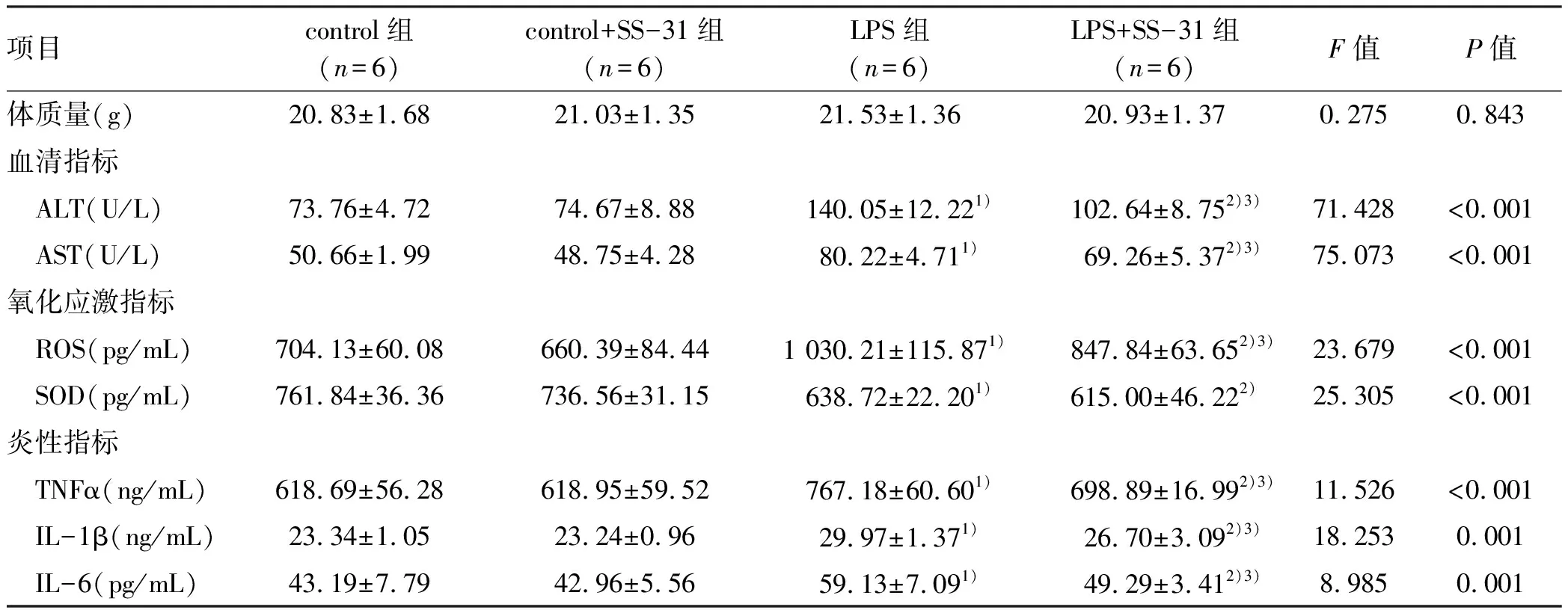
表1 4組小鼠各指標比較
2.5 各組小鼠肝組織病理切片比較 與 control組比較,LPS 組小鼠肝組織切片HE染色顯示出肝小葉結構破壞、炎性細胞浸潤、細胞間隙模糊、肝細胞腫脹; LPS+SS-31組炎性細胞浸潤減少,肝細胞腫脹減輕(圖1)。

注:a, control組;b,control+SS-31組;c,LPS組;d,LPS+SS-31組。圖1 肝組織病理切片(HE染色,×400)
3 討論
本實驗采用小鼠動物模型,通過監測ALT、AST來反映不同組別膿毒癥小鼠的肝損傷情況,并分別從氧化應激、炎癥反應、組織病理等多個角度進行分析,探討線粒體靶向肽SS-31對小鼠膿毒癥肝損傷的作用。
膿毒癥時易引起包括肝臟在內的多器官損傷,進一步導致器官功能障礙甚至衰竭,在微觀上線粒體是膿毒癥時易受損傷和出現功能障礙的細胞器,膿毒癥所引起的線粒體功能障礙在影響機體ATP能量產生和供應的同時,也引起了大量氧自由基的釋放,進一步加重了機體損傷,促進了膿毒癥器官損傷的發展。而肝臟作為人體內最大的解毒和免疫器官,當肝細胞受到嚴重損傷時,其合成、代謝、解毒、分泌與免疫功能發生嚴重障礙,其對內毒素的清除上發生障礙,反過來加劇了機體的損傷。既往相關研究[9,13-15]表明,SS-31可通過改善線粒體氧化呼吸鏈中復合物活性、穩定心磷脂改善膜的生物物理性能、減輕線粒體質子泄漏、減少ROS產生等途徑改善線粒體功能,減少ROS釋放。
本實驗研究結果顯示,與control組相比,小鼠腹腔注射LPS后12 h,血清中ALT、AST水平均顯著升高,表明 LPS 誘發小鼠產生了膿毒癥,發生了肝損傷,這與既往研究[16]結果一致。本實驗結果表明,使用線粒體靶向肽SS-31后可以減輕膿毒癥小鼠的急性肝損傷,且與LPS組相比發現腹腔注射SS-31后降低了膿毒癥小鼠模型中的ROS含量,這可能是通過SS-31改善了膿毒癥小鼠體內的線粒體功能實現的。ROS可作用于核因子(NF) -κB、活化蛋白-1等氧化還原敏感性轉錄因子,從而調節促炎基因的轉錄,增加炎癥介質釋放,加重炎癥反應。本實驗結果表明,SS-31可減少小鼠高表達的TNFα、IL-1β、IL-6等炎性因子,這與既往研究[17-18]一致。既往大量研究[19]證實,NF-κB是膿毒癥炎癥反應的重要通路,SS-31可下調年齡相關的NF-κB的激活,SS-31通過改善線粒體功能,減少ROS的釋放,進而減少NF-κB通路的激活及炎癥介質釋放可能是SS-31減輕炎癥反應的重要機制之一。氧化應激產生的大量ROS可導致體內SOD消耗,使SOD濃度降低,但本實驗使用SS-31未能逆轉SOD的降低,這可能與SS-31使用后仍超過某一“閾值”導致SOD被消耗有關。既往相關研究[20-21]證明了SS-31應用的安全性與耐受性良好,在本實驗中,與對照組相比,未發現注射SS-31藥物后小鼠產生不良反應,為SS-31應用的安全性提供了支持。
綜上所述,本實驗結果表明在膿毒癥小鼠腹腔注射SS-31治療后,可減少體內ROS的產生,下調膿毒癥時高表達的炎性因子,從而減輕小鼠膿毒癥肝損傷。通過對線粒體功能開展多方面機制研究,線粒體靶向藥物有望為膿毒癥的治療提供新的靶點。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突,特此聲明。
作者貢獻聲明:滿明銀負責課題設計,資料分析,撰寫論文;李娜娜參與收集數據,修改論文;卜月負責實驗及修改論文;于凱江負責擬定寫作思路,指導撰寫文章并最后定稿。

