基于CT動脈晚期特征列線圖術前預測胃癌分化程度
王玉婷,譚玲玉,喬香梅,季長風,李琳,劉松
胃癌是全球第五大常見癌癥,也是癌癥死亡的第三大原因[1]。胃癌的分化程度對治療方案和預后有很大影響,低分化往往伴隨著預后不良[2-3]。目前,胃癌分化程度的術前評估主要依靠內鏡活檢,而內鏡取樣僅限于粘膜表面[4]。對于相對較大的腫瘤,取樣組織為中分化/高分化,但腫瘤深部可能含有分化差的成分。
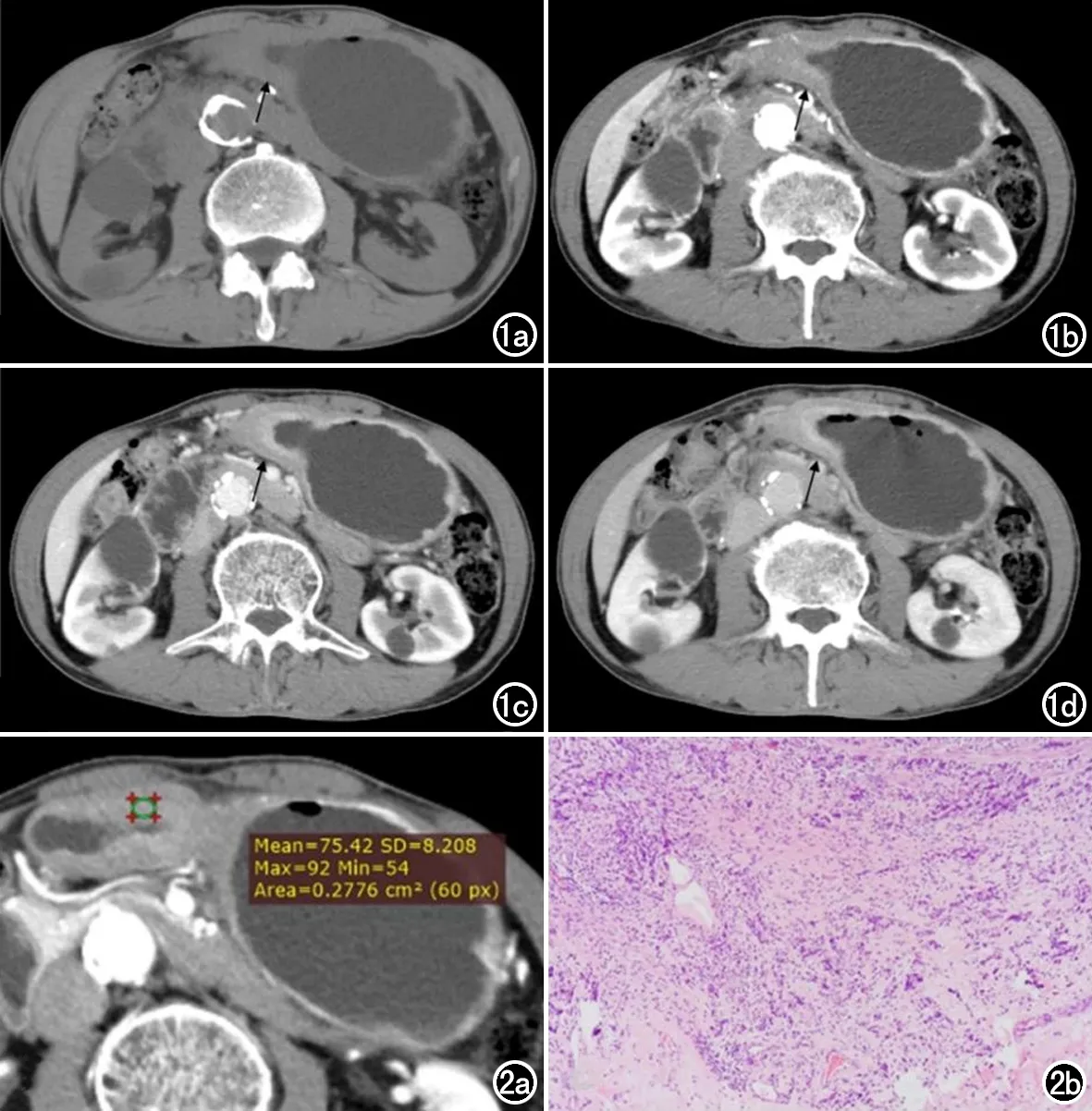
圖1 67歲,男,低分化胃癌,位于胃體和胃竇部。a)平掃期、b)40s 動脈晚期示病灶(箭)與鄰近粘膜分界較清(明顯增強)、病灶粘膜線中斷,彌漫性增厚,浸潤性生長及“分層”征;c)門脈期;d)延遲期。 圖2 男,67歲,胃竇癌。a)40 s動脈晚期病灶的最大橫軸面上勾畫興趣區,并在其他三個時期的同一橫軸面上復制;b)病理確診為低分化胃癌(HE,× 100)。
多層螺旋CT可以全面評估腫瘤形態,是目前胃癌常用的影像評估手段[5]。不同分化程度的胃癌,因惡性程度不同,CT形態學表現有差異。如何更好的顯示胃癌CT形態學特征尤為重要。胃癌起源于粘膜層,而粘膜層在動脈晚期強化明顯[6]。Lee等[7]的研究也表明,早期胃癌在動脈晚期(38~45 s)能夠更好的顯示典型和非典型病灶的增強模式。而門脈期(60~70 s)則更多用于評估淋巴結的轉移及TNM分期[8-9]。故筆者假設動脈晚期可能會顯示胃癌更多的形態學特征,也許可以找到不同分化程度胃癌的代表性特征。之前一篇文獻也表明,胃癌的原發病變在動脈晚期中顯示良好[6]。 因此,本研究旨在使用基于40 s動脈晚期CT圖像參數的列線圖術前預測胃癌分化程度。
材料與方法
1.病例資料
回顧性納入本院2019年4月-2020年5月經病理證實的胃癌患者的病例資料。納入標準:①經手術病理證實為胃癌;②術前2周內行腹部增強CT。排除標準:①術前行胃癌系統或局部治療(n=8);②無組織學分化資料(n=6);③無40 s動脈晚期圖像(n=29);④病灶體積小(長徑<1 cm),CT圖像上難以辨認(n=26);⑤胃充盈不佳(n=15);⑥呼吸或胃腸蠕動偽影嚴重(n=3)。最終納入188例患者,按2:1分為訓練組和驗證組,訓練組126例,驗證組62例。訓練組低分化胃癌85例,中/高分化胃癌41例,驗證組低分化胃癌42例,中/高分化胃癌20例。訓練組中男94例,女32例,年齡31~ 91歲,中位年齡64歲。此外本研究額外納入62例2018年7月-2019年4月30 s動脈期胃癌患者資料。
2.檢查設備和方法
采用64排螺旋CT(uCT 780,聯影)。所有患者在檢查前禁食6 h以上,飲用600~1000 mL溫水使胃擴張,并于檢查前對患者做好呼吸訓練。患者仰臥位,腳先進,掃描范圍為上腹部或全腹部。平掃后,采用高壓注射器以3.0 mL/s的流率經靜脈注射對比劑碘海醇(歐乃派克,350 mg I/mL),劑量1.5 mL/kg。注射對比劑40 s、70 s和180 s后分別采集動脈晚期(LAP)、門脈期和延遲期圖像。CT掃描參數為:管電壓100~120 kV,管電流150~250 mA,層厚5 mm,層間隔5 mm,視野35~50 cm,矩陣512×512,旋轉時間0.7 s,螺距1.0875。
3.圖像分析
由兩名醫師在對患者術后病理不知情的情況下共同分析CT圖像。兩人對動脈晚期CT圖像上病灶進行評估,并達成共識,具體如下:主要部位(賁門胃底、胃體、胃竇);范圍(1個部位,>1個部位);方位(小彎、大彎、前壁、后壁);環周范圍(1/4圈、2/4圈、3/4圈、4/4圈);粘膜線狀態(中斷型、增厚型);形態(彌漫增厚型、隆起型);“C”征(無、有):邊界清晰的隆起型病灶伴有潰瘍表現為“C”征[6];浸潤性(無,有);潰瘍(無,有);漿膜面不光整(無,有);鄰近脂肪渾濁(無,有);“分層”征(無,有)[6]。代表動脈晚期低分化胃癌病灶CT圖像見圖1所示。
醫師1在動脈晚期軸位圖像上腫瘤最大層面勾畫興趣區(region of interest,ROI),包含強化最明顯的區域(圖2),將其復制到相同層面的其它三期圖像上。將腫瘤在平掃、動脈晚期、門脈期及延遲期的平均CT值分別記錄為Non-value mean、AP value mean、PP value mean及DP value mean。并記錄各期CT值的最大值和最小值。將平掃、動脈晚期、門脈期、延遲期的平均CT值作為參考,計算增強后腫瘤衰減差異(△mean A-N、△mean P-N、△mean D-N、△mean P-A、△mean D-A、△mean D-P),對比增強比(contrast enhancement rate,CER)按以下公式計算:CERAP/PP/DP=△mean A-N/△mean P-N/△mean D-N ÷Non-value mean。由醫師1勾畫病灶ROI提取的CT值相關參數預測胃癌分化程度。醫師2重復上述步驟用來評估觀察者間的一致性。
4.多參數模型建立
將訓練組單變量分析中差異有統計學意義(P<0.05)的變量特征輸入二項式Logistic回歸計算出最佳模型。從最高的P值開始,采用了基于似然比檢驗的向后消除法,舍棄對預測沒有顯著影響的特征,從而得出最簡約的模型。將多參數模型中的預測變量用R軟件包(3.5.2版:http://www.Rproject.org)構建列線圖。
5.病理評估
胃癌切除術后,所有標本均按標準病理程序處理。根據WHO消化系統腫瘤分類(2019年版)[10]對每位患者組織學分化進行回顧性評估和記錄,腫瘤分化分為兩組,第1組為低分化,第2組為中/高分化。此外,此次研究還收集了納入患者的術前內鏡病理結果,并與術后病理結果對比。
6.統計學分析
采用SPSS(22.0版Microsoft Windows x64,SPSS)、MedCalc統計軟件(19.6.1版MedCalc Software Ltd,Ostend,Belgium;http://www.medcalc.org;2020)和R軟件包(3.5.2版:http://www.Rproject.org)進行統計學分析。分類變量采用chi-square或Fisher精確檢驗評估(n<5)。連續變量的正態分布通過Shapiro-Wilk檢驗進行評估。根據正態性檢驗結果,采用Mann-WhitneyU檢驗分析低分化和中/高分化胃癌組間的差異,并用中位數、第1與第3四分位數表示。通過受試者操作特征(receiver operating characteristic,ROC)曲線評估其診斷效能,并計算ROC曲線下面積(area under curve,AUC)、敏感度、特異度和符合率。采用決策曲線分析(decision curve analysis,DCA)評估列線圖的臨床實用性。采用Kappa檢驗評估形態學特征的一致性(0.000~0.200,差;0.201~0.400,一般;0.401~0.600,中等;0.601~0.800,好;0.801~1.000,優)。CT值相關參數的觀察者間一致性用組內相關系數(intraclass correlation coefficient,ICC)評估(0.000~0.200,差;0.201~0.400,一般;0.401~0.600,中等;0.601~0.800,好;0.801~1.000,優)。P<0.05表示差異有統計學意義。
結 果
1.胃癌患者人口統計數據及CT圖像形態特征評估
40s LAP訓練組低分化和中/高分化胃癌患者的CT形態學特征及人口統計數據見表1,30s動脈期的CT形態學特征及人口統計數據見表2。
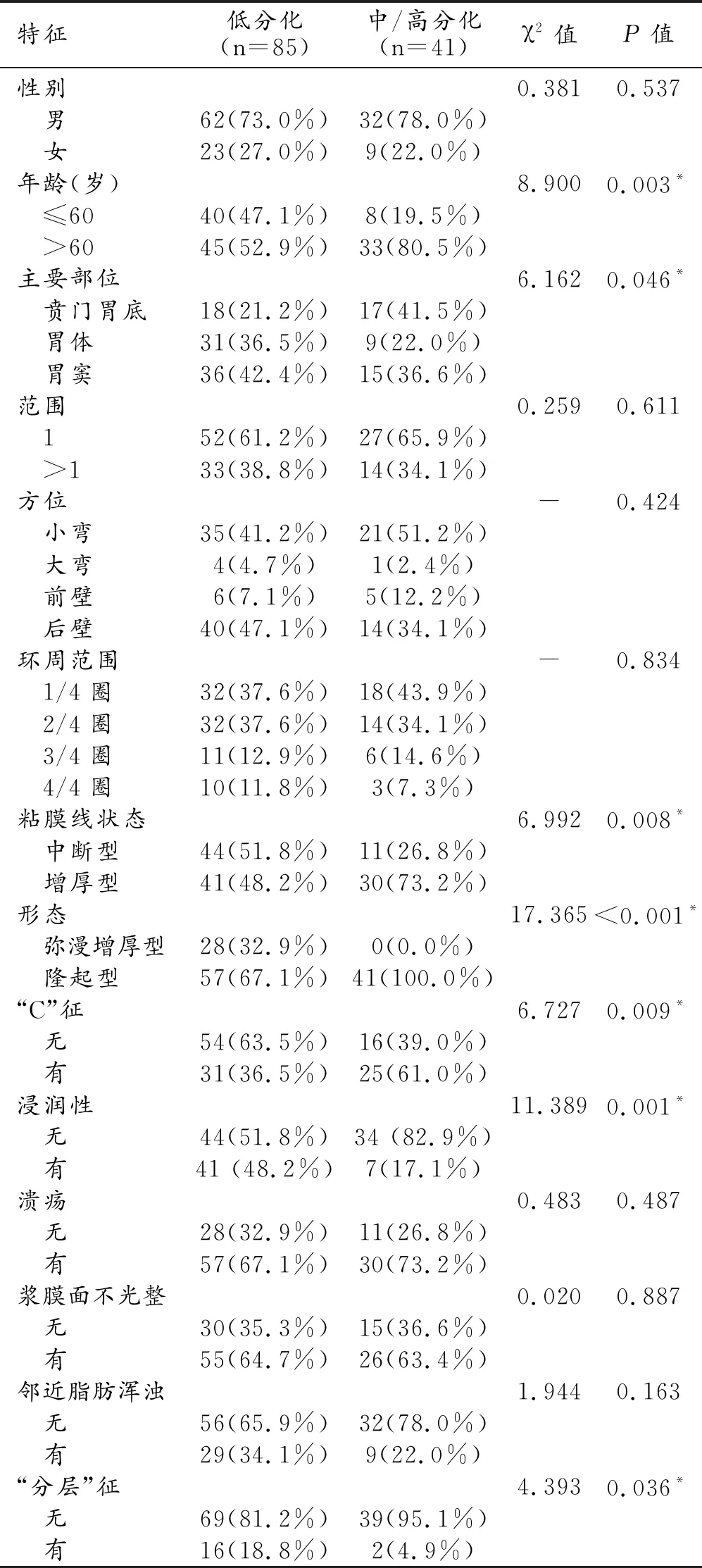
表1 兩組患者的CT形態學特征及人口統計數據的單因素分析
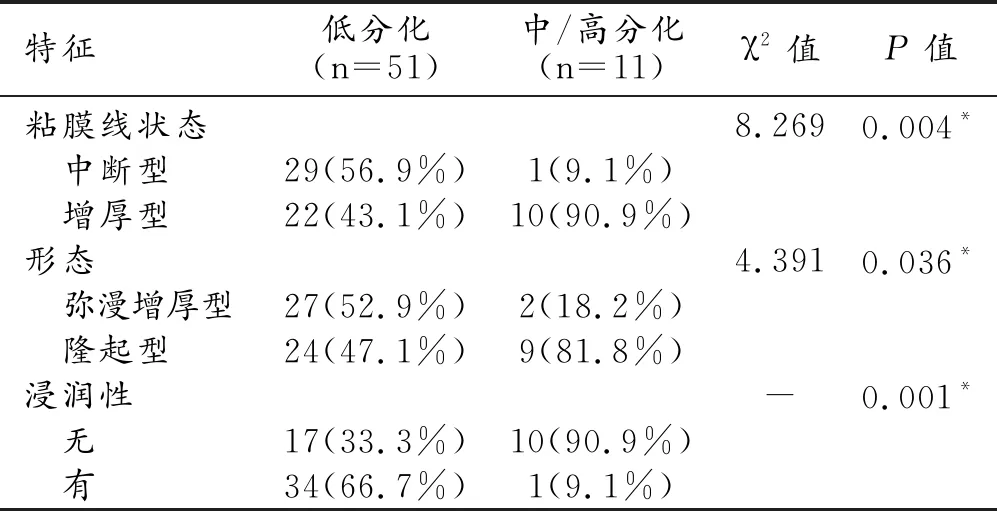
表2 兩組患者的CT形態學特征及人口統計數據的單因素分析結果
年齡及40 s動脈晚期中主要部位、粘膜線狀態、形態、“C”征、浸潤性及“分層”征在低分化、中/高分化胃癌組間差異有統計學意義(P<0.05)。性別和其他多項40s動脈晚期CT圖像特征差異均無統計學意義。此外,分化較差的胃癌容易出現粘膜線中斷、彌漫性增厚、浸潤性生長和“分層”征。而30s動脈期中僅粘膜線狀態、形態和浸潤性在兩組間差異有統計學意義(P<0.05)。
2.常規CT值參數分析
40s LAP訓練組低分化和中/高分化胃癌的定量CT參數的單變量分析結果見表3所示。低分化胃癌的延遲期平均值(P=0.005)、最大值(P=0.007)和最小值(P=0.046)均顯著高于中/高分化胃癌。△mean D-N,△mean D-A和CERDP在低分化和中高分化胃癌組間差異均有統計學意義(均P<0.05)。30s動脈期CT值相關參數在兩組間有5組參數差異有統計學意義(P<0.05)。
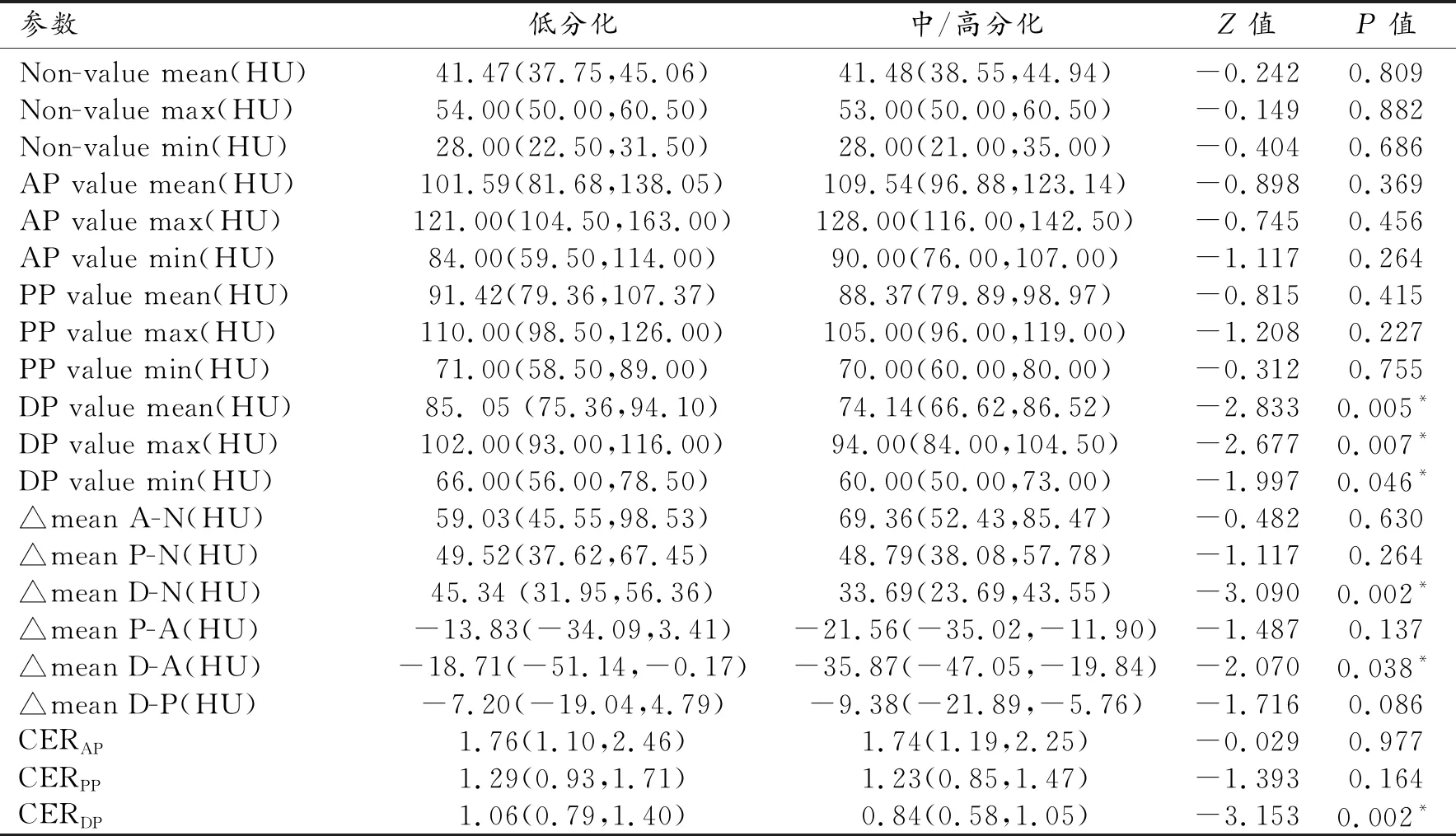
表3 40s動脈晚期訓練組低分化和中/高分化胃癌患者CT值相關參數的統計描述和單變量分析
3.多參數二元Logistic回歸模型及列線圖構建
40s LAP訓練組多參數二元Logistic回歸結果見表4,40s LAP訓練組和驗證組ROC曲線見圖3。訓練組預測低分化胃癌的最佳模型由年齡、浸潤性、形態、“C”征、DP value mean和DP value min等參數組成。多參數模型可預測低分化胃癌,以擬合參數≥0.62為閾值(AUC=0.849,P<0.001)診斷低分化胃癌的敏感度和特異度分別為80.00%和80.49%。Hosmer-Lemeshow檢驗結果示模型卡方值為4.182,P值為0.840,提示模型擬合良好。將該模型應用于驗證組得到的AUC值為0.762。基于訓練組多參數二元邏輯回歸模型構建的預測低分化胃癌的列線圖見圖4。驗證組中基于回歸的多參數模型列線圖的決策曲線分析見圖5,列線圖在一定的閾值范圍內臨床凈獲益率最高。
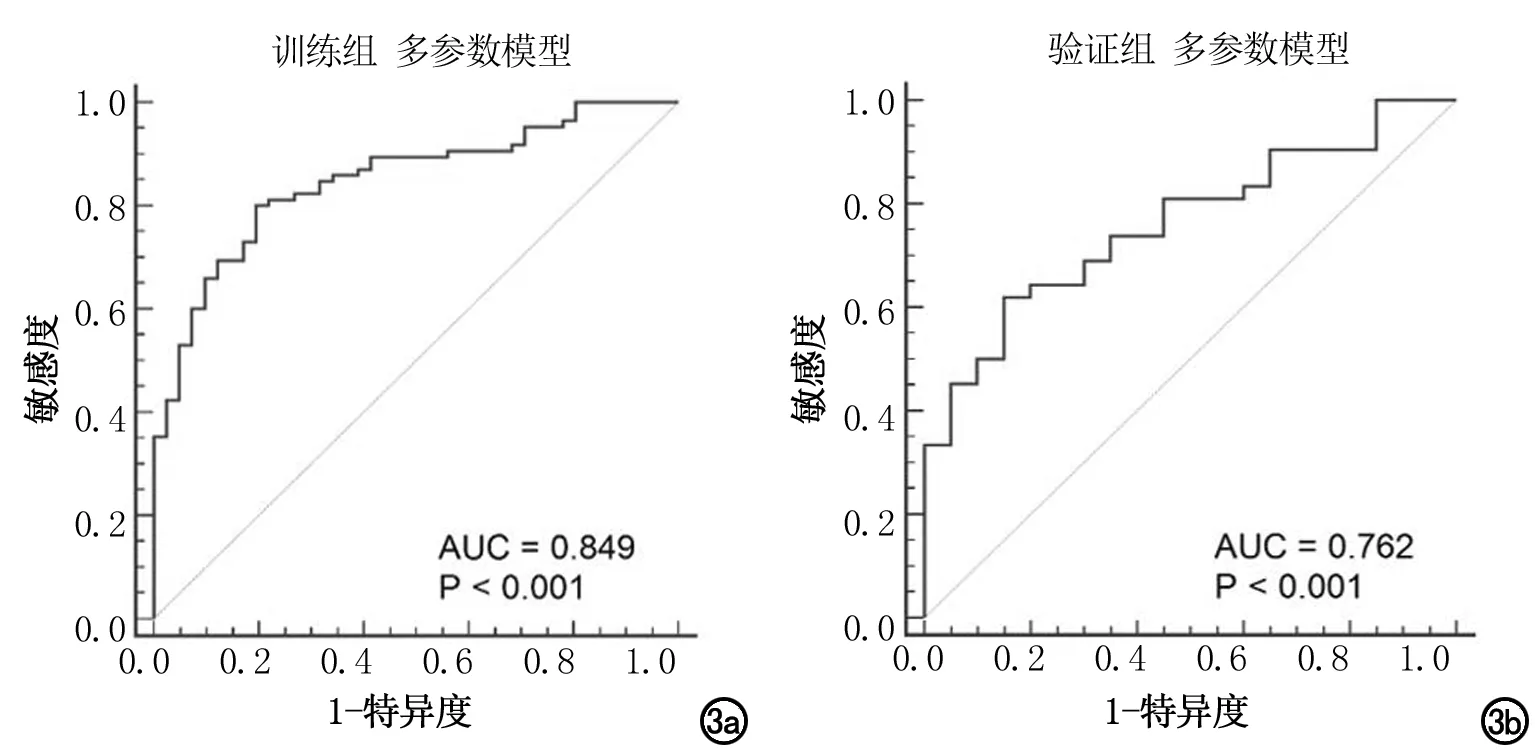
圖3 40 s LAP訓練組和驗證組預測低分化胃癌多參數模型的ROC曲線圖。聯合年齡、浸潤性、形態、“C”征、DP value mean和DP value min的多參數模型。a)訓練組,AUC為0.849;b)驗證組,AUC為0.762。
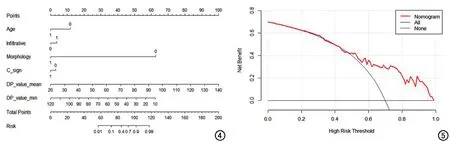
圖4 聯合40s動脈晚期CT圖像形態學特征、常規CT值參數和年齡的訓練組多參數Logistic回歸模型預測低分化胃癌的列線圖。 圖5 驗證組中基于回歸的多參數模型列線圖的決策曲線分析。縱坐標表示凈獲益率,橫坐標為閾值概率。紅線代表列線圖。藍線代表所有患者均為低分化胃癌。黑線代表所有患者均為中/高分化胃癌。和所有均為低分化胃癌患者(藍線)或均為中/高分化胃癌患者(黑線)相比,列線圖在一定的閾值范圍內臨床凈獲益率最高。
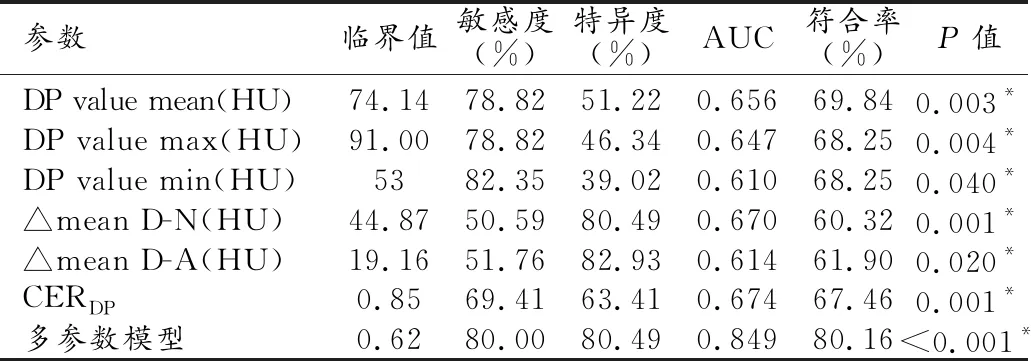
表4 CT值參數及多參數模型預測低分化胃癌的診斷效能
4.術前內鏡病理與術后病理的比較
40s LAP訓練組納入的126位患者中有108位有術前內鏡病理信息,在這108位患者中有86例(79.63%)與術后病理結果一致。
5.觀察者間一致性評估
40s LAP訓練組所有常規CT值參數都顯示出良好至優秀的觀察者間一致性(ICC=0.646~0.927)。有17個參數觀察者間一致性為優。Non-value min、Non-value max、△mean D-P和CERDP均顯示好的觀察者間一致性。形態學特征中有7個形態學參數表現為優秀的觀察者間一致性(0.801~1.000),5個形態學參數表現為良好的觀察者間一致性(0.601~0.800)。
討 論
胃癌分化程度與治療方案及預后有關,低分化往往伴隨著預后不良[2-3]。目前,胃癌分化程度的術前評估主要依靠內鏡活檢,而內鏡活檢存在抽樣誤差。本研究對比訓練組術前內鏡病理和術后病理結果發現其準確率為79.63%。
本研究發現訓練組40s LAP圖像的形態學特征,包括主要部位、粘膜線狀態、形態、“C”征、浸潤性和“分層”征在低分化和中/高分化胃癌組間差異有統計學意義。本研究中訓練組低分化的胃癌患者更容易發生在胃竇(36/85),而中/高分化的胃癌則易出現在賁門胃底(17/41),這也與張云等[11]的研究結果一致。分化較差的胃癌更多表現為粘膜線中斷(44/85),這可能與腫瘤分化程度越低,腫瘤侵襲性越強,惡性程度越高有關,粘膜結構更容易受到破壞。訓練組中所有中/高分化的病灶形態均為隆起型(41/41)。中/高分化的胃癌仍保留正常腺體的管狀結構,故導致腫塊樣病灶。“C”征實際上是邊界清晰的隆起型病灶伴有潰瘍,較多出現于中/高分化的胃癌(25/41)。大部分浸潤性生長的病灶(41/48)分化不良。分化差的腫瘤細胞形態不規則,侵襲性強,易發生浸潤性生長[2-3]。“分層”征較多出現于低分化的胃癌(16/18),這也與王芳等人研究一致[12]。這有可能是由于彌漫型胃癌大多分化較差,其增強CT表現為分層強化或不均勻強化[13-14]。
在本研究中,40s LAP圖像上有6組形態學特征在兩組間差異有統計學意義,而在30s動脈期中僅有粘膜線狀態、形態和浸潤性這3個參數差異有統計學意義,故40s LAP能更好的顯示胃癌形態學特征。此外,筆者還對40s LAP和30s動脈期圖像的常規CT值參數進行評估,結果主要為門脈期和延遲期CT值相關參數在預測胃癌分化程度方面有較大意義。
本研究中,訓練組胃癌患者40s LAP圖像的多個CT形態學特征和CT值參數在低分化和中/高分化胃癌組間差異有統計學意義。聯合40s LAP圖像中CT形態學特征、常規CT值參數和年齡的多參數模型可提高診斷效能。此外,本研究還采用列線圖直觀預測分化不良的風險。
近年來,多參數預測模型得到了廣泛的應用[15-16]。因此,在訓練組中建立一個聯合40s LAP圖像的形態特征、常規CT值參數和年齡為一體的多參數模型,其AUC為0.849,大大提高了診斷效能。此外,本研究還增加了驗證組,將該模型放入驗證組也得到了較好的診斷效能(AUC=0.762)。列線圖的使用解決了多參數模型的可視化問題[17]。因此,筆者也將其應用于日常工作中,可視化預測分化不良胃癌的風險[18]。
本研究也存在一些局限性。第一,本研究為回顧性研究,單中心的樣本量相對較少,有待多機構大樣本驗證,進一步提高模型準確度。第二,沒有使用放射組學等高維參數,但形態學參數更容易讀取和提取。第三,本研究使用的是同一臺螺旋CT,沒有經過其他機器的驗證。
綜上所述,40s LAP圖像中的多個形態學特征和CT值參數在低分化和中/高分化胃癌組間差異有統計學意義。此外,聯合40s LAP圖像中的形態學特征、常規CT值參數和年齡的列線圖有助于術前可視化預測胃癌分化程度。

