200例高尿酸血癥患者血清炎性因子水平與其HOMA-IR指數的關聯性分析
張永敏
內黃縣人民醫院(河南 安陽 456300)
高尿酸血癥為臨床常見代謝系統疾病,具有較高發病率,據報道,我國伴有癥狀或無癥狀高尿酸血癥患者達1.2億,對患者身心健康造成一定影響[1-2]。且隨著社會發展、人們生活習慣及飲食結構改變,高尿酸血癥發病人群呈逐漸年輕化趨勢,給我國社會衛生事業發展帶來較大壓力,已成為當前社會不容忽視的健康問題。高尿酸血癥為痛風重要生物化學基礎,可造成病情加重,目前尚無根治辦法,早期診斷、治療為臨床控制高尿酸血癥病情進展關鍵措施。既往研究發現,C反應蛋白、白介素水平同2型糖尿病、肥胖等胰島素抵抗疾病密切相關,可反映機體胰島素敏感性,且超敏-C反應蛋白(hs-CRP)已成為代謝綜合征重要預測因子,目前世界衛生組織(WHO)已將高尿酸血癥列為代謝綜合征診斷標準之一[3-4]。鑒于此,本研究選取我院200例高尿酸血癥患者為研究對象,旨在探討其血清hs-CRP、白介素-18(IL-18)水平與其胰島素抵抗(HOMA-IR)指數的關聯性,為高尿酸血癥診治提供參考。現報告如下。
1 資料與方法
1.1一般資料 選取我院2018年3月-2020年2月高尿酸血癥患者200例為高尿酸血癥組,同時選擇同期健康體檢者75例為對照組。對照組男47例,女28例,年齡25~68歲,平均(36.25±8.22)歲;體質量49~78kg,平均(64.77±6.12)kg。高尿酸血癥組男122例,女78例,年齡24~69歲,平均(35.77±8.63)歲;體質量51~79kg,平均(65.39±6.03)kg。兩組基線資料(性別、年齡、體質量)均衡可比(P>0.05)。
1.2選取標準 (1)納入標準:高尿酸血癥組符合高尿酸血癥相關診斷標準[5];高尿酸血癥組空腹血清尿酸≥420mol/L;知情本研究并簽署同意書。(2)排除標準:重要臟器存在嚴重功能障礙者;合并甲亢、癌癥放化療后患者;精神障礙性疾病;高尿酸血癥組對別嘌醇片過敏者;近1周內服用促進尿酸排泄藥物者;合并糖耐量降低、高血壓、肥胖者。
1.3方法
1.3.1 檢測方法 指導所有入選對象均于檢查前禁飲、禁食8~12h。采用無菌真空采血管抽取其靜脈血5ml,采用離心機設置轉速為3500r/min、半徑為8cm進行分離,分離時間10min,取上層血清,利用酶聯免疫吸附法測定血清hs-CRP、白介素18(IL-18)水平,hs-CRP、試劑盒購自上海淳麥生物科技有限公司,IL-18試劑盒購自南京賽泓瑞生物科技有限公司;利用化學發光法檢測研究對象空腹胰島素(FINS)(羅氏診斷,批號:215871),利用氧化酶比色法檢測研究對象空腹血糖(FPG)(羅氏診斷,批號:205413),由同一位具有5年及以上檢測經驗的檢驗師依照儀器、試劑盒說明書進行操作。基于計算穩態模型計算受試者的HOMA-IR指數。HOMA-IR指數計算公式:(FPG×FINS)/22.5。
1.3.2 治療方法 高尿酸血癥組所有入選對象均給予飲食指導,告知患者禁食黃豆、動物內臟、臘味制品、魚皮、菠菜、啤酒等,并給予別嘌醇片(廣州白云山醫藥集團股份有限公司白云山制藥總廠國藥準字H44021492,規格:0.1g)治療,口服,0.1/次,3次/d。持續治療3個月。
1.4觀察指標 (1)比較兩組炎性因子(hs-CRP、IL-18)水平。(2)比較兩組FPG、FINS、HOMA-IR指數。(3)HOMA-IR指數與hs-CRP、IL-18水平關聯性。(4)比較兩組治療前、治療3個月后炎性因子(hs-CRP、IL-18)水平。
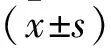
2 結果
2.1炎性因子水平 高尿酸血癥組hs-CRP、IL-18水平高于對照組(P<0.05),見表1。
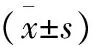
表1 炎性因子水平
2.2FPG、FINS水平及HOMA-IR指數 高尿酸血癥組FINS水平及HOMA-IR指數高于對照組(P<0.05),FPG水平與對照組比較,差異無統計學意義(P>0.05),見表2。
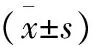
表2 FPG、FINS水平及HOMA-IR指數
2.3炎性因子水平與HOMA-IR指數關聯性 經Pearson分析可知,hs-CRP、IL-18水平與HOMA-IR指數存在正相關關系(P<0.05)。見表3。
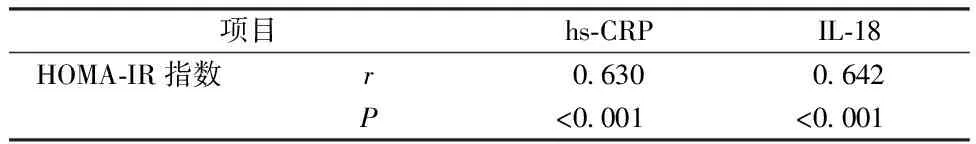
表3 關聯性分析
2.4治療前后炎性因子水平 高尿酸血癥患者治療3個月后血清hs-CRP、IL-18水平低于治療前(P<0.05)。見表4。
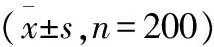
表4 治療前后炎性因子水平
3 討論
高尿酸血癥指機體于正常嘌呤飲食狀況下,空腹血尿酸水平女性非同日兩次>360mmol/L、男性非同日兩次>420mmol/L,為多種臨床疾病起始或誘發因素,與心腦血管系統、代謝性疾病發生及發展密切相關[6]。因高尿酸血癥具有較高復發率,已成為當前臨床廣泛關注健康問題,故需對其病理機制進行不斷深入探究,以期為臨床診斷、治療提供有效指導。
既往研究發現,高尿酸血癥患者脂代謝指標、體質指數、白介素6水平均存在明顯升高,表明高尿酸血癥發生同脂代謝異常、肥胖、炎性因子水平等密切相關[7]。本研究結果顯示,高尿酸血癥組血清hs-CRP、IL-18水平高于對照組(P<0.05),提示高尿酸血癥發生與血清hs-CRP、IL-18水平具有顯著相關性,進一步證實既往研究中高尿酸血癥發生同炎癥因子有關。本研究發現尿酸作為高尿酸血癥發生病理生理學基礎之一,在機體氧化應激反應過程中發揮重要作用。患者血液中單鈉尿酸鹽晶體可有效識別細胞表面Toll樣受體2激活炎性反應,引發瀑布聯級反應:可參與免疫應答、炎癥應答生理病理過程,于免疫應答中發揮“第二信使”作用,內源性刺激因子造成血管內皮細胞炎癥損傷,激活白細胞及血管內皮細胞黏附、刺激作用,引起血管內皮細胞結構、功能發生紊亂,進而導致炎癥因子如hs-CRP、IL-18生成增加,可形成炎癥反應級聯效應,若未及時控制,可造成病情進一步加重。
胰島素抵抗為高尿酸血癥患者主要癥狀之一,本研究選用HOMA-IR指數反映機體胰島素敏感度,結果顯示,高尿酸血癥組FINS水平及HOMA-IR指數高于對照組(P<0.05),提示高尿酸血癥患者存在胰島素抵抗。
高尿酸血癥患者常出現炎癥因子異常,并伴隨出現胰島素抵抗,目前尚未能完全確認二者之間是否存在必然聯系。本研究進一步深入探究發現,血清hs-CRP、IL-18水平與HOMA-IR指數存在正相關關系(P<0.05)。可能與高尿酸血癥導致慢性炎癥因素有關,而慢性炎癥可能為胰島素抵抗始發關鍵。高尿酸血癥、代謝紊亂、內皮功能紊亂、高游離脂肪酸等均可誘導細胞產生炎癥反應,機體發生炎癥反應時,炎性細胞因子由脂肪細胞中釋放,可引發代償性高胰島素血癥。IL-18為繼白介素-6(IL-6)、腫瘤細胞因子-α(TNF-α)之后發現的又一炎癥細胞因子,在炎癥級聯反應中占中心地位,在同胰島素抵抗相關的多種疾病中,如糖尿病、肥胖等均見血清IL-18水平異常升高[11]。故hs-CRP、IL-18可能通過炎癥機制促進胰島素抵抗發生、發展。胰島素抵抗可致使機體糖酵解過程中的中間產物向5-磷酸核苷轉移,增加肝臟脂肪合成,引起嘌呤代謝紊亂,致使血尿酸生成增多。而外周血中尿酸水平升高,可激活血管內皮細胞及白細胞的黏附及刺激作用,致使血管內皮結構及功能紊亂,進一步造成炎癥因子(如hs-CRP、IL-18)生成增加,加重胰島素抵抗,形成惡性循環。有學者表示,對于此類型患者給予抗炎治療,有助于緩解其臨床癥狀[12]。由本研究結果可知,高尿酸血癥患者治療后血清hs-CRP、IL-18水平低于治療前(P<0.05)。別嘌醇片為黃嘌呤氧化酶抑制劑,具有改善炎癥因子、血尿酸水平作用,可降低高尿酸血癥患者炎癥因子水平,根本上控制疾病發生、發展,促進患者恢復。
綜上所述,高尿酸血癥患者血清hs-CRP、IL-18水平呈異常高表達狀態,血清hs-CRP、IL-18水平與HOMA-IR指數存在明顯正相關關系,動態監測血清hs-CRP、IL-18水平,有助于臨床判斷疾病進展及治療效果,為臨床診治提供指導依據。

