miR-213靶向SRC抑制胃癌細胞的增殖和遷徙
侯花屏,劉新奇,石菲
1.榆林市第一醫院普外科,陜西 榆林 719000;2.空軍軍醫大學航空航天醫學院,陜西 西安 710032
胃癌又稱胃腺癌,是世界上第四大癌癥類型,也是癌癥相關死亡的第二大原因[1]。研究表明,胃癌發生與性別和年齡有關,男性發病率高于女性。50 歲以上人群中胃癌的發病率明顯升高[2-3]。胃癌在亞洲、拉丁美洲、中歐和東歐的發病率較高[1]。由于在早期階段,胃癌沒有臨床表現,許多患者在疾病的晚期才被診斷,因此胃癌的治療效果欠佳[2]。雖然病理診斷和手術治療是提高胃癌患者生存率的有效手段,但由于胃癌的復發和轉移,胃癌患者的5 年生存率仍然很低[3]。越來越多的證據表明,miRNA 對胃癌發生發展有著重要調節作用,miRNA 代謝的紊亂可能是胃癌的潛在發病機制[4-6]。有研究表明,miR-213在乳腺癌、頭頸部鱗狀細胞癌和舌細胞癌中發揮重要的調控作用[7-10],而miR-213對胃癌的調控作用尚不明確。本研究擬探究miR-213 對胃癌細胞增殖和轉移的作用及機制。
1 材料與方法
1.1 材料和儀器 澳洲胎牛血清(美國Gibco 公司,貨號:10100147)、低糖的DMEM 細胞培養基(美國Gibco 公司,貨號:31330095)、Ⅰ型膠原(美國Gibco公司,貨號:A1048301);Lipofectamine 2000(美國Invitrogen 公 司,貨 號:11668030);miRNA 核 苷 酸 序 列(miR-213 序列)(生工生物公司);RNA 的抽提試劑盒(日本TaKaRa 公司,貨號:639505)、反轉錄試劑盒(日本TaKaRa 公司,貨號:639549)、擴增試劑盒(日本Ta-KaRa 公司,貨號:639503);q-PCR 引物由生工生物公司合成;CCK-8細胞增殖檢測試劑盒(碧云天公司,貨號:b4758);抗Ki67 抗體(美國Abcam 公司,貨號:ab32147)、抗E-cadherin 抗體(美國Abcam 公司,貨號:ab128873)、抗N-cadherin 抗體(美國Abcam 公司,貨號:ab135745)和抗GAPDH 抗體(美國Abcam 公司,貨號:ab78453);DNA 內切酶及連接酶(北京百奧萊博科技有限公司,貨號:BTN130639 和BTN130653)。實時熒光定量PCR儀(美國Applied Biosystems公司,型號:ABI7500fast);酶標儀(上海沛歐分析儀器有限公司,型號:SPS5845);顯微鏡(日本Olympus 公司,型 號:cx21fs1);電泳儀及發光儀(中國天能公司,型號:天能EPS600)。
1.2 方法
1.2.1 標本收集 選取2018年1月至2020年1月期間在榆林市第一醫院行胃腺癌切除術的患者30例,收集患者胃癌組織及癌旁組織。標本收集均經過患者知情同意并簽署知情同意書后進行。納入標準:首次行手術切除的胃癌患者,術后經病理診斷為胃腺癌者;年齡為45~75歲男性。排除標準:不同意參加本次試驗者;存在心、肝及腎臟等重要臟器功能障礙者;不能夠配合者;長期服用藥物者;近5 年間罹患高血壓、糖尿病、冠心病及其他惡性腫瘤者;有過胃腸道手術病史者。
1.2.2 細胞培養及轉染 人正常胃黏膜上皮細胞GES-1 和胃癌細胞系MNK-45、MGC803、SCG-7901、AGS 購買自蘇州思瑞坦細胞庫。根據轉染寡核苷酸序列不同分為轉染miR-213 陰性對照序列(5'-CAG GGC UAU GGC UAU GGC UAU GC-3')的對照組和轉染miR-213 模擬序列(5'-AGC AGC CUU GUA CAG GGC UAU GA-3')的模擬物組[11]。轉染時將普通培養基去除,換為低血清的、不含抗生素的培養基繼續培養6 h;在此期間,將Lipofectamine 2000 和由公司合成的miRNA 相關核苷酸序列混合均勻,室溫放置30 min,待脂質體將核苷酸序列充分包裹;在培養6 h后將適量上述脂質體混合液加入到上述低血清培養基中(miRNA 相關核苷酸序列濃度為80 nmol/L)繼續常規培養6 h,隨后更換上述培養基為常規培養基,繼續培養細胞。
1.2.3 q-PCR 檢測miRNA 表達量 按照說明書利用RNAiso進行細胞裂解,室溫裂解2 min 后加入適量的三氯甲烷震蕩,待溶液完全乳化,室溫放置10 min后見萃取分層,高速離心后取無色上清加入等體積的異丙醇,充分混合后冰凍過夜。離心后棄去上清,加入無水乙醇充分洗滌沉淀,棄去上清,加入DEPC水溶解RNA。根據說明書配制反應液并設置參數,反轉錄條件:37℃預熱15 min,42℃加熱15 min,85℃加熱5 s,反應結束后得到的cDNA用于后續實驗。根據擴增試劑盒說明書配制反應液,經過預變性和擴增反應等步驟完成擴增步驟,利用相對定量法進行數據分析,擴增條件:95℃預變性30 s,95℃維持5 s,60℃維持34 s,進行40個循環[11]。
1.2.4 細胞增殖能力檢測 根據CCK-8 試劑盒說明書配制反應液,將上述反應液按照一定濃度加入到MNK-45 細胞中,隨后再將細胞放入常規孵箱培養,利用酶標儀檢測各組細胞的吸光度[11]。
1.2.5 transwell實驗檢測細胞遷徙 利用常規方法在transwell 的上、下培養室中加入基質凝膠和相應培養基。將MNK-45 細胞接種到上部培養室,48 h 后利用固定液固定MNK-45細胞,染色后利用顯微鏡對細胞進行觀察,記錄發生遷徙的細胞數目[12]。
1.2.6 劃痕實驗檢測細胞遷徙 使用移液器的細槍頭在培養有融合度達到80%左右MNK-45 細胞的培養板上進行劃線,隨后將劃線后的培養板繼續放入孵箱中常規培養,分別記錄各時間點不同組別細胞劃痕的愈合情況[12]。
1.2.7 Western blot 技術檢測蛋白表達量 利用蛋白酶裂解液裂解細胞,在上述液體中加入緩沖液,利用煮沸方法制備上樣蛋白樣品。電泳參數:95 V進行30 min 完成濃縮膠的電泳,隨后調整為120 V 電泳90 min 完成分離膠的電泳;轉膜參數:250 mA 恒流轉膜2 h。按照Ki67 (1∶3 000 稀釋)、E-cadherin(1∶5 000 稀釋)、N-cadherin(1∶3 000稀釋)和GAPDH(1∶10 000稀釋)抗體說明書配制抗體,室溫孵育4 h,取出條帶后沖洗干凈,配制帶有辣根過氧化物酶的二抗孵育液,隨后室溫孵育1 h,進行發光[11]。
1.2.8 熒光素酶報告基因系統的構建和檢測 通過靶基因預測軟件發現潛在靶基因肉瘤基因(sarcoma gene,SRC)的結合序列,并對其人工合成,即可得到非編碼(untraslated regions,UTR)序列,對上述序列進行突變即可得到突變(mutation,MUT)序列。利用DNA內切酶及連接酶將合成的上述基因插入到質粒中,將上述質粒進行擴增并抽提。隨后利用制備得到的質粒和UTR 或者MUT 序列共轉染入MNK-45 細胞(細胞轉染方法同前)。隨后利用酶標儀檢測細胞內熒光素酶活性[11-12]。
1.3 統計學方法 利用SPSS19.0 統計軟件進行相關數據分析。計量數據以均數±標準差(±s)表示;當進行兩樣本間比較時采用獨立t 檢驗,當進行不同時間點多次測量的樣本分析時采用重復測量方差分析;組間比較采用Bonferroni post hoc檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 miR-213 在胃腺癌組織和胃癌細胞系中低表達 與癌旁組織比較,胃癌組織中miR-213低表達,差異有統計學意義(P<0.05),見圖1A。與正常胃黏膜上皮細胞GES-1 比較,胃癌細胞系MNK-45、MGC803、SCG-7901 和AGS 中miR-213 低表達,差異均有統計學意義(P<0.05),見圖1B。

圖1 q-PCR檢測臨床胃癌樣本及細胞系內miR-213的含量
2.2 轉染miR-213 模擬序列能夠上調細胞內miR-213 的水平 與對照組比較,模擬物組細胞內miR-213含量增加,差異有統計學意義(P<0.05),見圖2。

圖2 q-PCR檢測胃癌細胞系MNK-45內miR-213的含量
2.3 轉染miR-213 模擬序列抑制胃癌細胞系MNK-45 的增殖 與對照組比較,模擬物組細胞增殖能力降低,差異有統計學意義(P<0.05),見圖3。
2.4 transwell 驗證轉染miR-213 模擬序列抑制胃癌細胞的遷徙 與對照組比較,模擬物組細胞遷徙能力下降,差異有統計學意義(P<0.05),見圖4。
2.5 劃痕實驗驗證轉染miR-213 模擬序列抑制胃癌細胞的遷徙 與對照組比較,模擬物組細胞遷徙能力下降,差異有統計學意義(P<0.05),見圖5。

圖3 CCK-8法檢測MNK-45細胞的增殖能力
2.6 miR-213模擬序列調控相關蛋白表達 與對照組比較,模擬物組細胞Ki67 和N-cadherin 表達下降,但E-cadherin 表達增加,差異有統計學意義(P<0.05),見圖6。
2.7 SRC 是miR-213 的靶基因 為進一步研究miR-21 的抑癌機制,利用Targetscan 和MiRanda 等靶基因預測軟件預測了miR-213 的潛在靶基因,發現SRC 基因的3’UTR 上存在miR-213 的潛 在結合位點。繼而,利用熒光素酶報告基因技術發現,與對照組比較,模擬物組質粒的熒光素酶活性降低,差異有統計學意義(P<0.05),見圖7。

圖4 transwell檢測MNK-45細胞的遷徙能力

圖5 劃痕實驗檢測MNK-45細胞的遷徙能力
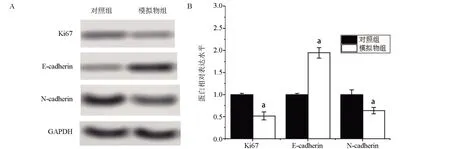
圖6 Western Blot檢測MNK-45細胞中Ki67、E-cadherin和N-cadherin蛋白的表達

圖7 熒光素酶報告基因結果驗證
3 討論
胃癌是世界范圍內最常見的胃腸道疾病之一,是導致癌癥相關死亡的第二大原因。由于胃癌在早期沒有明顯臨床表現,大多數患者在后期才被發現,往往錯過治愈機會[1-3]。故深入研究胃癌發病機制及尋求治療新靶點成為近年來的研究熱點。而miRNA研究較為深入,已有多種miRNA藥物已經進入臨床試驗[13]。
在文獻回顧中發現,miR-213在乳腺癌、頭頸部鱗狀細胞癌和舌細胞癌中發揮重要的調控作用[7-10]。為探究miR-213 在胃腺癌中的作用,課題組首先在患者知情同意下,按照嚴格的納入標準和排除標準收集胃腺癌樣本30 例。與癌旁組織比較,胃腺癌組織中miR-213低表達;與正常胃黏膜細胞比較,多種胃癌細胞系中miR-213 低表達。上述結果表明,miR-213 可能在胃癌中發揮抑癌作用。隨后課題組證明,上調miR-213 抑制胃癌細胞系的增殖和遷徙,這與之前學者研究報道一致[9-10]。GREITHER 等[9]發現,miR-213在頭頸部鱗狀細胞癌中低表達,上調miR-213 能夠抑制鱗狀細胞癌的增殖和遷徙。WONG 等[10]證實,miR-213能夠抑制舌細胞癌的增殖和侵襲作用。但也有學者報道,miR-213在乳腺癌中高表達,其能夠促進乳腺癌的增殖和侵襲[7-8]。miR-213在調控腫瘤細胞增殖方面的差異可能是由于腫瘤細胞來源不同,這同時也說明了miR-213在細胞增殖調控中的復雜性。
Ki67 是臨床和基礎研究中較為常見的細胞增殖標志物,其含量越高,增殖能力越強[14]。N-cadherin 和E-cadherin兩種蛋白在上皮間充質轉化這一腫瘤轉移的始動環節中發揮關鍵調控作用。N-cadherin作為常用間葉細胞標志物,而E-cadherin 作為常見的上皮細胞標志物,廣泛用于臨床診斷。細胞從上皮細胞向間葉細胞表型的轉變的一個標志是:E-cadherin 的表達下降以及N-cadherin 的表達升高,此時腫瘤細胞的轉移能力增強[15-16]。在本實驗中,課題組發現miR-213能夠下調Ki67 和N-cadherin 的表達,而上調E-cadherin的表達,這從另一方面證實了miR-213能夠抑制胃癌細胞的增殖和遷徙。
目前研究表明,在人類的多種腫瘤中SRC 基因被過度激活,進而促進腫瘤的生長及侵襲[17]。已有研究證實,抑制SRC 基因的活化可以發揮有效的抑癌作用[18-19]。為了探究miR-213抑制胃癌細胞增殖和遷徙的機制,首先利用生物信息學分析技術預測了miR-213 可能的靶基因,發現miR-213 與SRC 基因有著較高的匹配度。隨后課題組通過熒光素酶報告基因技術證明了miR-213 直接靶向作用于癌基因SRC,這可能是miR-213 發揮抑癌作用的重要方式。后續研究將進一步在體驗證miR-213的抑癌作用。
綜上所述,胃癌組織及胃癌細胞系內低表達miR-213,miR-213 可靶向SRC 抑制胃癌細胞的增殖和遷徙。

