金銀花對銅綠假單胞菌生物膜及QS系統作用研究進展①
(1.桂林醫學院,廣西 桂林 541199;2.湖南中醫藥大學臨床醫學院,湖南 長沙 410007)
銅綠假單胞菌(P.aeruginosa,PA)是一種常見的機會致病菌,是引起免疫力低下患者細菌感染的常見病原體,由于抗菌藥物的臨床廣泛使用,耐藥株不斷增加,導致PA感染易反復發作,且難以控制。PA具有較強的生物膜形成能力,可引起急慢性感染。有研究表明,至少65%的慢性PA感染與生物膜形成有關,而生物膜的形成受群體感應(quorum sensing,QS)系統的調控。QS 系統是一種密度依賴性的基因表達調控系統,當其感知到病原菌生長密度達到閾值水平,通過信號分子與靶受體的結合而啟動QS系統。PA感染是一個慢性、復雜化的過程,與其慢性感染密切相關的是PA可以分泌綠膿素、彈性蛋白酶、鼠李糖脂等多種毒力因子。這些毒力因子的分泌是由群體感應系統參與調控的[1-2]。
近年來,細菌耐藥成為臨床棘手的難題,而中藥作為細菌耐藥的新型抑制劑受到廣泛關注。中藥安全性高,又具有與抗生素不同的抗菌機制,有不易產生耐藥性等優點。金銀花,為忍冬屬植物,其干燥花蕾或帶初開的花,具有清熱解毒、抑菌消炎等功效,廣泛用于醫藥及日用品中。目前,已有多種金銀花和(或)山銀花制劑用于治療PA感染所致的呼吸系統疾病。而“中藥抗生素”分子水平的基礎研究很少,作用的靶點模糊,對抗細菌耐藥性的機制闡述仍不清晰,不能深入揭示中藥抗細菌耐藥性的機理和作用,嚴重制約了“中藥抗生素”的突破和發展。本文從金銀花對PA的群體感應系統作用機制進行綜述。
1 PA生物膜與耐藥
“生物膜(biofilm,BF)”也稱為微生物群落,是指細菌附著于黏膜或生物醫學材料表面,通過分泌ECMs(細胞外基質)如:胞外多糖(EPS)、胞外DNA(eDNA)、RNA、蛋白質和脂類等將其自身包繞其中而形成高度致密的膜樣聚合物[3]。生物膜相當于細菌的“保護膜”,所以生物膜菌對各種消毒劑和抗生素的抵抗力通常比浮游菌更強[4]。生物膜的形成,提高了細菌對抗生素和宿主免疫反應的抗性,故生物膜已成為醫學領域的一個研究熱點。
PA的耐藥機制十分復雜,幾乎具有細菌所有的耐藥機制,形成生物膜是PA耐藥的重要原因之一[5]。PA生物膜的形成主要包括以下幾個階段。①附著:PA的初始附著由黏附素、IV型菌毛和脂多糖介導,并受c-di-GMP(環二鳥苷酸)和sRNA(小分子核糖核酸)調控。②成熟:生物膜的成熟主要表現為生物膜結構的形成和ECM的產生。③剝離:包括剝落、侵蝕和播撒3個階段,剝落和侵蝕為被動剝離,播撒擴散為主動剝離[6]。
2 PA 的群體感應系統
PA生物膜的發育受多種因素的影響,QS系統是調控PA生物膜形成的主要機制之一。1998年戴維斯和他的同事首次報告了QS系統在生物膜形成中的作用[7]。在PA中至少存在4種QS系統,即las系統、rhl系統、喹諾酮信號系統以及近期發現的IQS系統[8]。其中前兩種是由酰基高絲氨酸內酯(acyl-homoserine lactones,AHLs)信號分子介導,占主導地位,控制毒力因子的產生和生物膜的成熟。喹諾酮系統是由喹諾酮類信號分子介導的,受las系統調控卻又能調控rhl系統,是前兩個系統之間的橋梁。IQS系統是近年新發現的QS系統子系統,可以參與rhl系統及喹諾酮系統信號分子的合成[1]。
las系統主要由lasI和lasR兩個編碼基因介導,其中lasI合成酶合成AHLs的同系物3-氧十二烷酰高絲氨酸內酯(3-oxo-C12-homoserine lactone,3-oxo-C12-HSL);lasR編碼生成轉錄因子LasR。當3-oxo-C12-HSL分子在細胞環境中達到假定的閾值時,其作為誘導PA群體感應的重要分子,通過與LasR的相互作用產生多聚體,從而啟動las系統。該系統參與調節急性感染的多種毒力因子的表達,包括外毒素A、LasA、LasB彈性蛋白酶和蛋白水解酶等。rhl是PA的第2個系統。與las系統一樣,rhl系統同樣是由rhlR和rhlI兩個基因調節,其中rhlR編碼生成RhlR;rhlI編碼生成丁基高絲氨酸內酯(N-butyryl-homoserine lactone,C4-HSL),RhlR和C4-HSL結合后主要負責調控鼠李糖脂的表達,以及參與PA毒力因子釋放到宿主細胞胞質中的調控;并且rhl系統在轉錄和轉錄后的水平上也受到las系統的分級調節。喹諾酮系統是PA的另一個QS系統[9],其中pqsABCDE編碼生成PqsE和 2-庚基-4-喹諾酮(2-heptyl-4-quinoline,HHQ)。PqsH是一種由las系統調控的基因,在轉換HHQ到喹諾酮系統信號分子2-庚基-3-羥基-4-喹諾酮(2-heptyl-3-hydroxy-4-quinoline,PQS)的過程中承擔重要角色。喹諾酮系統主要負責誘導鼠李糖脂和其他參與PA生物膜形成的分子產生。后來發現的一個QS系統是IQS,IQS系統的信號分子為2-(2-羥基苯基)-噻唑-4-碳醛(IQS),IQS由非核糖體肽合成酶基因簇ambBCDE編碼產生[1];它可以將環境壓力因素整合到QS中。IQS系統既參與調控PQS,又可以調節C4-HSL以及相關毒力因子的產生,如彈性蛋白酶、鼠李糖脂等。
實踐證明,這4套QS系統是分層次調節的,如圖1。研究證實[10], las系統在QS系統中具有最高的地位,可以對rhl、PQS和IQS系統進行分級調控。另外,las 系統信號分子3-oxo-C12-HSL 可功能性地結合于RhlR蛋白調節器,促進其裂解及失活;rhl系統還可以調控綠膿菌素的產生,導致真核宿主細胞發生氧化性損傷,破壞宿主抗氧化防御系統;rhl系統處于最低水平,受其他所有QS系統的調控,并能激活許多與QS相關的毒力因子;且RhlR對PQS有負調節作用。相關研究表明在細菌生長穩定期,RhlR 可替代缺失的 LasR,促進蛋白酶、綠膿菌素、PQS及3-oxo-C12-HSL的產生。PQS由las和IQS激活,并激活rhl系統。IQS由las激活,并參與調控PQS和rhl系統,可正調控PQS和C4-HSL產生[11];當然,每個QS系統也可以被環境因素以及一些宿主源性因素激活。
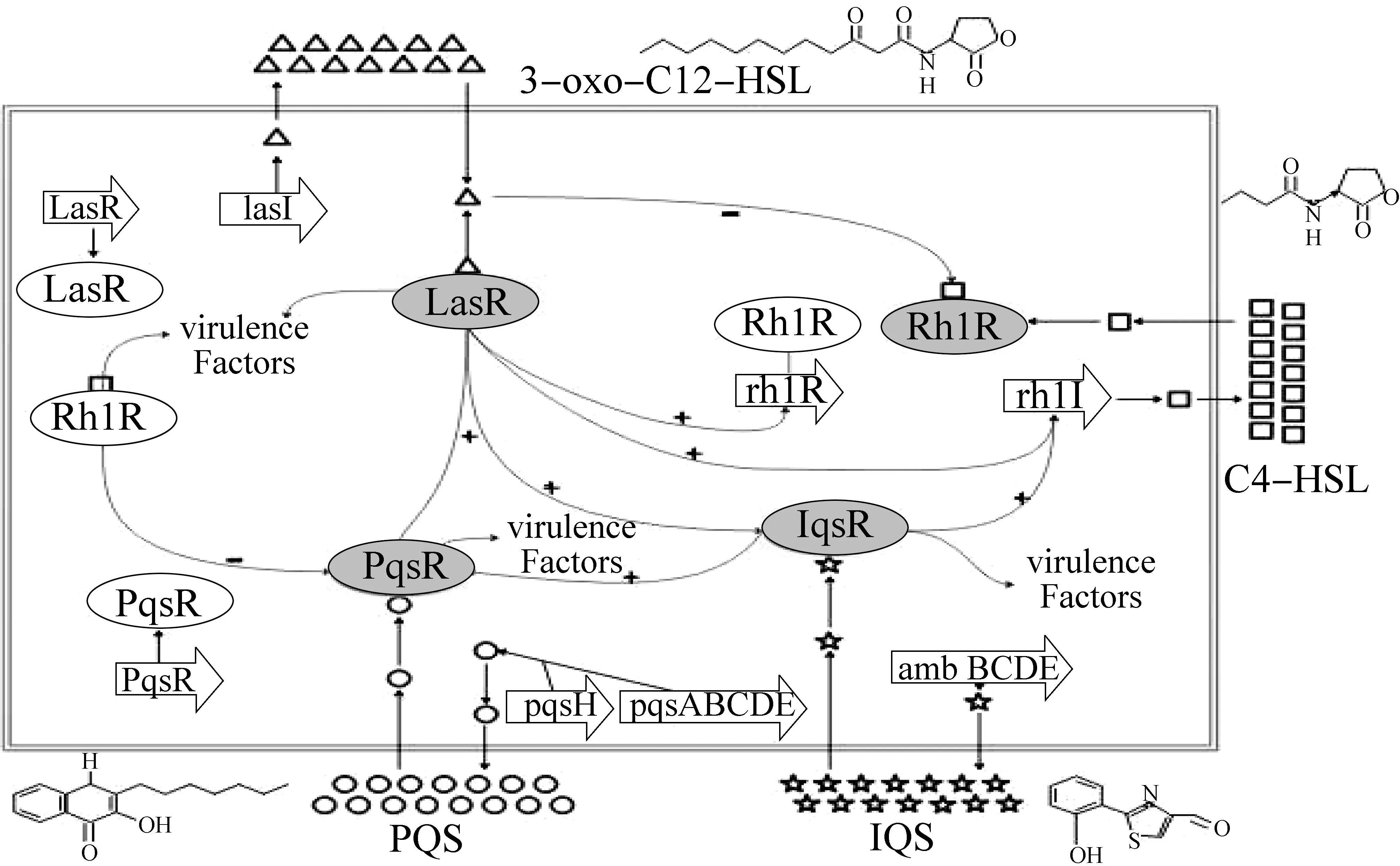
圖1 銅綠假單胞菌的QS系統
3 金銀花與PA的生物膜和QS系統
3.1 金銀花的抑菌作用
臨床上抗菌藥物廣泛應用及不合理使用導致細菌耐藥性逐漸增加,中草藥抗菌作用的研究成為熱點。金銀花是常用的中藥品種,《藥典》分列收載金銀花與山銀花,山銀花和金銀花藥性相同,組分相似,主要為綠原酸及黃酮類等。金銀花具有廣譜抑菌作用,且耐藥性發生率低等特點,系列研究證明金銀花及組份對PA及其耐藥菌均有抑制作用[12-14]。
3.2 金銀花與PA的生物膜
細菌生物膜是指細菌黏附于接觸表面,被自身分泌的胞外聚合物包裹形成的細菌聚集的膜狀結構。生物膜多細胞結構的形成是一個動態過程, 包括細菌起始附、生物膜發展和成熟等階段。金銀花可通過抑制細胞生物膜形成過程中發揮其抑菌作用,形成生物膜是PA耐藥的重要原因之一。
陳一強等[15]通過體外復制PA的生物膜模型發現金銀花組PA在固體表面的黏附數明顯少于空白對照組,62.5 mg/ml的金銀花可以抑制和破壞早期及成熟生物膜,證實金銀花水煎液在體外能抑制PA對固體表面的粘附能力及生物膜形成能力,并能破壞PA已形成的生物膜,增強CAZ(頭孢他啶)對生物膜內PA的清除作用。溫紅俠等[16]研究金銀花主要成分綠原酸的抑菌作用機制,通過構建體外PAO1生物模型,并測定MIC值,電鏡觀察載體表面生物膜形態,空白對照組見大量分布均勻的微菌落和游離細菌,而建模3 d、7 d綠原酸組分別偶見聚集菌落、僅見稀少的薄層生物膜,表明綠原酸可以抑制PA的生物膜形成, 并對早期和成熟生物膜具有破壞作用, 對于生物膜內PA與CAZ有協同殺菌作用, 并且強于紅霉素組。袁秀麗等[17]通過試管稀釋法測定金銀花水煎液和慶大霉素對PA的MIC(最小抑菌濃度),用MTT法建立體外PA生物膜并檢定金銀花水煎液和慶大霉素不同MIC濃度的抗PA生物膜作用,得出金銀花水煎液在體外能抑制PA對固體表面的黏附能力及生物膜形成能力,并能破壞PA已形成的生物膜,增強慶大霉素對生物膜內PA的清除作用。王琳等[18]證明金銀花提取物對PA生物膜有清除作用,而且對于生物膜的初始黏附作用效果更強。該研究采用激光共聚焦顯微鏡觀察在金銀花提取物作用下的PA 的生物膜的整體發展和結構變化,發現金銀花提取物主要通過抑制生物膜立體結構形成而實現對生物膜的清除作用。
3.3 金銀花與PA的QS系統
金銀花及其組分綠原酸等均被證實對PA的QS系統相關毒力因子,如彈性蛋白酶、綠膿素的表達及QS基因有抑制作用。陳一強等[15]證實了金銀花組分綠原酸具有抑制PA毒力因子及QS系統信號分子的作用,這可能與其抑制了QS系統的相關基因表達有關;該研究還通過動物實驗進一步證實了綠原酸在體內對PA的抑制作用。李鏞等[19]研究發現,泛耐藥 PA 群體行為與 QS 基因相關,且彈性蛋白酶和LasI,LasR表達過高,提示 QS 基因在 PA 耐藥機制中起重要作用。Wang等[20]也證實綠原酸在轉錄水平對QS系統進行調節,下調PA的QS相關基因lasI,lasR,rhlI,rhlR,pqsA和pqsR的表達,從而細菌生物膜形成受阻,成群運動減弱和毒力因子表達下降。Annapoorani等[21]采用Glide version 5.5篩選1 920種天然化合物和PA的LasR和RhlR受體蛋白進行對接、QSI評價。綠原酸在總蛋白水解試驗、LasB彈性蛋白酶試驗、溶血素測定試驗對PA01, AS1 and AS2 菌株均表現出不同的抑制效果,蛋白酶顯示出活性下降,即這五種QSI化合物可能抑制蛋白酶的產生,并且這五種化合物并未與蛋白酶進行結合或者降解酶活性,說明是通過化合物本身的QSI潛力起作用。在PA01、AS1和AS2生長中,被測QSI化合物作用組和對照組的細胞生長密度無變化,也證明了這些化合物的抑制作用不是由于抗菌活性,而可能是通過QSI活性。本課題組前期研究發現亞抑菌濃度(4 mg/ml)的山銀花粗提物對綠膿素及彈性蛋白酶的表達有顯著的抑制作用,山銀花粗提物在MIC時對鼠李糖脂有極顯著抑制作用;實時熒光定量PCR檢測結果顯示山銀花粗提物在亞抑菌濃度(4 mg/ml)時,rhlI和lasI基因的表達量顯著低于空白對照組;在MIC時對rhlR基因的表達有顯著的抑制作用。
綜上所述,形成生物被膜是PA耐藥的重要原因之一,而QS系統是調控PA生物膜形成的主要機制之一。金銀花能抑制PA的QS相關毒力因子及基因的表達,破壞其生物膜的形成,達到一定抑菌的效果。我國中草藥文化歷史悠久,中草藥抑菌作用研究成為國內研究熱點,金銀花在治療感染性疾病方面具有多成分、多作用、多途徑、多環節的特點,抑菌機制值得深入研究。

