基于網絡藥理學和分子對接探討枸杞子治療阿爾茨海默病的作用機制
吉潔 梅俊 信琪琪 叢偉紅 張穎 徐鳳芹
摘要 目的:基于網絡藥理學方法及分子對接研究枸杞子治療阿爾茨海默病(AD)的作用機制。方法:采用網絡藥理學方法,通過檢索中藥系統藥理學數據庫與分析平臺(TCMSP),GeneCards、NCBI基因數據庫及OMIM數據庫,篩選枸杞子治療AD的相關靶點,通過構建韋恩圖,得到枸杞子-AD共同靶點,運用STRING數據庫構建二者靶點蛋白質-蛋白質相互作用(PPI)網絡圖,并且運用Cytoscape 3.8.0軟件進行可視化處理,篩選關鍵基因,同時對藥物-疾病共有靶點進行基因本體(GO)富集分析和京都基因和基因組百科全書(KEGG),并使用AutodockTools1.5.6進行分子對接,驗證靶點與小分子的結合度。結果:通過篩選,共得到121個枸杞子-AD共有靶點,41個關鍵靶點,包括JUN、AKT1、MAPK1、RELA、IL-6等,GO分析發現,生物學過程主要與氧化應激、衰老等相關,KEGG通路分析富集在AGE-RAGE、HIF-1等信號通路。將靶點MAPK1與β-谷甾醇進行分子對接發現,結合活性較好。結論:本研究初步探討了枸杞子治療阿爾茨海默病的主要活性成分、相關靶點及其相關通路,發現其多成分、多靶點、多通路的特點,為后續實驗驗證提供了一定的參考和物質基礎。
關鍵詞 枸杞子;網絡藥理學;阿爾茨海默病;靶點;信號通路;作用機制;分子對接;β-谷甾醇
Mechanism of Lycii Fructus in Treatment of Alzheimer′s Disease Based on Network Pharmacology and Molecular Docking
JI Jie1,MEI Jun2,XIN Qiqi2,CONG Weihong2,ZHANG Ying2,XU Fengqin2
(1 School of Graduate,China Academy of Chinese Medical Sciences,Beijing 100029,China; 2 Xiyuan Hospital,China Academy of Chinese Medical Sciences,Beijing 100091,China)
Abstract Objective:To explore the mechanism of Lycii Fructus in the treatment of Alzheimer′s disease (AD) based on network pharmacology and molecular docking.Methods:The targets of Lycii Fructus against AD were screened out from TCMSP,GeneCards,NCBI,and OMIM by network pharmacology.The Venn diagram was plotted to obtain the common targets of Lycii Fructus and AD.The protein-protein interaction (PPI) network was delineated by STRING.Cytoscape 3.8.0 was used for visualization processing,and key genes were screened out.The common targets of Lycii Fructus and AD underwent GO and KEGG pathway enrichment analyses.AutoDock Tools 1.5.6 was used for molecular docking to verify the binding degree between the targets and small molecules.Results:A total of 121 common targets and 41 key targets of Lycii Fructus and AD were obtained,including JUN,AKT1,MAPK1,RELA,and IL-6.As revealed by GO analysis,oxidative stress,aging,and other biological processes were mainly involved.KEGG pathway analysis showed that the pathways were mainly enriched in AGE-RAGE,HIF-1,and other signaling pathways.MAPK1 had good binding activity with β-sitosterol as indicated by molecular docking.Conclusion:The present study investigated the main active components,related targets,and related pathways of Lycii Fructus in the treatment of AD,and unraveled the characteristics of multi-component,multi-target,and multi-pathway,which provided references and material basis for the follow-up experimental verification.
Keywords Lycii Fructus; Network pharmacology; Alzheimer′s disease; Target;Signaling pathway;Mechanism of action;Molecular docking;Beta-sitosterol
中圖分類號:R285文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2022.03.011
阿爾茨海默病(Alzheimer Disease,AD)是以進行性認知功能障礙和行為損害為主要表現的中樞神經系統退行性病變,主要發生在老年及老年前期,隨著阿爾茨海默病的進展,患者甚至可能會出現個性的改變、情緒波動等。隨著人口老齡化的加劇,與年齡相關的癡呆如AD患病率也逐年上升[1]。枸杞的干燥果實即為枸杞子[2]。《本草綱目》中載其具有補肝益腎、益精明目的功效。枸杞子性平,歸肝、腎二經,常用于治療肝腎陰虛、頭暈健忘等臨床癥狀[3]。現代植物化學研究發現,枸杞子中主要包含枸杞子多糖、酚類、槲皮素、胡蘿卜素、煙酸、甜菜堿、豆甾醇等成分[4]。現代藥理學研究顯示,枸杞子具有抗氧化、抗衰老、神經保護、清除自由基、抗炎等作用,目前被廣泛用于養生保健及醫學等領域[5]。藥食同源是枸杞子的優勢,具有很好的開發前景,然而其成分、靶點等作用方式復雜,治療疾病的機制尚不明確。
在系統生物學的理論基礎上,通過構建分析“藥物-靶點-疾病”的網絡,分析其互作關系即為網絡藥理學。網絡藥理學將網絡生物學概念、方法和技術應用到藥物相關的研究上,其在藥物靶點選擇、新的適應證預測、挖掘藥物研發規律等方面都應用頗廣,其強調從網絡層面闡釋中藥治療疾病的機制[6-7]。本研究擬采用網絡藥理學方法及分子對接法,通過對相關數據庫的檢索,分析枸杞子的活性成分,并找到其作用靶標,結合AD疾病數據庫,預測枸杞子治療AD的作用靶點,為從分子水平、基因水平等闡明枸杞子抗AD的作用機制提供一定的參考依據及理論基礎。
1 資料與方法
1.1 獲取枸杞子的潛在靶點
基于中藥系統藥理學數據庫與分析平臺(TCMSP)(https://tcmspw.com/tcmsp.php)檢索枸杞子的化合物成分及潛在靶點[8]。結合藥代動力學吸收、分布、代謝和排泄(Absorption, Distribution, Metabolism and Excretio,ADME),本研究將口服生物利用度(Oral Bioavailability,OB)及藥物類藥性(Drug Likeness,DL)作為篩選依據,在TCMSP中,將篩選條件設定為OB≥30%,DL≥0.18,對枸杞子的成分及其作用靶點進行篩選及構建。
1.2 篩選AD相關靶點
在GeneCards數據庫(https://www.genecards.org/)[9],美國國家生物技術信息中心(NCBI)基因數據庫(https://www.ncbi.nlm.nih.gov/)以及OMIM數據庫(http://ctdbase.org/)中,以“Alzheimer′s disease”為關鍵詞,進行人類基因檢索,獲取AD的疾病靶點。其中,在GeneCards數據庫中,根據Score進行中位值的篩選以獲得更相關的靶點,并且通過UniProt數據庫查詢靶點蛋白的基因名稱。
1.3 疾病-藥物-成分-靶點網絡的構建
將枸杞子潛在靶點與AD的疾病靶點于UniProt數據庫中進行標準化統一命名,導入Excel表,并運用VENNY2.1繪制韋恩圖,運用Cytoscape 3.8.0軟件構建藥物成分-疾病-靶點可視化網絡,并且根據Degree值篩選關鍵藥效成分。
1.4 藥物-靶點相互作用網絡構建
得到枸杞子-AD的共有靶點,將其導入STRING數據庫(https://string-db.org/cgi/input.pl),構建蛋白質-蛋白質相互作用(PPI)網絡,生物種類設定為“Homo Sapiens”,本研究設定置信度閾值>0.9,篩選蛋白質相互作用,得到PPI網絡,并且根據Degree值篩選出關鍵靶點。
1.5 基因本體論(GO)及京都基因和基因組百科全書(KEGG)通路富集分析
運用STRING數據庫,使用R語言3.6.3,應用clusterProfiler、enrichplot、ggplot2數據包,將藥物疾病得到的共有靶點進行GO富集,包括3部分:生物過程(Biological Process,BP)、分子功能(Molecular Function,MF)、細胞組分(Cell Component,CC),并且進行KEGG通路富集。
1.6 分子對接
將枸杞子的核心成分與得到的關鍵靶點進行分子對接,得到對接的親和力,利用TCMSP下載中藥成分格式3D結構,運用AutodockTools1.5.6,打開配體小分子,進行加氫、加電荷、檢測配體的root、并搜尋與定義可旋轉鍵;從RCSB Protein Data Bank(www.rcsb.org)下載得到蛋白質的三維結構,作為對接所用蛋白質,通過添加氫原子、計算Gasteiger電荷、合并非極性氫,將其保存為受體。運用Autodock vina 1.1.2,選取affinity最佳構象作為最終對接構象,進行半柔性對接,并使用Pymol進行可視化作圖。
2 結果
2.1 枸杞子活性成分及靶點預測
在TCMSP數據庫中,結合OB值及DL值,剔除重復化合物并且匯總后,最終得出45個化合物成分,對納入的化合物成分進行靶點預測,通過Uniprot數據庫,進行了確認并且轉換,共得到196個靶點。
2.2 AD靶點網絡構建
以“Alzheimer′s disease”為關鍵詞檢索在GeneCards、NCBI、OMIM數據庫中檢索查詢,結果發現在GeneCards數據庫檢索到1 350個相關靶點,NCBI數據庫獲得1 198個靶點,OMIM數據庫獲得527個靶點。結合UniProt轉換,基因合并并且刪除重復后,得到2 413個AD相關靶點。
2.3 疾病-藥物-成分-靶點網絡的構建
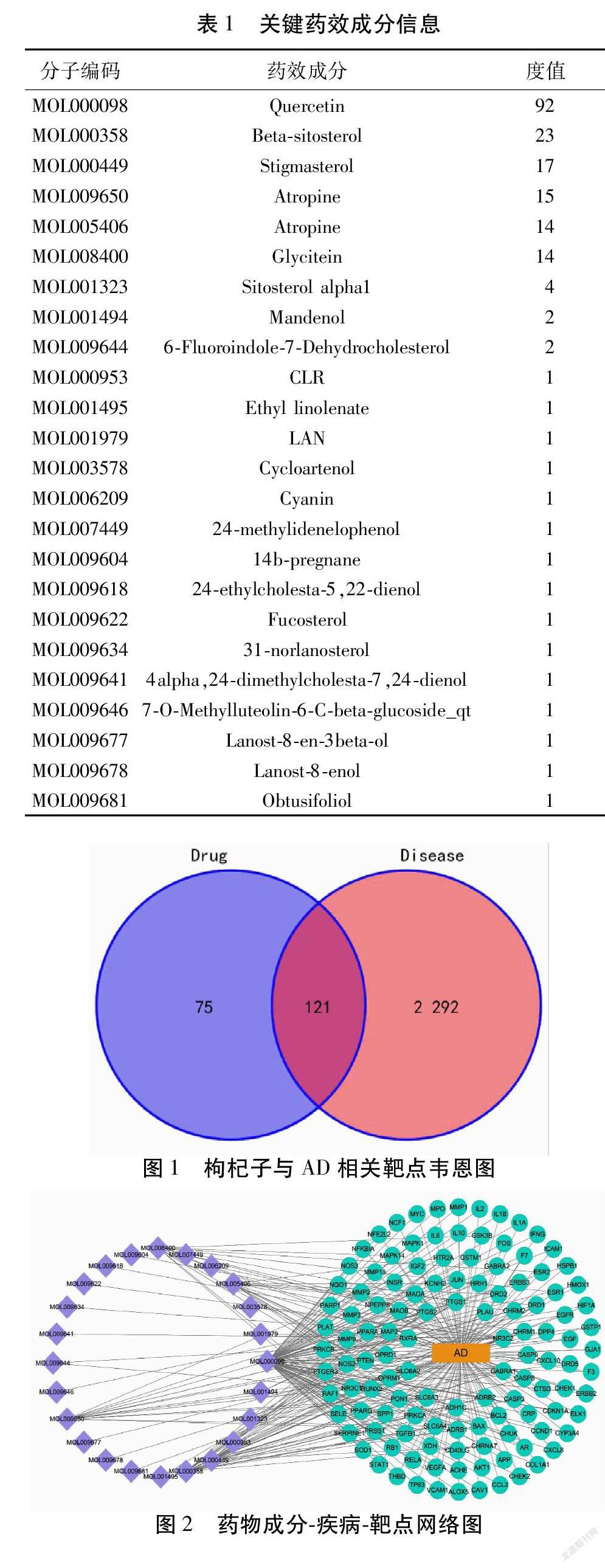
將篩選出來的枸杞子藥物靶點與AD的疾病靶點導入Excel表,并運用VENNY2.1繪制韋恩圖。枸杞子藥物靶點196個與AD疾病靶點2 413個,交集靶點121個。見圖1。將結果導入Cytoscape 3.8.0軟件構建藥物成分-疾病-靶點可視化網絡。見圖2。在網絡圖中,淡紫色為枸杞子的活性成分,綠色為枸杞子作用于AD的靶點,橙色矩形為疾病即AD,連線則代表化合物和靶標之間的作用關系。見圖2。將藥效成分Degree排序,Degree值越高成分越重要,現將其藥效成分列于下表。見表1。
2.4 藥物-靶點PPI網絡構建
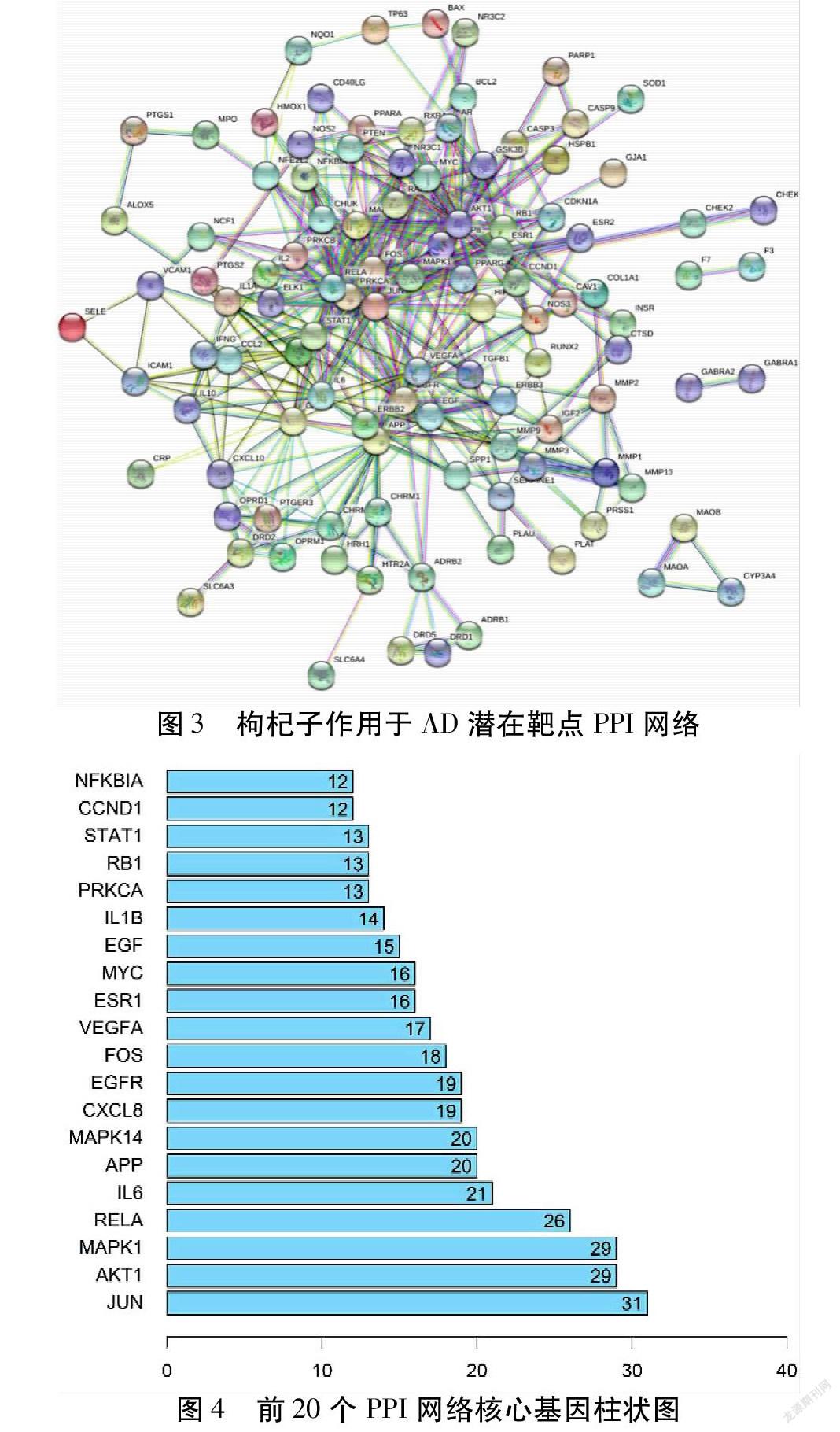
得到枸杞子-AD的共有靶點,將其導入STRING數據庫,根據本研究設定條件得到PPI網絡。該網絡中有121個節點,417條邊,平均度值為6.89,平均局部聚類系數為0.462。見圖3。運用Cystoscape 3.8.0,導入節點信息,利用Network Analyzer工具進行拓撲分析,根據Degree篩選排序,將分值大于平均分的基因作為關鍵靶點,共篩選出41個關鍵靶點,并且將前20個靶點進行可視化展示,圖中橫坐標為每個靶點的度值。見圖4。
2.5 GO及KEGG通路富集分析
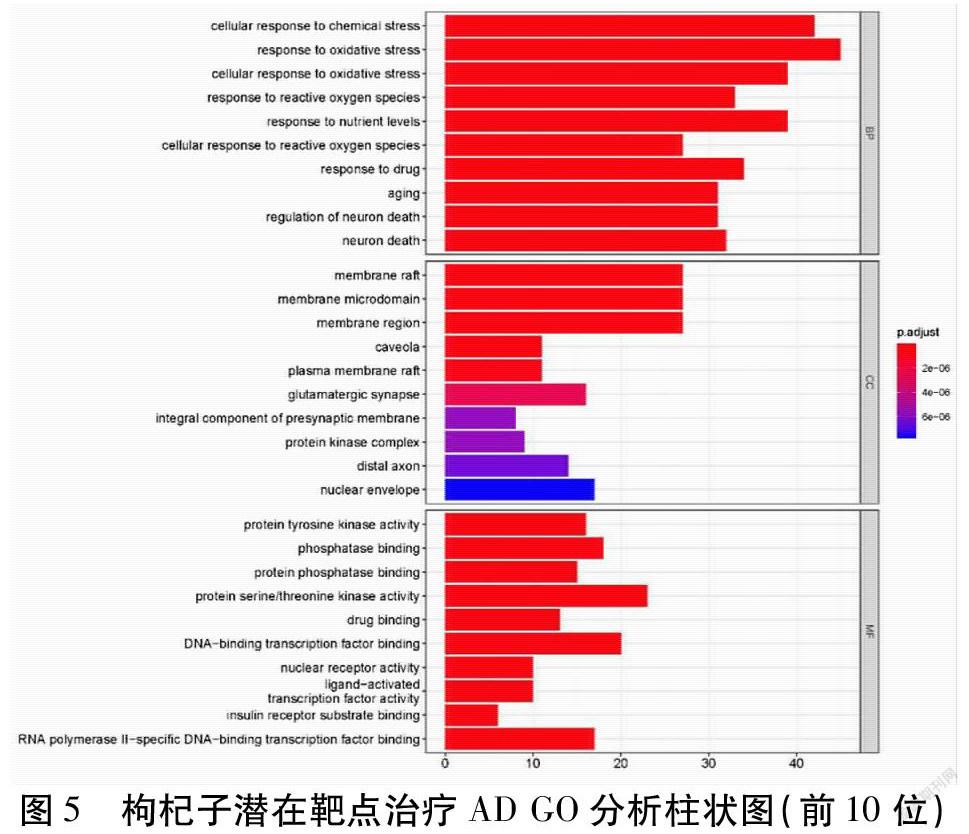
運用STRING數據庫,將枸杞子-AD的共有靶點進行GO富集,將校正條件設定為P值≤0.05進行篩選,共富集到2 405個生物過程,209個分子功能,102個細胞組分。使用R 3.6.3,應用ClusterProfiler、Enrichplot、Ggplot2數據包,發現生物過程包括:細胞對化學應激的反應(Cellular Response to Chemical Stress)、氧化應激反應(Response to Oxidative Stress)、細胞對氧化應激的反應(Cellular Response to Oxidative Stress)、對活性氧的反應(Response to Reactive Oxygen Species)、衰老(Aging)、神經元死亡調節(Regulation of Neuron Death)等。細胞組分包括:膜筏(Membrane Raft)、小凹(Caveola)、質膜筏(Plasma Membrane Raft)、膜區(Membrane Region)、谷氨酸能突觸(Glutamatergic Synapse)、膜微結構域(Membrane Microdomain)、突觸前膜的組分(Integral Component of Presynaptic Membrane)、蛋白激酶復合物(Protein Kinase Complex)、遠端軸突(Distal Axon)、核被膜(Nuclear Envelope)等。分子功能包括:蛋白酪氨酸激酶活性(Protein Tyrosine Kinase Activity)、磷酸酶結合(Phosphatase Binding)、蛋白磷酸酶結合(Protein Phosphatase Binding)、蛋白絲氨酸/蘇氨酸激酶活性(Protein Serine/Threonine Kinase Activity)、藥物結合(Drug Binding)、核受體活性(Nuclear Receptor Activity)、配體激活轉錄因子活性(Ligand-Activated Transcription Factor Activity)、胰島素受體底物結合(Insulin Receptor Substrate Binding)等。排名前10的生物過程、細胞組分、分子功能柱狀圖見圖5。
圖5 枸杞子潛在靶點治療AD GO分析柱狀圖(前10位)
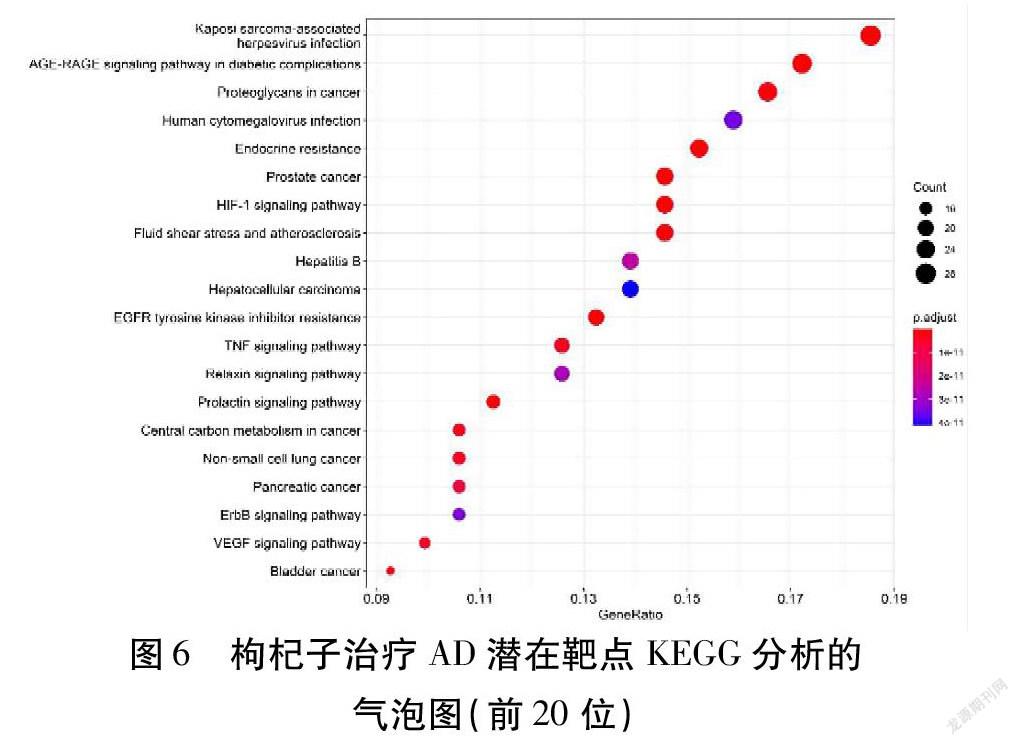
將枸杞子-AD的共有靶點進行KEGG通路富集分析,運用STRING數據庫,設定校正P值≤0.05,進行篩選,總共富集到164條信號通路。使用R3.6.3,安裝并引用clusterProfiler包后,對排名前20個結果可視化處理見圖6。通路主要富集在糖尿病并發癥晚期糖基化終產物(AGE)及其受體(RAGE)信號通路(AGE-RAGE Signaling Pathway in Diabetic Complications)、EGFR酪氨酸激酶抑制劑抵抗(EGFR Tyrosine Kinase Inhibitor Resistance)、VEGF信號通路(VEGF Signaling Pathway)、流體剪切力及動脈粥樣硬化通路(Fluid Shear Stress and Atherosclerosis)、低氧誘導因子-1(HIF-1)信號通路(HIF-1 Signaling Pathway)、人巨細胞病毒感染(Human Cytomegalovirus Infection)等。
圖6 枸杞子治療AD潛在靶點KEGG分析的氣泡圖(前20位)? 注:橫坐標代表目標基因屬于這個分支的基因數量/背景基因集中于這個分支所有基因的數量比值,縱坐標代表通路名稱,氣泡面積大小代表目標基因富集于這個分支的數量,氣泡顏色代表富集顯著性,即P值的大小
2.6 成分-疾病-通路-靶點網絡構建
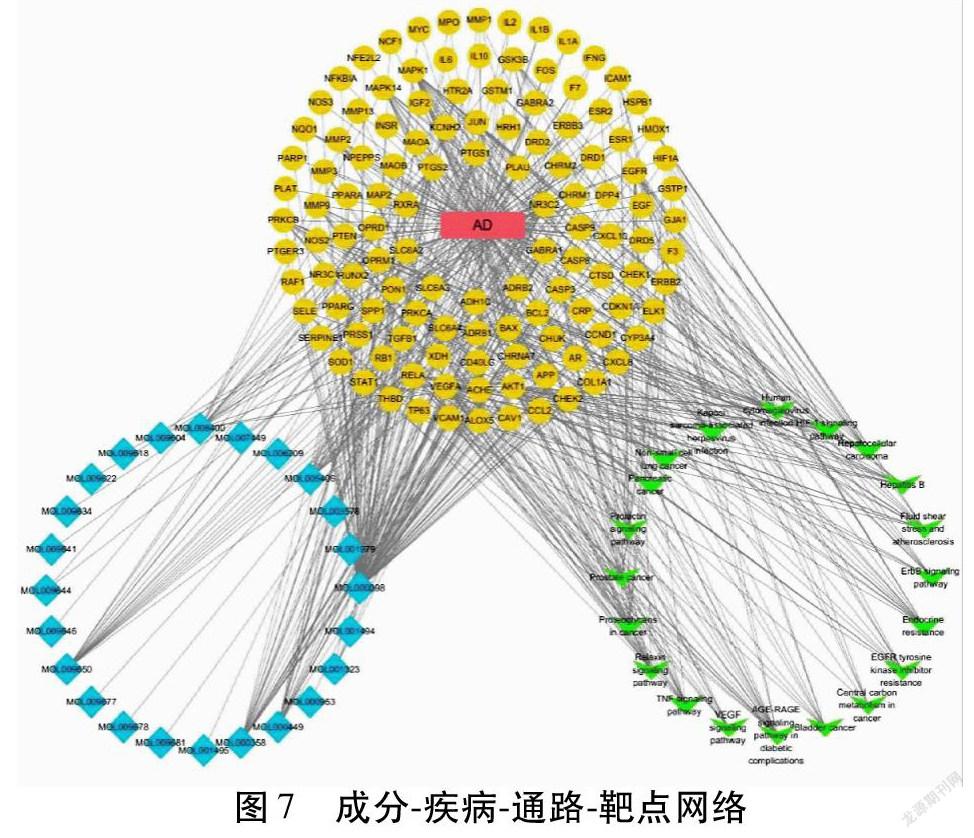
運用Cytoscape 3.8.0,導入成分—疾病—通路—靶點網絡,繪制通路網絡圖,更直觀地展示枸杞子活性成分在治療阿爾茨海默病過程中的多成分-多靶點-多通路的作用特點。見圖7。如圖7所示,藍色為化合物,黃色為枸杞子作用于AD的靶點,紅色為疾病即AD,綠色為最顯著的前20條通路。
2.7 分子對接分析
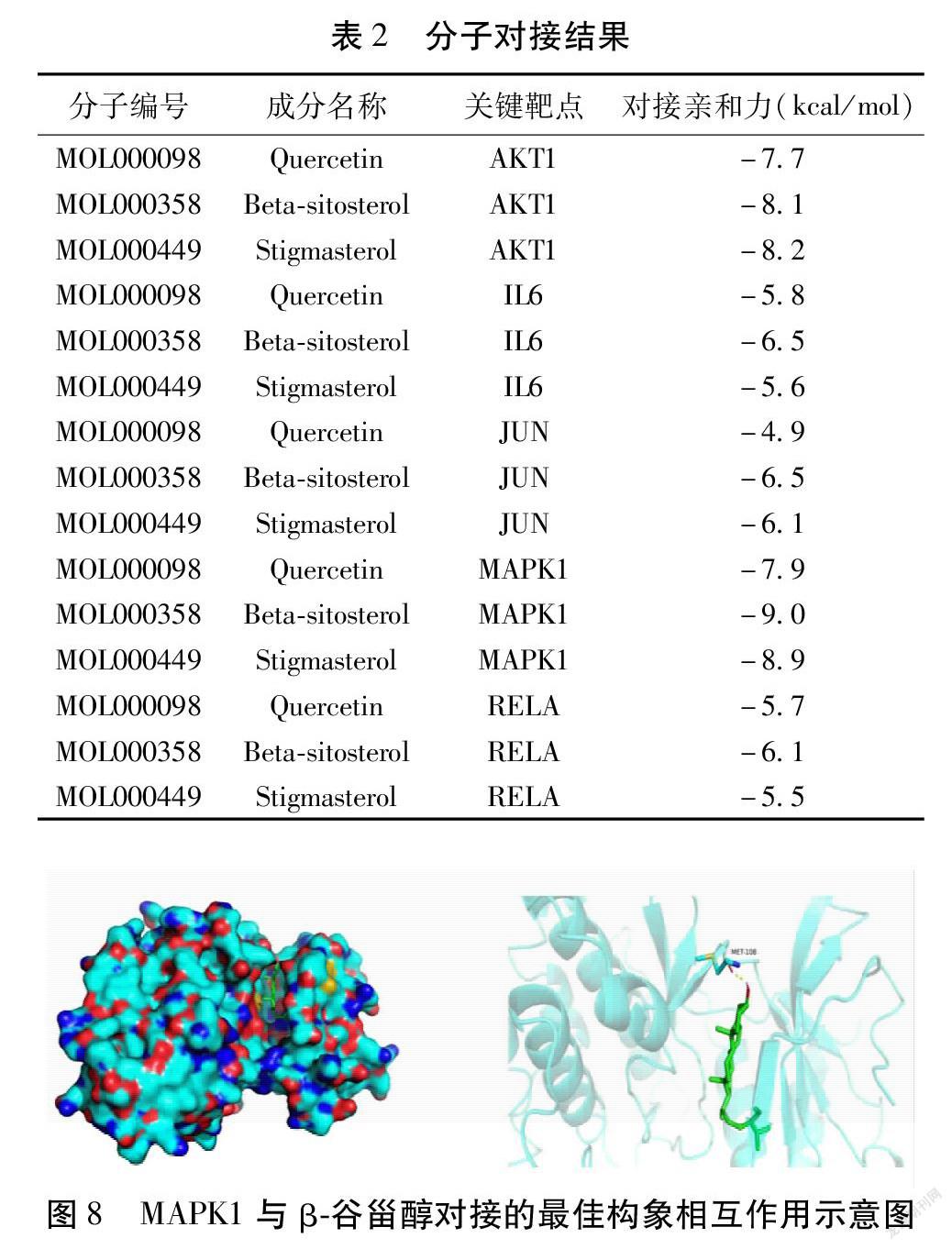
將排名前三的關鍵活性成分槲皮素、β-谷甾醇、豆甾醇與5個關鍵靶點AKT1、IL6、JUN、MAPK1、RELA進行分子對接。表格中對接的親和力越小,代表配體與受體蛋白結合更穩定,表明該藥物成分與關鍵靶點具有強結合力。見表2。結果顯示β-谷甾醇與MAPK1分子對接效果最佳。見表2。為了從分子水平闡明蛋白MAPK1與β-谷甾醇的作用模式,本研究將化合物對接至蛋白的活性口袋,其對接打分為-9.0 kcal/mol,理論結合模式如圖8所示,從圖8中可看出化合物和蛋白氨基酸MET108形成氫鍵作用,使得蛋白與化合物形成穩定的復合物。分子對接研究為蛋白與化合物的相互作用方式給予一定的解釋,為進一步研究小分子藥物奠定理論基礎。
3 討論
隨著老齡化進程的加快,到2050年預計全球癡呆癥患者的人數將增加至1.315億[10]。據國際阿爾茨海默病協會(ADI)的“世界阿爾茨海默病2020年報告”,2020新冠肺炎席卷世界,在第一波新冠肺炎疫情死亡者中,超過四分之一患有癡呆癥;全球每年新發癡呆的病例預估為990萬,大約每3.2 s增加1例,此估值較2010年新發病例高30%;全球癡呆費用亦增長超過30%。盡管目前針對AD的癥狀管理等治療藥物,乙酰膽堿酯酶抑制劑,如多奈哌齊,N-甲基-D-天冬氨酸受體拮抗劑,如美金剛胺等可延緩延遲認知障礙的進展,但AD仍未能得到有效的改善控制,提示其病理生理機制及治療尚有許多未知,亟須積極開發新的有效治療藥物[11-14]。
枸杞子具有補益肝腎之效,現代藥理學研究發現,枸杞子具有抗氧化、抗衰老、神經保護等作用,廣泛用于醫學及保健領域,臨床顯示其對AD具有一定的治療效果。但枸杞子含有多組分、多靶點,各組分之間可產生協同作用,因此形成的體系龐大復雜,想要完全了解其作用機制不易。近年來,隨著計算機技術的不斷發展和生物醫學數據庫的應用,網絡藥理學成為闡釋中藥作用機制的方法之一。
通過網絡藥理學方法,獲得枸杞子活性成分包括槲皮素、β-谷甾醇、豆甾醇等。槲皮素可降低氯化鋁誘導的AD動物模型海馬神經元的損傷[15],顯著提高β淀粉樣蛋白1-42(Aβ1-42)干預的HT-22細胞MAPK1和CYCS水平,降低MAPT、PIK3R1、CASP8和DAPK1水平,具有一定的治療AD價值[16]。有學者將卵磷脂/β谷甾醇用鞣酸包裹在非神經毒性脂質體中,發現其可以成功通過小鼠腦微血管內皮細胞血腦屏障,并且可以減少人神經母細胞瘤(SK-N-SH)細胞誘導的Tau蛋白聚集,表現出一定的抗AD作用[17]。
通過網絡藥理學研究預測,枸杞子作用的核心靶點包括JUN、AKT1、MAPK1、RELA、IL-6、APP、FOS等。JNK通路對神經發育和神經元再生至關重要,由炎癥介質或環境應激激活,在程序性細胞死亡中起重要作用,JUN及FOS是JNK通路的下游蛋白,具有調控細胞凋亡、生長、增殖等作用,目前JNK通路特異性抑制劑正在被開發,可作為神經保護藥物[18-21]。AKT磷酸化是胰島素和其他生長因子信號轉導的關鍵節點,與AD神經病理和認知功能下降有關[22]。MAPK1作為MAPKs的天然負調控因子,在MAPKs去磷酸化過程中發揮著重要作用[23]。在本次分子對接中,發現MAPK1與小分子β-谷甾醇具有較強結合活性。RELA是ApoE的一種抑制性轉錄因子,可促進β-淀粉樣蛋白(Aβ)水解分解,從而抑制β-淀粉樣蛋白異常積聚[24]。APP作為神經細胞、突觸及腦功能正常發揮所需要的物質,可以保護神經細胞對抗毒性損害,調節神經細胞的增殖、分化,并且可調節突觸傳遞和突觸可塑性,改善學習記憶障礙[25]。
通過對關鍵靶點的GO功能注釋及KEGG富集通路分析,發現GO生物過程主要集中在氧化應激反應、衰老、神經元死亡調節等上。研究表明,自由基氧化應激是導致衰老原因之一,且許多老齡化疾病的發病機制都與機體氧化應激有關,如AD、PD等[26-28]。通過對靶點KEGG富集通路分析,發現枸杞子抗AD的作用與AGE-RAGE信號通路、HIF-1信號通路等相關。晚期糖基化終產物(AGEs)與衰老和許多退行性疾病如AD、糖尿病、動脈粥樣硬化的發展也有一定的關系[29]。HIF-1是哺乳動物氧穩態的重要調節因子,隨著年齡的增長,大腦供氧及葡萄糖逐漸減少,這可能是導致低代謝的因素之一,而大腦對認知和記憶至關重要的區域,如海馬體、頂葉、顳葉、皮質等則更容易受到慢性缺氧的影響,而在AD患者中,可見這些低代謝腦部區域APP表達增強,Aβ清除減少[30-31]。
本研究運用網絡藥理學研究方法,從分子水平揭示了枸杞子抗阿爾茨海默病的可能成分及關鍵作用機制。本研究中,枸杞子治療AD的作用靶點屬于預測階段,通過建立了中藥成分-蛋白質靶標、疾病-基因的相互作用網絡圖,發現枸杞子治療AD“多成分、多靶點、多通路”的特點,并且將其PPI進行了可視化分析,初步驗證了枸杞子治療AD的藥理學作用機制,為其后續實驗提供了一定的參考依據,但后續仍需要開展體內體外實驗來驗證靶點,觀察這些靶點是否參與了藥物對疾病的調控,本研究可作為下一步實驗的前期基礎。
參考文獻
[1]Aliev G,Ashraf GM,Tarasov VV,et al.Alzheimer′s Disease-Future Therapy Based on Dendrimers[J].Curr Neuropharmacol,2019,17(3):288-294.
[2]趙明宇.枸杞子的藥理作用及臨床應用研究[J].北方藥學,2018,15(4):156.
[3]Luo Q,Cai Y,Yan J,et al.Hypoglycemic and hypolipidemic effects and antioxidant activity of fruit extracts from Lycium barbarum[J].Life Sci,2004,76(2):137-149.
[4]王瑩,金紅宇,李耀磊,等.不同分子量枸杞多糖對RAW264.7巨噬細胞的免疫調節作用[J].中國新藥雜志,2021,30(12):1079-1086.
[5]Amagase H,Farnsworth NR.A review of botanical characteristics,phytochemistry,clinical relevance in efficacy and safety of Lycium barbarum fruit(Goji)[J].Food Research International,2011,44(7):1702-1717.
[6]Hopkins AL.Network pharmacology[J].Nature Biotechnology,2007,25(10):1110-1111.
[7]趙光躍,魏玉海,蘇姍姍,等.基于1H-NMR植物代謝組學技術分析青海產區枸杞子的化學特征[J].中國實驗方劑學雜志,2020,26(17):95-103.
[8]Ru J,Li P,Wang J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014,6:13.
[9]Safran M,Dalah I,Alexander J,et al.GeneCards Version 3:the human gene integrator[J].Database(Oxford),2010,2010:baq020.
[10]Sengoku R.Aging and Alzheimer′s disease pathology[J].Neuropathology,2020,40(1):22-29.
[11]Anonymous.2020 Alzheimer′s disease facts and figures[J].Alzheimers Dement,2020,Mar 10.doi:10.1002/alz.12068.Online ahead of print.
[12]Kim S,Kim N,Lee J,et al.Dynamic Fas signaling network regulates neural stem cell proliferation and memory enhancement[J].Sci Adv,2020,6(17):eaaz9691.
[13]Galluzzi L,Vitale I,Aaronson SA,et al.Molecular mechanisms of cell death:recommendations of the Nomenclature Committee on Cell Death 2018[J].Cell Death Differ,2018,25(3):486-541.
[14]Aupperle PM.Navigating patients and caregivers through the course of Alzheimer′s disease[J].J Clin Psychiatry,2006,67(3):8-14.
[15]Rifaai RA,Mokhemer SA,Saber EA,et al.Neuroprotective effect of quercetin nanoparticles:A possible prophylactic and therapeutic role in alzheimer′s disease[J].J Chem Neuroanat,2020,107:101795.
[16]Qi P,Li J,Gao S,et al.Network Pharmacology-Based and Experimental Identification of the Effects of Quercetin on Alzheimer′s Disease[J].Front Aging Neurosci,2020,12:589588.
[17]Hu Y,Hu X,Lu Y,et al.New Strategy for Reducing Tau Aggregation Cytologically by A Hairpinlike Molecular Inhibitor,Tannic Acid Encapsulated in Liposome[J].ACS Chem Neurosci,2020,11(21):3623-3634.
[18]Coffey ET.Nuclear and cytosolic JNK signalling in neurons[J].Nat Rev Neurosci,2014,15(5):285-299.
[19]Bruckner SR,Estus S.JNK3 contributes to c-jun induction and apoptosis in 4-hydroxynonenal-treated sympathetic neurons[J].J Neurosci Res,2002,70(5):665-670.
[20]Muller FL,Lustgarten MS,Jang Y,et al.Trends in oxidative aging theories[J].Free Radic Biol Med,2007,43(4):477-503.
[21]Clarke M,Pentz R,Bobyn J,et al.Stressor-like effects of c-Jun N-terminal kinase(JNK) inhibition[J].PLoS One,2012,7(8):e44073.
[22]Arvanitakis Z,Wang HY,Capuano AW,et al.Brain Insulin Signaling,Alzheimer Disease Pathology,and Cognitive Function[J].Ann Neurol,2020,88(3):513-525.
[23]Thiel G,Rssler OG.Resveratrol stimulates AP-1-regulated gene transcription[J].Mol Nutr Food Res,2014,58(7):1402-1413.
[24]Ge X,Guo M,Hu T,et al.Increased Microglial Exosomal miR-124-3p Alleviates Neurodegeneration and Improves Cognitive Outcome after rmTBI[J].Mol Ther,2020,28(2):503-522.
[25]王珉琦,李文惠,孫安陽.分泌型β-淀粉樣蛋白前體蛋白的神經保護作用及其分子機制[J].中國生物化學與分子生物學報,2020,36(6):617-626.
[26]Simioni C,Zauli G,Martelli A M,et al.Oxidative stress:role of physical exercise and antioxidant nutraceuticals in adulthood and aging[J].Oncotarget,2018,9(24):17181-17198.
[27]Butterfield DA.Perspectives on Oxidative Stress in Alzheimer′s Disease and Predictions of Future Research Emphases[J].J Alzheimers Dis,2018,64(s1):S469-469S479.
[28]Siddique YH,Naz F,Jyoti S.Effect of capsaicin on the oxidative stress and dopamine content in the transgenic Drosophila model of Parkinson′s disease[J].Acta Biol Hung,2018,69(2):115-124.
[29]Sourris KC,Watson A,Jandeleit-Dahm K.Inhibitors of Advanced Glycation End Product(AGE) Formation and Accumulation[J].Handb Exp Pharmacol,2021,264:395-423.
[30]Semenza GL.HIF-1 mediates metabolic responses to intratumoral hypoxia and oncogenic mutations[J].J Clin Invest,2013,123(9):3664-3671.
[31]Ashok BS,Ajith TA,Sivanesan S.Hypoxia-inducible factors as neuroprotective agent in Alzheimer′s disease[J].Clin Exp Pharmacol Physiol,2017,44(3):327-334.
(2021-01-30收稿 本文編輯:魏慶雙,徐穎)

